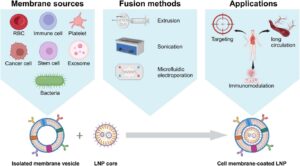
ABSTRAK
Pelapisan membran sel (CMC) nanopartikel (NP) telah muncul sebagai strategi terkemuka yang telah memperoleh perhatian signifikan dan mencapai kemajuan penting di berbagai sektor terapi. Pelapisan NP dengan membran sel alami memberinya berbagai fungsi dan mengatasi berbagai tantangan dalam penghantaran obat, seperti memperpanjang waktu sirkulasi, mengurangi imunogenisitas, dan meningkatkan efisiensi penargetan dan komunikasi seluler. Di antara berbagai NP, nanopartikel lipid (LNP) telah merevolusi bidang nanomedicine dengan menyediakan berbagai fitur menguntungkan untuk penghantaran obat. Karakteristik serbaguna LNP bersinergi dengan baik dengan sifat biomimetik membran sel, menciptakan struktur hibrida dengan fungsionalitas yang ditingkatkan untuk berbagai aplikasi biomedis. Bentuk LNP yang lebih maju dengan kemampuan yang ditingkatkan secara signifikan dapat dicapai melalui CMC. Namun, peluang signifikan tetap ada untuk kemajuan lebih lanjut, dengan upaya berkelanjutan yang difokuskan pada penemuan aplikasi inovatif dan sepenuhnya memanfaatkan potensi kombinasi yang menjanjikan ini. Artikel ini memberikan tinjauan kritis tentang kemajuan terkini dalam LNP berlapis membran sel (CMC-LNP). Pertama, berbagai jenis LNP, metode persiapannya, dan strategi pelapisannya dirangkum. Pengembangan, sifat, fungsi, dan aplikasi CMC-LNP kemudian dibahas. Terakhir, keunggulan, keterbatasan, tantangan, dan prospek masa depannya disajikan.
1 Pendahuluan
Nanopartikel lipid (LNP) telah mengubah bidang sistem penghantaran obat, menunjukkan keberhasilan besar di berbagai aplikasi. Dengan fleksibilitas dan biokompatibilitasnya yang unggul, LNP adalah alat penting untuk mengangkut dan mengantarkan beragam terapi [ 1 , 2 ]. LNP menawarkan beberapa keuntungan termasuk secara umum ditoleransi dengan baik dengan toksisitas rendah dan imunogenisitas minimal. Mereka dapat mengantarkan tidak hanya obat yang larut dalam air tetapi juga beberapa biologis. Dengan menggabungkan lipid dengan sifat fisikokimia yang terdefinisi dengan baik—seperti lipofilisitas, berat molekul, dan muatan—LNP dapat dengan mudah disesuaikan dalam ukuran dan karakteristik permukaan untuk mencapai tujuan terapi tertentu [ 1 , 3 ]. Sistem ini menawarkan kelayakan komersial untuk formulasi farmasi di berbagai rute penghantaran, termasuk aplikasi topikal, oral, parenteral, paru, dan transdermal [ 4 , 5 ].
Dengan lebih dari satu miliar dosis yang diberikan di seluruh dunia untuk COVID-19, vaksin mRNA–LNP telah menjadi salah satu produk obat yang paling banyak digunakan dalam sejarah, menggarisbawahi keunggulan LNP dalam pengiriman obat [ 2 , 6 ]. Peran protektif LNP melampaui melindungi mRNA dari degradasi. Ia juga memainkan peran penting dalam memfasilitasi penyerapan mRNA oleh sel inang. Proses yang diatur ini memastikan pengiriman mRNA ke dalam sitosol, tempat urutan mRNA mengalami translasi, yang pada akhirnya mengarah pada sintesis protein Spike [ 7 ]. Sebelum vaksin COVID-19, beberapa sistem lipid telah disetujui untuk aplikasi klinis [ 8 , 9 ]. Misalnya, persetujuan klinis Doxil berbasis liposom (LIP) pada tahun 1995 menandai tonggak penting dalam nanomedicine kanker, menjadi nanodrug pertama yang disetujui oleh Badan Pengawas Obat dan Makanan Amerika Serikat (US FDA). Doxil adalah LIP PEGylated yang mengandung doxorubicin (DOX), yang dirancang untuk pengobatan kanker payudara, multiple myeloma, kanker ovarium, dan berbagai tumor padat lainnya. Dibandingkan dengan DOX bebas, Doxil memberikan beberapa keuntungan termasuk waktu sirkulasi yang lebih lama dalam plasma, penurunan substansial dalam kardiotoksisitas, dan pemanfaatan permeabilitas dan efek retensi yang ditingkatkan, yang memungkinkan penargetan tumor secara pasif dengan baik [ 8 , 10 ]. Tonggak penting lainnya adalah persetujuan ONPATTRO pada tahun 2018, obat small interfering RNA (siRNA) pertama yang disetujui menggunakan LNP untuk mengobati amiloidosis yang dimediasi transthyretin herediter [ 11 ]. Hal ini membuka jalan bagi kemajuan dalam terapi asam nukleat, yang menjadikan LNP sebagai platform yang sukses untuk memberikan obat asam nukleat [ 12 ]. Selain itu, LNP telah digunakan sebagai nanocarrier dalam berbagai uji klinis, yang mencakup aplikasi seperti penyuntingan gen, terapi penggantian protein, dan imunoterapi kanker [ 2 , 8 , 13 ]. Berbagai macam aplikasi ini telah memposisikan LNP sebagai platform teknologi yang efektif, andal, dan terukur yang memiliki potensi luar biasa untuk menerjemahkan terapi tambahan.
Modifikasi permukaan telah diterapkan secara luas untuk meningkatkan efisiensi LNP dan mengatasi beberapa tantangan yang ada. Berbagai strategi untuk memodifikasi permukaan LNP, yang melibatkan metode kimia dan fisik, telah diterapkan. Metode kimia, seperti mencangkok polimer hidrofilik (seperti polietilen glikol (PEG) atau polisakarida/amfifil lainnya) ke permukaan LNP, dan metode fisik, seperti adsorpsi polimer, umumnya digunakan untuk merekayasa permukaan LNP [ 1 , 14 ]. Pelapisan membran sel (CMC) telah muncul sebagai metode baru untuk fungsionalisasi permukaan, menarik perhatian besar karena bioaktivitas dan biokompatibilitasnya yang sangat baik. Keragaman jenis sel menghasilkan berbagai membran sel, masing-masing dengan sifat biologis yang unik.
Dalam beberapa tahun terakhir, nanomedicine telah membuat langkah signifikan, khususnya dalam meningkatkan pengiriman yang ditargetkan, bioavailabilitas, dan kemanjuran terapeutik obat-obatan. LNP, bersama dengan nanopartikel polimer (PNP) dan nanomaterial anorganik, telah dikembangkan untuk tujuan ini. Namun, banyak dari platform ini menghadapi keterbatasan yang terus-menerus, termasuk pembersihan cepat oleh sistem fagosit mononuklear (MPS), penetrasi jaringan yang buruk, dan aktivasi kekebalan yang tidak diinginkan. CMC telah muncul sebagai strategi yang menjanjikan untuk mengatasi keterbatasan ini, menyediakan nanopartikel (NP) dengan fitur biomimetik seperti penghindaran kekebalan, sirkulasi darah yang diperpanjang, dan penargetan homotipe. Teknologi ini telah memperluas potensi terapeutik nanomedicine di berbagai model penyakit. Meskipun CMC telah menunjukkan keberhasilan substansial pada tingkat praklinis, optimasi lebih lanjut masih diperlukan dalam hal biomimikri, keamanan, dan kelayakan translasi, terutama untuk aplikasi klinis. Integrasi teknologi CMC dengan LNP telah menghasilkan pengembangan LNP berlapis membran sel (CMC-LNP)—sistem hibrida yang menggabungkan fleksibilitas struktural dan biokompatibilitas LNP dengan kemampuan penargetan dan imunomodulasi membran alami [ 15 – 17 ]. Hasilnya, CMC-LNP menawarkan platform yang sangat menjanjikan untuk sistem pengiriman nanomedicine generasi berikutnya.
Meskipun banyak ulasan telah membahas teknologi LNP atau CMC, analisis khusus dan sistematis yang berfokus pada CMC-LNP masih belum ada [ 8 , 18 – 20 ]. Literatur yang ada cenderung menggeneralisasi jenis NP atau menekankan inti polimer/anorganik, mengabaikan sifat fisikokimia yang unik, biokompatibilitas, dan keuntungan translasi dari sistem berbasis lipid. Sebaliknya, ulasan ini menyajikan evaluasi terfokus dan komparatif LNP sebagai platform inti untuk pelapisan membran, termasuk persiapan, integrasi fungsional, dan aplikasi terapeutik CMC-LNP. Kami selanjutnya memberikan analisis kritis tentang keamanan, stabilitas, dan tantangan translasi klinisnya, menawarkan sumber daya terkini dan praktis bagi para peneliti di lapangan (Gambar 1 ). Ini membedakan pekerjaan kami dari publikasi sebelumnya dan menyoroti semakin pentingnya LNP dalam pengembangan sistem penghantaran obat yang terinspirasi secara biologis di masa depan.
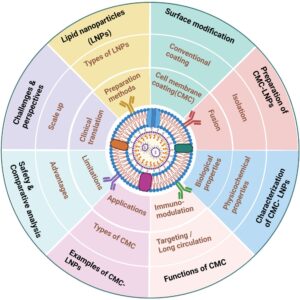
2 Nanopartikel Lipid
Dengan mengubah komposisi dan metode persiapan, berbagai LNP dapat dibuat dengan karakteristik unik (Gambar 2 ) untuk pengiriman obat dan tujuan biomedis lainnya.
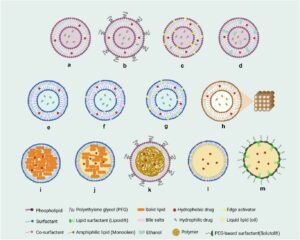
2.1 Berbagai Jenis LNP
2.1.1 Sistem Pengiriman Liposomal dan Vesikular
LIP (Gambar 2a ), sebagai model klasik LNP, terutama dibangun dengan satu atau lebih lapisan ganda fosfolipid. Mereka telah berevolusi secara signifikan, berkembang dari konseptualisasi ke aplikasi praktis dalam pengaturan klinis, dan mendapatkan persetujuan untuk berbagai formulasi farmasi [ 8 ]. Ditandai dengan ukurannya yang kecil, LIP terdiri dari fosfolipid alami atau sintetis [ 21 ]. Mereka adalah pembawa obat serbaguna karena biodegradabilitasnya, biokompatibilitasnya, toksisitasnya yang rendah, dan kemampuan untuk merangkum obat hidrofilik dalam kompartemen berair sentral dan yang hidrofobik dalam lapisan ganda lipid. Selain itu, LIP menunjukkan kemampuan merakit sendiri dan menyajikan cakupan karakteristik biofisik dan fisikokimia yang luas yang dapat disesuaikan untuk menyesuaikan fitur biologisnya [ 22 – 24 ]. Fosfolipid dalam larutan menunjukkan karakteristik amfifilik yang sangat mirip dengan membran sel alami, mendorong hubungan yang kuat antara LIP dan membran sel mamalia. Interaksi ini sangat meningkatkan efektivitas penyerapan seluler [ 25 ]. Selain fosfolipid, LIP dapat menggabungkan komponen tambahan untuk meningkatkan stabilitasnya, termasuk kolesterol, PEG, propilen glikol, dan kitosan (CS). Komponen tambahan ini memiliki efek signifikan pada jaringan sehat, berpotensi memengaruhi sistem imun melalui aktivasi atau penekanan [ 23 ].
Integrasi PEGylation ke dalam LIP (Gambar 2b ) menandai kemajuan signifikan atas LIP tradisional. Modifikasi ini sangat mengurangi penyerapan oleh MPS, yang mengarah pada sirkulasi darah yang lebih lama, peningkatan stabilitas, dan perbaikan distribusi jaringan, yang pada gilirannya menghasilkan peningkatan farmakokinetik [ 26 ]. Inovasi ini membuka jalan bagi keberhasilan Doxil [ 27 ]. Umur sirkulasi LIP yang lebih lama yang dicapai melalui PEGylation dipengaruhi oleh kepadatan PEG pada permukaan partikel dan berat molekul polimer [ 23 ]. Mereka juga dapat direkayasa untuk merespons berbagai rangsangan, termasuk suhu, pH, cahaya, redoks, ultrasound, enzim, dan rangsangan eksternal magnetik. Lebih jauh lagi, modifikasi permukaan dengan komponen seperti antibodi, aptamer, peptida, dan ligan penargetan dapat meningkatkan pengiriman yang ditargetkan [ 27-29 ] .
Meskipun LIP telah banyak dieksplorasi untuk penghantaran obat secara dermal dan transdermal, ketidakstabilan bawaannya dan permeabilitas kulit yang tidak memadai menimbulkan keterbatasan pada aplikasi penghantaran topikalnya. Untuk mengatasi tantangan ini, kategori baru vesikel elastis (ultra-dapat-diubah bentuk) seperti transfersom dan etosom dikembangkan [ 30 , 31 ].
Transfersom (Gambar 2c ), yang dicirikan oleh fleksibilitas dan elastisitasnya yang luar biasa, terdiri dari fosfolipid dan surfaktan (seperti Span 20, Tween 80, dan natrium kolat) yang berfungsi sebagai aktivator tepi untuk meningkatkan fleksibilitas. Kemampuan deformasinya yang luar biasa memfasilitasi peningkatan penetrasi kulit, menjadikannya pembawa yang efektif untuk obat-obatan dengan berat molekul tinggi dan rendah untuk berbagai zat terapeutik, termasuk vaksin, protein, dan obat antikanker [ 32 , 33 ]. Transfersom berlaku untuk pengiriman obat topikal dan transdermal, menunjukkan kemampuannya untuk menembus pori-pori yang lebih kecil (5–10 kali) dari diameternya [ 33 ]. Namun, terlepas dari kelebihan ini, stabilitas yang buruk tetap menjadi kelemahan utama untuk transfersom yang sangat dapat dideformasi, terutama karena reaksi oksidasi [ 34 ].
Etosom (Gambar 2d ), yang didefinisikan oleh vesikel lipid elastis yang mengandung fosfolipid dan campuran etanol-air pekat, menggunakan etanol sebagai peningkat permeasi yang terkenal. Etanol dapat menembus lipid interseluler dan meningkatkan fluiditas lipid membran sel. Hal ini, pada gilirannya, memfasilitasi pengiriman dan permeabilitas berbagai molekul termasuk peptida dan protein [ 35 , 36 ]. Peningkatan fleksibilitas juga mengurangi kerapuhan vesikel, mengurangi kebocoran obat hingga mencapai target yang ditentukan. Akibatnya, hal ini meningkatkan konsentrasi obat secara keseluruhan di tempat terapeutik [ 36 ]. Sangat penting untuk mempelajari secara menyeluruh keamanan formulasi ini untuk mengurangi risiko iritasi kulit yang disebabkan oleh etanol [ 37 ]. Versi etosom yang disempurnakan, yaitu transetosom dan invasom, masing-masing menggabungkan surfaktan dan terpene sebagai aktivator tepi ke dalam struktur etosom standar, untuk meningkatkan interaksinya dengan membran sel, sehingga meningkatkan penetrasi intraseluler [ 38 ].
Niosom (Gambar 2e ) adalah vesikel berlapis ganda yang terbentuk dari surfaktan nonionik dan zat bermuatan netral. Meskipun sebagian besar terdiri dari surfaktan, niosom juga dapat menggabungkan kolesterol sebagai agen penstabil dalam membran vesikularnya. Mirip dengan pembawa vesikular lainnya, niosom dapat membungkus obat hidrofobik dan hidrofilik dalam lapisan ganda dan intinya, masing-masing [ 39 ]. Dibandingkan dengan LIP, niosom menawarkan beberapa keuntungan seperti efektivitas biaya, peningkatan stabilitas kimia, dan kemudahan formulasi dan peningkatan skala [ 39 , 40 ]. Mereka juga menunjukkan fleksibilitas dalam penghantaran obat melalui berbagai rute, termasuk penetrasi oral, transdermal, okular, paru, dan sawar darah-otak (BBB) [ 39 ]. Versi niosom yang dikeringkan, disebut proniosom, terdiri dari pembawa yang larut dalam air yang dilapisi surfaktan nonionik. Proniosom perlu dihidrasi sebelum digunakan, diubah menjadi dispersi niosom berair [ 41 ]. Mengingat bahwa proniosom berada dalam bentuk kering, mereka memberikan manfaat dibandingkan niosom, mengurangi masalah seperti fusi, agregasi, dan penggumpalan dan membuat transportasi dan distribusi lebih nyaman [ 39 , 41 ]. Niosom PEGylated dan etosom surfaktan juga menunjukkan waktu sirkulasi darah yang lebih baik dan pengiriman transdermal yang ditingkatkan, masing-masing [ 39 , 42 ].
Bilosom (Gambar 2f ) adalah vesikel dwi lapis yang terdiri dari surfaktan nonionik seperti niosom konvensional tetapi mengandung garam empedu. Karakteristik uniknya meliputi dimensi partikel berukuran nano, deformabilitas luar biasa, dan fleksibilitas yang luar biasa. Menyertakan garam empedu dalam komposisinya memberikan perlindungan signifikan terhadap tantangan seperti pH asam dan pencernaan enzimatik di saluran gastrointestinal (GIT) [ 43 , 44 ]. Sifat bilosom yang dapat dideformasi meningkatkan penyerapannya oleh sel-sel usus, membuatnya sangat efektif untuk pengiriman makromolekul biologis secara oral dibandingkan dengan sistem pengiriman tradisional [ 45 , 46 ]. Fitur-fitur unik ini memposisikan bilosom sebagai nanocarrier yang menjanjikan untuk meningkatkan efisiensi pengiriman obat, terutama dalam skenario di mana perlindungan terhadap kondisi fisiologis yang keras dan optimalisasi penyerapan sel target sangat penting.
Spanlastik (Gambar 2g ), jenis nanovesikel berbasis surfaktan yang inovatif dan sangat fleksibel, terdiri dari Span (surfaktan nonionik) dan aktivator tepi. Mereka memiliki potensi yang cukup besar sebagai sistem pengiriman dibandingkan dengan niosom tradisional, dengan elastisitas yang ditingkatkan dikaitkan dengan adanya aktivator tepi [ 47 , 48 ]. Mereka menawarkan struktur yang dapat dideformasi dan multilamelar yang unggul, kemampuan penjebakan yang lebih efisien [ 48 ], dan profil pelepasan obat yang lebih baik [ 49 ]. Sifat lipofilik Span 60 sangat penting untuk pembentukan vesikel lamelar. Vesikel yang terutama terdiri dari Span 40 (nilai keseimbangan hidrofilik-lipofilik [HLB] 6,7) dan Span 80 (nilai HLB 4,3) menunjukkan gangguan, ketidakstabilan, dan agregasi yang signifikan dibandingkan dengan yang berbasis Span 60 (nilai HLB 4,7), yang stabil. Penambahan etanol memberikan karakteristik khusus pada vesikel, yang memengaruhi ukuran, stabilitas, efektivitas penjebakan, dan permeabilitas kulit. Namun, mempertahankan tingkat etanol yang optimal sangat penting untuk menjaga permeabilitas dan sifat permukaan [ 48 ].
Kubosom (Gambar 2h ) memiliki komposisi struktural yang khas dengan lapisan lipid ganda yang melengkung dan berkesinambungan yang memanjang dalam tiga dimensi, membentuk dua sistem saluran air yang saling berhubungan. Komponen utama kubosom adalah lipid amfifilik, seperti gliseril monooleat (GMO atau monoolein) dan fitantriol (PHYT), yang merakit diri dalam air untuk menciptakan struktur kubik bikontinu yang menstabilkan kubosom. Stabilisator seperti Poloxamer 407 juga penting untuk menjaga stabilitas koloid dan mencegah reagregasi ke dalam fase massal. Kubosom muncul sebagai pembawa vesikular obat yang menjanjikan untuk berbagai zat, termasuk senyawa hidrofilik, amfifilik, dan hidrofobik, dari obat molekul kecil hingga biomolekul yang lebih besar seperti protein, peptida, asam amino, dan asam nukleat [ 50 , 51 ]. Berbeda dengan LIP lamelar, kubosom menawarkan inti bagian dalam yang kaya lipid secara seragam, yang memungkinkannya menampung zat hidrofobik pada konsentrasi hingga tiga kali lebih tinggi daripada LIP tradisional [ 52 , 53 ]. Stabilitas koloid adalah atribut utama kubosom, meningkatkan efektivitasnya dalam pengiriman obat dengan melindungi molekul yang dienkapsulasi dari oksidasi, degradasi, dan faktor lingkungan, dan mendukung pengembangan sistem pengiriman pelepasan berkelanjutan [ 54 ].
2.1.2 Nanopartikel Lipid Padat
Nanopartikel lipid padat (SLN) (Gambar 2i ) adalah pembawa obat yang biokompatibel dan biodegradable yang terdiri dari inti lipid padat yang terbungkus dalam cangkang surfaktan luar. SLN menawarkan keuntungan seperti persiapan sederhana, stabilitas fisik, perlindungan obat labil dari degradasi, dan potensi pelepasan obat yang berkelanjutan. Namun, mereka juga memiliki keterbatasan termasuk kapasitas pemuatan obat yang rendah dan potensi kebocoran obat selama penyimpanan [ 55 , 56 ]. Pembawa lipid berstruktur nano (NLC) (Gambar 2j ), yang mewakili generasi kedua SLN, terdiri dari matriks padat yang memiliki berbagai kompartemen lipid cair. Struktur ini meningkatkan pemuatan obat, memungkinkan pelepasan obat yang terkendali, dan meminimalkan risiko pengeluaran obat selama penyimpanan [ 57 ]. Struktur amorf inti NLC mencegah pengeluaran obat, terutama ketika obat lebih larut dalam lipid cair. Gumpalan minyak kecil tersebar merata di inti lipid padat, memfasilitasi pelepasan obat secara bertahap dari tetesan minyak ini [ 58 ]. Stabilitas fisik dan kimia NLC yang diperpanjang dikaitkan dengan kristalinitasnya yang menurun dan risiko pengeluaran obat yang berkurang [ 8 , 58 ]. Baik SLN maupun NLC menggabungkan lipid (seperti alkohol lemak, asam lemak, lilin, dan gliserida) dan agen penstabil (seperti surfaktan dan zat pelapis). Surfaktan pada antarmuka lipid–air menurunkan tegangan antarmuka, meningkatkan stabilitas formulasi. Metode produksi untuk SLN dan NLC umumnya menghindari pelarut organik, menggunakan teknik seperti homogenisasi tekanan tinggi (HPH), ultrasonikasi, pengadukan berkecepatan tinggi, dan injeksi pelarut [ 8 , 59 ]. Selain itu, permukaan SLN dan NLC yang dimodifikasi telah dikembangkan untuk memperpanjang waktu tinggal mereka di lapisan mukosa, seperti target GIT dan mata, dan untuk mencapai pengiriman yang ditargetkan ke area tubuh tertentu [ 58 , 60 ].
2.1.3 Nanokapsul Lipid
Lipid nanocapsules (LNCs) (Gambar 2m ) terdiri dari inti berminyak hidrofobik yang distabilkan oleh kombinasi surfaktan lipid dan surfaktan PEGylated. Dengan mengubah komposisi LNC, sifat-sifatnya dapat divariasikan secara signifikan, memungkinkan persiapan kapsul dalam berbagai ukuran untuk memenuhi aplikasi tertentu. LNC dapat merangkum molekul hidrofobik dan hidrofilik [ 61 , 62 ], menawarkan beberapa keuntungan, seperti pelepasan obat yang berkelanjutan, potensi pemuatan obat yang tinggi, skalabilitas dalam pembuatan, dan stabilitas fisik yang kuat [ 63 , 64 ]. Lesitin adalah surfaktan lipofilik yang banyak digunakan, dengan Lipoid menjadi jenis yang paling mapan. Solutol, surfaktan PEGylated yang berasal dari PEG, adalah jenis lain yang umum digunakan, terdiri dari PEG 660 hidroksistearat dan PEG 660. Karakteristik amfifilik Solutol dihasilkan dari kombinasi PEG hidrofilik dengan hidroksistearat hidrofobik [ 65 ]. LNC telah menunjukkan janji dalam mengatasi BBB dan penghalang darah-cairan serebrospinal, meningkatkan bioavailabilitas obat di otak. Sistem ini telah berhasil diterapkan dalam berbagai konteks medis dan biomedis [ 65 ]. Rantai PEG pada permukaan LNC dapat menghindari penyerapan sistem retikuloendotelial (RES), memastikan sirkulasi plasma yang diperpanjang [ 65 ]. Untuk enkapsulasi obat lipofilik, LNC terbukti lebih efisien dibandingkan dengan LIP [ 66 ], karena obat dalam LNC tidak terbagi menjadi beberapa kompartemen berminyak [ 65 , 67 ]. Untuk menjaga stabilitas dan efektivitas biofarmasi LNC, terutama selama proses pengeringan beku, sangat penting untuk menjaga rasio seimbang Solutol/Lipoid [ 68 ].
2.1.4 Nanopartikel Lipid Lainnya
Nanopartikel lipid–polimer (LPNP) telah direkayasa untuk memanfaatkan keunggulan komplementer dari komponen lipid dan polimer. Komponen polimer merupakan bagian integral dalam mengatur pelepasan obat yang terkontrol, sementara komponen lipid secara signifikan meningkatkan efisiensi enkapsulasi obat, permeabilitas membran, dan biokompatibilitas. Kombinasi sinergis ini menghasilkan peningkatan kinerja in vivo, waktu sirkulasi yang lebih lama, dan hasil terapi yang lebih efektif [ 69 – 71 ]. LPNP dapat diformulasikan menggunakan kombinasi lipid dan polimer alami, sintetis, atau semi-sintetik, yang masing-masing memberikan sifat fisikokimia yang berbeda. Struktur hibridanya memungkinkannya berfungsi sebagai nanocarrier serbaguna untuk berbagai macam agen terapeutik, termasuk sistem penghantaran obat ganda dan perawatan berbasis asam nukleat. Selain itu, permukaannya dapat dengan mudah dimodifikasi untuk meningkatkan penargetan, stabilitas, dan biokompatibilitas [ 72 ]. LPNP direkayasa dalam berbagai konfigurasi tergantung pada distribusi komponen lipid dan polimer dalam struktur NP. Inti polimer–cangkang lipid NP (Gambar 2k ) adalah yang paling banyak dipelajari, yang memiliki inti polimer yang dikelilingi oleh cangkang yang terbuat dari lipid dan konjugat lipid–PEG. Jenis LPNP lainnya termasuk nanobin yang dikurung polimer, di mana lapisan polimer tambahan melapisi permukaan NP, dan LPNP monolitik, di mana lipid tertanam dalam matriks polimer. Inti berongga lipid–polimer–lipid NP memiliki lapisan lipid sentral dengan lapisan tengah berbasis polimer, sedangkan lapisan terluar biasanya terdiri dari lipid dan PEG. Beberapa teknik telah dikembangkan untuk sintesis LPNP, termasuk emulsifikasi–penguapan pelarut, nanopresipitasi, dan metode pemanasan berair [ 69 , 72 ].
Nanoemulsi (NE) merupakan dispersi minyak dan fase air yang transparan dan stabil, yang distabilkan oleh lapisan antarmuka yang terdiri dari molekul surfaktan dan kosurfaktan. Konfigurasi ini menjamin keberadaan droplet yang sangat kecil, biasanya berukuran dalam kisaran 20–200 nm. NE ini menunjukkan janji yang signifikan dalam penghantaran obat, dengan rute pemberian yang serbaguna seperti formulasi topikal, oral, inhalasi, dan injeksi. Produksi yang mudah, kapasitas solubilisasi yang lebih tinggi, stabilitas yang lebih lama, variabilitas intrapasien yang berkurang, dan masa simpan yang lebih lama merupakan beberapa keuntungan yang ditawarkan oleh NE. Lebih jauh, NE dilaporkan dapat meningkatkan penyerapan limfatik, sehingga meningkatkan bioavailabilitas obat dan mengurangi efek samping sistemiknya [ 73 – 75 ]. NE diklasifikasikan berdasarkan komposisi dan distribusi relatif fase terdispersi internal dan fase kontinu yang dominan. Mereka dikategorikan sebagai bifasik (W/O atau O/W; Gambar 2l ) atau sebagai beberapa NE (W/O/W). Dalam kasus emulsi O/W, tetesan minyak/lipid dapat terdiri dari minyak nabati alami, trigliserida rantai pendek, trigliserida rantai menengah yang dimodifikasi, atau trigliserida rantai panjang. Berbagai surfaktan, seperti lesitin, tween, span, dan famili poloxamer, dapat digunakan, bersama dengan kosurfaktan umum seperti propilen glikol, PEG, etanol, dan gliserin [ 74 , 76 ]. Produksi NE dapat dicapai dengan menggunakan metode berenergi tinggi (misalnya, HPH) atau pendekatan berenergi rendah yang bergantung pada proses emulsifikasi spontan [ 75 ]. Sistem penghantaran obat nanoemulsifikasi diri (SNEDDS) adalah prakonsentrat NE atau bentuk NE anhidrat. Setelah diencerkan dengan media berair, seperti cairan gastrointestinal, mereka secara otomatis membentuk tetesan NE. SNEDDS menghadirkan banyak manfaat, termasuk peningkatan stabilitas kimia dan fisik, potensi untuk dimasukkan ke dalam bentuk dosis yang lebih diinginkan, dan tidak ada masalah rasa. Sistem ini menunjukkan janji yang signifikan dalam meningkatkan bioavailabilitas obat dengan kelarutan air yang buruk [ 77 , 78 ].
2.2 Metode Persiapan LNP
2.2.1 Homogenisasi Tekanan Tinggi
HPH adalah metode yang andal, mapan, dan digunakan secara luas untuk produksi skala besar. HPH telah lama digunakan dalam memproduksi NE untuk nutrisi parenteral [ 79 , 80 ], dan baru-baru ini menjadi teknik utama untuk memproduksi SLN dan NLC. Metode ini melibatkan pemaksaan cairan melalui celah berukuran mikron pada tekanan tinggi berkisar antara 100 hingga 2000 bar, menghasilkan kecepatan tinggi melebihi 1000 km/jam. Gaya kavitasi dan tegangan geser yang dihasilkan secara efektif memecah partikel menjadi ukuran yang lebih kecil [ 80 , 81 ]. HPH dapat dicapai baik pada suhu tinggi (homogenisasi panas) atau di bawah suhu kamar (homogenisasi dingin). Dalam kedua metode, langkah awal melibatkan penggabungan kargo ke dalam lipid massal dengan melarutkan atau mendispersikannya dalam lelehan lipid [ 82 ]. Homogenisasi panas, yang dilakukan di atas titik leleh lipid, dapat dianggap sebagai homogenisasi emulsi. Pra-emulsi dibuat dengan mencampur lelehan obat-lipid dengan fase air pada suhu yang sama menggunakan mixer geser tinggi. Suhu tinggi biasanya menghasilkan ukuran partikel yang lebih kecil karena viskositas yang berkurang, tetapi suhu tinggi juga dapat mempercepat degradasi pembawa dan obat. Peningkatan tekanan homogenisasi atau jumlah siklus dapat menyebabkan ukuran partikel yang lebih besar, karena penggabungan partikel dari peningkatan energi kinetik [ 80 , 83 ].
Homogenisasi dingin, di sisi lain, menggunakan lipid padat dan menyerupai penggilingan suspensi di bawah tekanan tinggi. Metode ini dikembangkan untuk mengatasi masalah seperti degradasi obat pada suhu yang lebih tinggi, distribusi obat ke seluruh fase berair selama homogenisasi, dan tantangan dalam langkah kristalisasi saat membuat NE. Sementara homogenisasi dingin bertujuan untuk meminimalkan paparan termal, beberapa paparan tidak dapat dihindari karena pencairan awal campuran obat/lipid [ 80 ]. Berbagai jenis LNP telah dikembangkan menggunakan HPH termasuk NLC [ 84 ], LIP [ 85 ], SLN [ 86 ], dan niosom [ 87 ].
2.2.2 Teknik Mikrofluida
Lanskap produksi LNP kecil telah mengalami pergeseran transformatif dengan munculnya perangkat mikrofluida. Perangkat ini menawarkan proses yang inovatif, berkelanjutan, dan dapat direproduksi dalam satu langkah [ 88 – 90 ]. Biasanya, lipid dilarutkan dalam pelarut yang dapat bercampur dengan air, dan komponen aktif (seperti RNA, protein, atau obat-obatan) dilarutkan dalam fase berair. Surfaktan juga dapat ditambahkan, tergantung pada persyaratan khusus formulasi. Ketika pelarut dan fase berair dicampur dalam perangkat mikrofluida, hal itu memicu supersaturasi lipid, yang mengarah pada presipitasi LNP [ 91 , 92 ]. Banyak mikromixer telah dikembangkan untuk meningkatkan efisiensi pencampuran [ 93 , 94 ]. Di antara mereka, mikromixer herringbone staggered (SHM) telah digunakan secara luas (Gambar 3a ) [ 95 , 96 ]. SHM menawarkan pencampuran yang cepat dan tepat, menghasilkan NP dengan distribusi ukuran sempit sekitar 20–50 nm [ 97 ]. Selama dekade terakhir, berbagai struktur mikrofluida telah dirancang untuk produksi LNP, termasuk baffle mixer (Gambar 3c ) [ 88 ], T-junction mixer (Gambar 3d ) [ 98 ], dan flow-focusing micromixer (Gambar 3b ) [ 99 ].
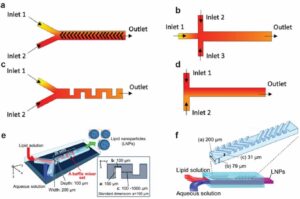
Dalam beberapa tahun terakhir, banyak perangkat mikrofluida telah dikembangkan untuk memproduksi LNP, berkontribusi pada berbagai platform pengiriman seperti RNA, DNA, obat-obatan, dan sistem pengiriman NP lainnya [ 103 , 104 ]. Selain itu, perangkat mikrofluida yang tersedia secara komersial seperti NanoAssemblr (Gambar 3e ) dan iLiNP (Gambar 3f ) secara aktif digunakan untuk membuat LNP untuk pengiriman RNA [ 103 , 105 ]. Baik Pfizer/BioNTech dan Moderna Therapeutics telah mengeksploitasi teknologi mikrofluida berskala besar untuk produksi massal vaksin COVID-19. Hal ini menyoroti peran penting mikrofluida dalam mengatasi tantangan kesehatan global [ 106 , 107 ].
2.2.3 Nanopresipitasi
Nanopresipitasi adalah teknik sederhana untuk membuat LNP, yang menawarkan potensi skalabilitas yang unggul tanpa memerlukan gaya geser tinggi, suhu tinggi, atau tekanan yang meningkat. Metode ini melibatkan pelarutan lipid dalam pelarut organik seperti etanol atau aseton, yang kemudian dicampur dengan air, yang menyebabkan supersaturasi lipid padat dalam campuran lipid-air, yang mengarah pada presipitasi LNP [ 109 ]. Dibandingkan dengan metode fabrikasi lainnya, nanopresipitasi menguntungkan karena prosesnya yang sederhana dan satu langkah untuk membuat LNP dengan karakteristik yang terkontrol, tanpa memerlukan masukan energi eksternal. Hal ini menjadikannya metode yang efisien, fleksibel, dan hemat biaya [ 110 , 111 ].
Efek Marangoni, fenomena kompleks dan kumulatif yang timbul dari interaksi aliran, difusi, dan perubahan tegangan permukaan pada antarmuka dua pelarut yang dapat bercampur, secara signifikan memengaruhi proses nanopresipitasi [ 112 ]. Nanopresipitasi massal, meskipun menguntungkan dalam berbagai aspek, menghadapi keterbatasan dalam mengendalikan dinamika fluida, sehingga menghasilkan NP dengan distribusi ukuran yang lebih luas, terutama dalam produksi skala besar dan volume pencampuran yang substansial. Selain itu, pencampuran yang tidak memadai dapat menyebabkan ketidakkonsistenan dalam kualitas dan sifat NP antar batch, sehingga tidak praktis untuk produksi skala besar [ 3 ].
Tantangan lain yang terkait dengan metode ini adalah rendahnya kandungan obat dalam NP, biasanya di bawah 10 wt% [ 113 ]. Hal ini muncul dari perbedaan waktu presipitasi lipid dan obat. Ketika lipid mengendap lebih cepat daripada obat, obat dapat mengkristal atau teragregasi tanpa dienkapsulasi oleh lipid, sehingga menghasilkan enkapsulasi obat minimal dalam LNP [ 114 , 115 ]. Untuk mengatasi hal ini, teknologi nanopresipitasi sekuensial yang baru-baru ini dikembangkan memungkinkan peningkatan kontrol atas presipitasi obat dan lipid, sehingga memungkinkan pembentukan LNP dengan kandungan obat yang dapat disesuaikan, mulai dari nilai rendah hingga tinggi [ 116 , 117 ]. Xu et al. [ 117 ] melaporkan penggunaan nanopresipitasi sekuensial yang dikontrol konsentrasi untuk mensintesis LNP dengan kandungan obat yang tinggi (Gambar 4b ). Dengan mengendalikan konsentrasi lipid dan komposisi pelarut, mereka membuat beberapa LNP yang mengandung obat yang berbeda, sehingga mencapai kandungan obat dari 1 hingga 70 wt% [ 117 ].
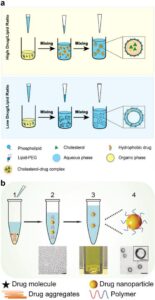
Selama bertahun-tahun, banyak metode telah dieksplorasi untuk membuat NP lebih biokompatibel dan fungsional. Modifikasi permukaan NP telah berperan penting dalam meningkatkan stabilitas fisikokimia mereka, mengurangi imunogenisitas, meningkatkan biokompatibilitas, memungkinkan pengiriman target yang tepat, mencapai pelepasan obat yang terkendali, dan meminimalkan efek off-target. Hal ini pada akhirnya mengarah pada kinerja terapi yang unggul dan peningkatan bioavailabilitas dalam aplikasi pengiriman obat [ 1 , 118 ]. Berbagai bagian melekat pada permukaan NP untuk mengoptimalkan kinerjanya dalam sistem biologis. Salah satu metode memerlukan pelapisan NP dengan zat polimer, baik sintetis maupun alami. Polimer alami meliputi polisakarida seperti dekstran, asam hialuronat (HA), asam polisialat, heparin, dan CS. Polimer sintetis, di sisi lain, meliputi PEG, poliakrilamida, polivinil pirolidon, dan kopolimer berbasis PEG seperti polisorbat dan poloksamer [ 119 ].
HA telah diteliti secara ekstensif sebagai bahan pelapis untuk berbagai LNP karena biokompatibilitasnya, biodegradabilitasnya, dan kemampuan penargetannya dalam berbagai aplikasi biomedis [ 120 – 122 ]. HA diketahui mengikat reseptor permukaan sel seperti reseptor hialuronan endotel pembuluh limfatik 1 (LYVE-1), reseptor untuk motilitas yang dimediasi hialuronan (RHAMM), dan CD44 [ 123 ], dan juga menunjukkan afinitas yang seragam untuk semua isoform CD44. Dalam sebuah penelitian oleh Shen et al. [ 124 ], pemberian HA–SLN yang dimuat paclitaxel (PTX) menunjukkan pengiriman PTX intraseluler yang baik, menghasilkan apoptosis in vitro yang signifikan pada sel CD44+. Dalam model metastasis paru-paru menggunakan sel B16F10-CD44+, PTX–HA–SLN menunjukkan spesifisitas yang sangat baik dalam penargetan dan akumulasi di jaringan tumor, yang mengarah ke efek antitumor yang nyata tanpa efek samping [ 124 ]. NP berlapis HA juga menunjukkan spesifisitas yang berkurang untuk reseptor hati dan akumulasi hati yang lebih rendah, yang memfasilitasi akumulasi yang lebih besar di lokasi tumor [ 125 ]. Selain itu, hialuronidase, yang umumnya terdapat dalam matriks ekstraseluler (ECM) asam tumor, memainkan peran penting dalam perkembangan tumor, metastasis, dan invasi [ 126 ].
PEG berfungsi sebagai bahan pelapis yang sangat umum untuk memodifikasi NP untuk memperpanjang sirkulasi mereka dalam aliran darah [ 118 ]. Rantai PEG menyediakan lapisan polimer yang fleksibel, yang menginduksi halangan sterik dan mencegah penyerapan protein serum yang tidak spesifik [ 127 – 129 ]. Meskipun ada kemajuan dalam PEGylation, kekhawatiran yang meningkat berkaitan dengan respons imun yang ditimbulkan terhadap bagian PEGylated termasuk obat-obatan, protein, dan NP [ 119 ]. Dalam sebuah studi tahun 2018, Neun dan rekannya [ 130 ] menyelidiki antibodi terhadap PEG dan aktivasi sistem komplemen sebagai respons terhadap LIP PEGylated yang dimuat DOX. Terapi PEGylated lainnya, seperti asparaginase PEGylated, merangsang pembentukan antibodi anti-PEG [ 131 ]. NP berlapis PEG ini menghadapi penghapusan yang lebih cepat oleh RES, pembersihan yang cepat dari sirkulasi darah, dan biodistribusi yang buruk [ 132 ]. Untuk mengatasi masalah ini, berbagai polimer telah dikembangkan untuk meningkatkan hidrofilisitas dan biokompatibilitas [ 133 – 135 ].
Satu pendekatan umum melibatkan penggunaan polimer mukoadhesif sebagai lapisan pelapis, yang meningkatkan retensi NP pada permukaan mukosa, sehingga memastikan paparan yang lama, pelepasan yang terkendali, dan peningkatan penetrasi jaringan di lokasi yang diinginkan [ 1 , 136 , 137 ]. Selain itu, pelapis yang responsif terhadap rangsangan seperti yang sensitif terhadap pH atau aktivitas enzimatik, memungkinkan pelepasan obat spesifik lokasi dalam lingkungan mikro tumor (TME) yang asam atau jaringan yang meradang [ 1 , 138 ]. Selain itu, konjugasi dengan ligan penargetan seperti peptida, antibodi, asam folat, dan mannosa dapat secara signifikan meningkatkan penargetan aktif dengan mengikat reseptor permukaan sel tertentu [ 1 ]. Misalnya, NP yang difungsikan oleh mannosa dapat secara selektif menargetkan reseptor mannosa yang diekspresikan pada sel kanker dan/atau makrofag, membuatnya sangat berguna dalam terapi kanker dan pengiriman vaksin [ 1 , 139 ].
3 CMC-LNP
Upaya ekstensif telah didedikasikan untuk meningkatkan daya tahan dan efisiensi LNP dengan mencari strategi pelapisan baru untuk mengatasi tantangan yang terkait dengan konjugasi polimer ke permukaan LNP. Teknik CMC telah mendapatkan banyak perhatian dan popularitas sebagai bahan siluman untuk LNP, memperkenalkan membran dengan lapisan protein yang melekat. Ini tidak hanya memfasilitasi penargetan sel-sel tertentu yang tepat tetapi juga memungkinkan LNP untuk menghindari sistem imun. Desain ini menggabungkan sifat-sifat unik dari inti LNP dan membran sel, menciptakan platform serbaguna untuk interaksi yang ditargetkan dan modifikasi potensial. Ini juga muncul sebagai solusi untuk mengatasi kekurangan metode pengiriman obat tradisional, khususnya yang menggabungkan modifikasi ligan yang padat karya dan kompleks yang melibatkan banyak kriteria dan terbukti tidak efisien [ 140 ]. [ 15 ] pertama kali dilaporkan menggunakan membran sel darah merah (RBC) (RCM) untuk melapisi poli(asam laktat-ko-glikolat) NP pada tahun 2011. Sejak saat itu, CMC telah dipelajari secara luas dengan berbagai inti NP termasuk polimer, lipid, atau NP anorganik, dan berbagai jenis membran sel termasuk kanker, sel induk, trombosit, sel imun, bakteri, dan sebagainya. Selain penghantaran obat, CMC juga berlaku dalam terapi fototermal, modulasi imun, detoksifikasi, dan terapi fotodinamik [ 141 – 144 ].
3.1 Persiapan CMC-LNP
Pembuatan CMC-LNP melibatkan proses sederhana untuk memodifikasi permukaan LNP, tanpa perlu pertimbangan khusus mengenai sifat-sifatnya. Proses ini terutama meliputi tiga langkah: isolasi membran sel, pengembangan dan pemilihan inti LNP yang tepat, dan penyatuan membran dan inti untuk menghasilkan CMC-LNP (Gambar 5 ) [ 19 , 145 ].
3.1.1 Isolasi
Untuk memanen vesikel membran sel (CMV) dengan sukses, sangat penting untuk melakukan ekstraksi membran dengan hati-hati guna mencegah denaturasi protein permukaan. Prosedur mengisolasi dan memurnikan membran sel terdiri dari beberapa langkah yang bertujuan untuk memperoleh membran sel murni. Ini melibatkan pemanenan dan lisis sel, fragmentasi mekanis, dan ultrasentrifugasi. Sejumlah besar sel target harus diperoleh dari sumber tertentu seperti garis sel, darah, atau organisme. Setelah ini, membran sel dikenakan perlakuan larutan hipotonik atau siklus beku-cair berulang, bersama dengan teknik lisis mekanis seperti ultrasonikasi, ekstrusi, atau homogenisasi untuk mengganggunya.
Berbagai penyangga lisis hipotonik telah dijelaskan, masing-masing dengan komposisi yang unik. Namun, penyangga lisis hipotonik yang mengandung 20 mM Tris–HCl (pH 7,5), 10 mM KCl, 2 mM MgCl 2 , dan satu tablet penghambat protease mini bebas EDTA per 10 mL larutan telah menjadi yang paling banyak digunakan. Sementara lisis hipotonik ini menjaga integritas membran dan cocok untuk aplikasi selanjutnya, hal ini sering kali memerlukan integrasi dengan metode tambahan untuk mengisolasi fragmen yang diinginkan secara efektif [ 146 ].
Lisis hipotonik yang dikombinasikan dengan homogenisasi merupakan teknik yang banyak digunakan untuk memecah membran. Teknik ini telah digunakan secara efektif di berbagai jenis sel, termasuk sel sehat dan sel kanker. Homogenisasi sebagian besar dilakukan dengan homogenizer Dounce, yang menonjolkan efisiensinya dalam proses fragmentasi membran [ 146 , 147 ].
Teknik yang jarang digunakan untuk fragmentasi membran juga telah diterapkan pada berbagai jenis sel. Metode beku-cair digunakan untuk memecah sel darah merah, makrofag, trombosit, dan sel melanoma. Metode ini melibatkan penerapan sampel ke siklus pembekuan berulang, baik dalam bak etanol atau dengan es kering, diikuti dengan pencairan pada suhu 37°C atau suhu ruangan. Saat sampel membeku, sel mengembang dan membentuk kristal es, dan selama pencairan, sel berkontraksi, yang akhirnya menyebabkan membran sel pecah. Meskipun teknik ini mudah dan sederhana untuk dilakukan, teknik ini berpotensi merusak protein membran yang sensitif terhadap suhu dan memengaruhi fungsi enzim yang halus. Sonikasi adalah teknik lain yang digunakan untuk homogenisasi cepat. Namun, frekuensi, durasi, dan daya harus dikontrol dengan hati-hati untuk mencegah kerusakan pada sampel [ 146 , 147 ].
Setelah itu, ultracentrifugasi diferensial diterapkan untuk menghilangkan komponen intraseluler, yang menghasilkan CMV dengan dimensi yang beragam. Proses ini memerlukan pemaparan fragmen pada satu, dua, atau tiga langkah sentrifugasi. Untuk meningkatkan efisiensi, beberapa eksperimen menggabungkan langkah-langkah tambahan, seperti menangguhkan kembali fragmen dalam buffer lisis, melakukan homogenisasi, atau menggunakan gradien sukrosa. Meskipun demikian, metode inti umumnya mencakup serangkaian langkah sentrifugasi, diikuti dengan pencucian membran sel yang diekstraksi. Proses ini dimulai dengan langkah sentrifugasi pada gaya yang relatif rendah, sekitar 3000× g , untuk menghilangkan nuklei dan sel utuh, meninggalkan supernatan untuk tahap berikutnya. Sentrifugasi berikutnya dilakukan pada gaya yang lebih tinggi, biasanya antara 10.000× g dan 20.000× g , untuk menghilangkan mitokondria dan organel lainnya. Akhirnya, ultracentrifugasi dilakukan pada kecepatan 15.000× g atau lebih tinggi untuk mengisolasi membran sel. Jumlah langkah sentrifugasi yang tepat, gaya sentrifugal yang diterapkan, dan penggunaan gradien dapat bervariasi tergantung pada persyaratan khusus percobaan. Pendekatan yang dipilih biasanya disesuaikan dengan tujuan dan kondisi penelitian tertentu [ 146 , 147 ].
Akhirnya, vesikel seragam diperoleh dengan menggunakan film polikarbonat dengan banyak nanopore melalui multiekstrusi menggunakan mikro ekstruder, atau dengan menggunakan ultrasonik dengan sonikator [ 15 , 148 ]. Untuk mempertahankan bioaktivitas protein membran dan mencegah denaturasinya, prosedur ekstraksi harus dilakukan pada suhu 4°C dengan penambahan inhibitor protease. Khususnya, ketika bekerja dengan prokariota seperti bakteri, yang membran selnya dikelilingi oleh peptidoglikan, pendekatan ekstraksi membran bervariasi dari yang digunakan untuk eukariota. Vesikel membran dari bakteri dapat dikumpulkan dengan ultrafiltrasi dari supernatan media kultur [ 149 , 150 ].
3.1.2 Fusi
3.1.2.1 Ekstrusi
Ekstrusi adalah teknik yang sering dilaporkan untuk memproduksi CMC-LNP. Proses ini melibatkan beberapa putaran ekstrusi CMV dan LNP melalui membran polikarbonat berpori [ 15 , 151 ]. Gaya mekanis dihasilkan selama proses ini saat CMV dan LNP melintasi film berpori, yang kemudian mendorong fusi dan pembungkusan lapisan ganda fosfolipid membran sel di dalam inti LNP [ 152 ]. CMC-NP pertama yang dikembangkan pada tahun 2011 menggunakan RCM dibuat menggunakan teknik ekstrusi [ 15 ]. Setelah itu, ekstrusi menjadi metode umum karena kesederhanaan dan kemampuan beradaptasinya dan telah dimanfaatkan untuk melapisi NP dengan berbagai ukuran [ 153 ]. Sementara ekstrusi adalah pendekatan yang efektif untuk membuat CMC-LNP dengan ukuran partikel yang seragam, skalabilitasnya agak sulit dicapai, yang membuatnya lebih terbatas pada penelitian laboratorium [ 148 ].
3.1.2.2 Sonikasi
Sonikasi adalah teknik lain yang umum digunakan untuk menginduksi fusi membran sel. Ketika LNP inti dan CMV dikultur bersama, mereka mengalami integrasi spontan di bawah ultrasound, menghasilkan pembentukan CMC-LNP [ 154 – 156 ]. Namun, ukuran partikel CMC-LNP yang dihasilkan oleh metode ini mungkin menunjukkan heterogenitas dan polidispersitas [ 157 ]. Lebih jauh lagi, paparan ultrasound dapat memengaruhi inti bagian dalam yang lembut dengan menyebabkan efek kavitasi, yang menghasilkan modifikasi permukaan LNP [ 158 ]. Mencapai kemanjuran pembungkus membran yang optimal dan meminimalkan potensi denaturasi protein dan kebocoran kargo memerlukan penyesuaian parameter ultrasound yang cermat, termasuk frekuensi, daya, dan durasi ultrasound [ 159 ]. Meskipun ada tantangan ini, metode ini menyediakan cara yang sederhana dan hemat biaya untuk produksi CMC-LNP yang dapat diskalakan [ 145 ].
3.1.2.3 Elektroporasi Mikrofluida
Elektroporasi mikrofluida adalah teknik canggih yang menggabungkan mikrofluida dengan elektroporasi, yang menawarkan alternatif inovatif untuk metode tradisional seperti ekstrusi dan sonikasi. Elektroporasi, yang umum digunakan dalam transfeksi sel, menerapkan medan listrik untuk mengganggu sementara penghalang dielektrik membran sel, yang memungkinkan biomolekul dan NP untuk melewatinya. Sejak dimulainya pada tahun 2001, elektroporasi mikrofluida telah mengalami kemajuan yang signifikan, dengan pengembangan berbagai desain chip yang ditujukan untuk meningkatkan efisiensi transfeksi dan mengurangi kebutuhan tegangan. Platform mikrofluida ini memberikan throughput, presisi, dan skalabilitas yang tinggi, sehingga semakin penting untuk sintesis berbagai NP [ 147 , 160 ].
Metode ini memiliki kemiripan dengan sonikasi tetapi menggunakan pulsa listrik sebagai tenaga pendorong untuk fusi membran. Proses ini melibatkan pengenalan CMV dan LNP melalui saluran masuk terpisah dari chip mikrofluida, tempat keduanya bergabung dan bercampur dalam saluran yang ditentukan. Sistem ini biasanya memiliki saluran penggabungan berbentuk Y, saluran pencampuran berbentuk S, dan unit elektroporasi. Setelah mencapai area elektroporasi, pulsa listrik membuat pori-pori sementara pada membran sel, yang memungkinkan integrasi LNP dan menghasilkan pembentukan CMC-LNP. NP yang dilapisi selanjutnya dikumpulkan di saluran keluar [ 161 ]. Keuntungan utama dari metode ini meliputi pelestarian integritas membran dan aktivitas protein permukaan. Dengan mengoptimalkan parameter seperti laju aliran, durasi pulsa, dan voltase, peneliti dapat mencapai CMC-LNP dengan efisiensi dan stabilitas enkapsulasi yang unggul. Selain itu, teknik ini menunjukkan potensi besar untuk produksi skala besar, meskipun biayanya yang relatif tinggi tetap menjadi batasan yang penting [ 160 ].
3.1.2.4 Metode Fusi Lainnya
Nanocomplexation flash merupakan pendekatan mutakhir untuk fabrikasi CMC-NP. Teknik ini melibatkan pengenalan larutan yang mengandung inti NP dan fragmen membran sel ke dalam saluran masuk terpisah dari mixer vortex multi-saluran masuk. Daerah vortex turbulen yang dihasilkan oleh laju aliran yang terkontrol menghasilkan gaya geser yang kuat, yang memecah membran sel dan mengintegrasikannya secara seragam dengan inti NP. Metode ini menawarkan beberapa keuntungan dibandingkan sonikasi tradisional, termasuk peningkatan stabilitas lapisan membran, peningkatan otomatisasi, dan hasil produksi yang lebih tinggi [ 162 ]. Metode inovatif lainnya adalah pengemasan in situ, yang menggabungkan fungsionalitas biologis dengan kemampuan untuk membungkus NP dengan berbagai bentuk dan komposisi. Dalam pendekatan ini, sel-sel terpapar NP dalam lingkungan yang terkontrol dan kemudian dipindahkan ke media kultur bebas serum. Hal ini mendorong pelepasan nanovesikel hibrida yang secara alami mengintegrasikan NP dalam strukturnya, menciptakan nanoplatform fungsional [ 163 ]. Metode tambahan yang dilaporkan untuk fusi CM mencakup fusi spontan dengan atraksi elektrostatik, ekstrusi/sonikasi, pembekuan-pencairan/sonikasi, dan ekstrusi/elektroporasi, masing-masing dengan kelebihan dan keterbatasan spesifik yang disesuaikan dengan aplikasi yang berbeda [ 147 , 164 , 165 ]. Ringkasan komparatif dari kelebihan dan keterbatasan utama dari teknik-teknik ini disediakan dalam Tabel 1 .
| Metode fusi | Keuntungan | Kekurangan | Referensi |
|---|---|---|---|
| Ekstrusi |
|
|
[ 20 , 165 ] |
| Sonikasi |
|
|
[ 20 , 166 ] |
| Elektroporasi mikrofluida |
|
|
[ 20 , 165 ] |
| Fusi spontan melalui tarikan elektrostatik |
|
|
[ 165 , 166 ] |
3.1.3 Vesikel Membran Sel
Selain berfungsi sebagai bahan pelapis untuk NP, CMV—yang diisolasi dan diaplikasikan tanpa inti sintetis—juga muncul sebagai wahana penghantaran obat mandiri yang menjanjikan. CMV mempertahankan kompleksitas lipid–protein–karbohidrat penuh dari membran asli, yang memungkinkannya untuk meniru identitas biologis sel induk dengan cermat. Aplikasinya tidak hanya mencakup penghantaran obat, tetapi juga pencitraan diagnostik, terapi fototermal, dan terapi fotodinamik [ 167 , 168 ]. Muatan terapeutik dapat dimuat melalui teknik koinkubasi atau pemuatan jarak jauh, dan modifikasi permukaan, seperti PEGilasi atau konjugasi peptida, dapat lebih meningkatkan fungsionalitasnya [ 168 , 169 ]. CMV juga telah direkayasa menggunakan perlakuan sitokalasin B untuk memfasilitasi pembentukan vesikel tanpa mengorbankan integritas membran, memperluas penerapannya ke berbagai jenis sel dengan sitoskeleton berbasis aktin [ 170 , 171 ]. Misalnya, Wang et al. [ 170 ] menunjukkan manfaat terapeutik CMV yang berasal dari sel punca endotel dan mesenkimal untuk regenerasi tulang dalam model cacat tengkorak tikus, dengan hasil yang menggembirakan. Dibandingkan dengan nanocarrier sintetis, CMV menunjukkan imunogenisitas yang berkurang, biokompatibilitas yang ditingkatkan, toksisitas rendah, sirkulasi yang lama, dan kemampuan penargetan yang melekat karena pelestarian fungsionalitas membran. Namun, tantangan praktis seperti agregasi vesikel, hilangnya aktivitas, dan ketidakstabilan selama penyimpanan tetap menjadi hambatan utama untuk penerapan klinis [ 168 ]. Mengatasi masalah ini akan sangat penting untuk keberhasilan pengembangan nanoterapi berbasis CMV.
3.2 Fungsi CMC
3.2.1 Penargetan
Membran sel yang menyelubungi LNP memiliki fungsi penting dalam mencapai penargetan yang dimediasi homotipe yang memungkinkan penargetan pasif dan aktif [ 172 ]. Pengikatan pada sel yang berbagi membran serupa dapat dicapai oleh protein berbasis membran sel yang terlibat dalam interaksi homotipe atau heterotipe [ 140 ]. Interaksi ini meningkatkan penargetan dan menjanjikan berbagai aplikasi dalam pengiriman obat yang ditargetkan. Spesifisitas penargetan bergantung pada interaksi molekuler antara molekul perekat di membran induk dan ligan yang sesuai pada sel target. Homogenitas membran induk merupakan faktor penting dalam mencapai efek penargetan yang diinginkan. Selain itu, peningkatan kadar molekul perekat pada membran sel diamati setelah aktivasi sel. Oleh karena itu, pra-stimulasi sel kandidat sebelum ekstraksi membran lebih disukai [ 173 ]. Penargetan aktif mencakup berbagai pendekatan seperti reseptor, antibodi, dan penargetan yang dimediasi peptida, masing-masing disesuaikan untuk mencapai tujuan spesifik CMC-LNP [ 174 , 175 ]. Penargetan yang dimediasi reseptor melibatkan penggunaan reseptor seperti HA, transferin, folat, dan reseptor faktor pertumbuhan epidermal [ 176 ]. Reseptor tertentu pada CMC-LNP memainkan peran penting dalam penargetan aktif, memungkinkan pengikatan efektif ke sel-sel spesifik yang ditunjuk untuk pengiriman obat [ 177 , 178 ]. Untuk terapi kanker, permukaan CMC-LNP dapat disuplai dengan berbagai reseptor yang diekspresikan secara tinggi yang ditemukan pada sel kanker, seperti P-selectin, CD11a, GPIb, GP IIb, dan CD11b [ 179 ]. Mengidentifikasi reseptor yang diekspresikan berlebihan dalam sel tumor target adalah langkah awal dalam menentukan reseptor penting untuk pengiriman NP. Misalnya, reseptor permukaan CD44, yang ditemukan pada berbagai jenis membran sel, memainkan peran penting dalam meningkatkan kemampuan penargetan tumor [ 180 ]. CD44 memfasilitasi interaksi antara sel dan ECM, khususnya melalui pengikatannya ke HA, komponen ECM utama. Interaksi ini sangat penting dalam aplikasi penargetan tulang, menjadikan CMC-LNP sebagai platform yang menjanjikan untuk terapi regenerasi tulang [ 181 ]. Khususnya, ekspresi CD44 dalam hantu bakteri bermuatan LIP yang dilapisi membran sel kanker (CCM) (CCM-LIP-loaded bacterial ghosts), yang dikembangkan oleh Ling et al. [ 182 ], secara signifikan meningkatkan efisiensi penargetan dalam model tumor.
Selain itu, membran sel yang berasal dari sel darah putih, sel punca mesenkimal, dan trombosit menunjukkan spektrum molekul perekat yang luas, yang memungkinkan interaksi yang kuat dengan endotelium yang meradang dan meningkatkan akumulasi di tempat peradangan [ 183 , 184 ]. Memanfaatkan ini, Geng et al. [ 185 ] mengembangkan LIP berlapis membran sel trombosit (PCM) (PCM-LIP) yang diperkaya dengan CD44, yang menunjukkan peningkatan pengiriman yang ditargetkan dan internalisasi seluler dalam jaringan yang meradang.
Selain penargetan alami, membran yang berasal dari sel imun menawarkan keuntungan lebih lanjut melalui presentasi antigen dan pemrosesan permukaan dinamis, yang dapat dimanfaatkan untuk pengiriman presisi [ 147 , 186 ]. Selain itu, fungsionalisasi CMC-LNP dengan ligan penargetan, seperti antibodi atau peptida, dapat secara substansial meningkatkan spesifisitas sel atau jaringan. Modifikasi ini dapat diperkenalkan secara tepat menggunakan teknik konjugasi tingkat lanjut, seperti kimia klik, yang memastikan perlekatan ligan yang stabil dan efisien. Dengan meningkatkan presisi penargetan, strategi ini tidak hanya memaksimalkan kemanjuran terapeutik tetapi juga meminimalkan efek di luar target, mengurangi toksisitas sistemik dan meningkatkan hasil pengobatan secara keseluruhan [ 187 – 189 ].
Penyerapan seluler CMC-LNP diatur oleh beragam mekanisme penetrasi, yang dipengaruhi oleh jenis sumber membran, komposisi lipid, muatan permukaan, dan lingkungan sel target spesifik. Memahami jalur-jalur ini sangat penting untuk mengoptimalkan efisiensi pengiriman dan merancang sistem LNP yang ditingkatkan secara fungsional. Beberapa penelitian telah menunjukkan bahwa endositosis, dalam berbagai bentuknya, memainkan peran utama. Misalnya, Liu et al. [ 190 ] melaporkan bahwa endositosis bergantung kolesterol adalah jalur dominan untuk CCM-LIP, yang menyoroti pentingnya domain rakit lipid dalam proses internalisasi. Sebaliknya, Nie et al. [ 191 ] dan Pitchaimani et al. [ 192 ] mengamati fusi membran langsung sebagai mekanisme penyerapan utama untuk masing-masing LIP berlapis CCM dan membran sel pembunuh alami (NKCM) (NKCM-LIP), yang memungkinkan pengiriman sitoplasma tanpa penjebakan endosomal. Endositosis dan makropinositosis yang dimediasi oleh clathrin juga telah diidentifikasi sebagai jalur masuk alternatif, tergantung pada sifat fisikokimia CMC-LNP dan jenis sel target [ 181 , 193 , 194 ]. Jalur-jalur ini dapat diaktifkan atau ditingkatkan secara selektif dengan menyesuaikan sifat-sifat membran permukaan atau menggabungkan ligan yang berinteraksi dengan reseptor spesifik.
3.2.2 Sirkulasi Panjang
CMC dapat memperpanjang waktu sirkulasi LNP. Pertama, membran sel tidak memicu respons sel imun, dan mereka menunjukkan tingkat disintegrasi yang lambat di dalam tubuh yang kemudian memungkinkan mereka untuk menghindari deteksi sistem imun [ 195 ]. Dengan memiliki ligan atau reseptor spesifik pada permukaan CMC-LNP, mereka menunjukkan afinitas yang kuat untuk sel-sel tertentu dan menghindari interaksi dengan sel epitel pembuluh darah. Selain itu, LNP yang dilapisi dengan RCM menunjukkan sirkulasi yang diperpanjang, karena waktu paruh yang lama dan fleksibilitas yang luar biasa dari sel-sel ini untuk menavigasi melalui kapiler yang sempit [ 196 ]. Dengan memanfaatkan sel-sel imun untuk pelapisan, yang memiliki reseptor homotipe pada permukaannya, CMC-LNP secara efektif dapat lolos dari fagositosis dan RES [ 197 ]. CD47, protein transmembran yang umumnya diekspresikan pada membran sel yang berbeda, memiliki peran penting dalam kaskade sinyal yang mengomunikasikan pesan “jangan makan aku” ke fagosit, berkontribusi pada penghindaran imun dan sirkulasi CMC-LNP yang lebih lama [ 173 ]. Kehadiran CD47 pada PCM-LIP yang dikembangkan oleh Geng et al. [ 185 ] dan hantu bakteri yang dimuat CCM-LIP yang dikembangkan oleh Ling et al. [ 182 ] berhasil menghambat fagositosis yang dimediasi makrofag yang mengarah pada sirkulasi yang lebih lama dan kemanjuran terapi yang lebih baik.
Memperpanjang waktu sirkulasi meningkatkan efikasi CMC-LNP. Dengan periode pelepasan yang diperpanjang, ada kemungkinan berkurang untuk menginduksi resistensi obat pada sel kanker, dan CMC-LNP lebih kecil kemungkinannya untuk mengalami kerusakan dini atau eliminasi sebelum mencapai tempat yang dituju. Menariknya, waktu sirkulasi LNP yang dilapisi PEG juga dapat diperpanjang oleh CMC [ 172 ]. LNP yang berbeda menunjukkan waktu sirkulasi yang lebih lama ketika dilapisi dengan membran sel. LIP yang dilapisi membran sel makrofag (MCM) (MCM-LIP) yang dikembangkan oleh Tang et al. [ 198 ] menunjukkan waktu sirkulasi yang diperpanjang secara signifikan, dengan waktu paruh eliminasi 13,92 jam, dibandingkan dengan rekan-rekan mereka yang dilapisi PEG, yang memiliki waktu paruh 7,83 jam. Demikian pula, NLC berlapis RCM yang dikembangkan oleh Zhou et al. [ 199 ] menunjukkan waktu sirkulasi yang diperpanjang relatif terhadap NLC yang tidak dilapisi, terutama karena penghindaran pengenalan imun. Lebih lanjut, Xie et al. [ 200 ] mengembangkan LIP berlapis membran sel hibrida (CMC-LIP) menggunakan membran sel kanker dan leukosit untuk meningkatkan kemanjuran antitumor terhadap kanker payudara. Mereka membandingkan waktu paruh sirkulasi LIP yang dilapisi dengan membran sel kanker, leukosit, dan hibrida (HCM). Semua LIP berlapis menunjukkan waktu paruh sirkulasi yang lebih lama daripada LIP yang tidak dilapisi. Di antara formulasi berlapis, LIP berlapis leukosit memiliki waktu sirkulasi darah terpanjang (20,2 jam), diikuti oleh LIP berlapis membran hibrida (8,1 jam), sedangkan LIP yang tidak dilapisi hanya memiliki waktu sirkulasi 4 jam. Sirkulasi yang diperpanjang ini dikaitkan dengan keberadaan protein imunomodulatori pada membran leukosit, yang memfasilitasi penghindaran pengenalan sistem imun [ 200 ].
Salah satu hambatan paling signifikan untuk nanomedicine yang diberikan secara sistemik, termasuk CMC-LNP, adalah pembentukan korona protein. Setelah kontak dengan cairan biologis, lapisan dinamis protein yang teradsorpsi dengan cepat terbentuk pada permukaan NP. Lapisan ini membentuk kembali identitas biologis partikel dan sangat memengaruhi biodistribusi, opsonisasi, imunogenisitas, penyerapan seluler, dan efisiensi penargetannya [ 201 , 202 ]. Sementara korona protein dapat, dalam beberapa konteks, meningkatkan stabilitas NP dan mengurangi agregasi, ia sering menutupi ligan fungsional atau komponen membran, sehingga melemahkan efek penargetan yang dimaksudkan dan mengorbankan kemanjuran in vivo. Modifikasi pada komposisi dan sifat permukaan LNP dapat membentuk kembali korona protein, yang berpotensi memengaruhi biodistribusi dan efisiensi penargetan spesifik organ [ 203 , 204 ].
Penerapan CMC pada LNP secara signifikan membatasi akumulasi protein pada permukaannya, meningkatkan stabilitasnya dalam sistem biologis [ 190 , 202 , 205 ]. Studi oleh Corbo et al. [ 205 ] pada LIP berlapis dan tidak berlapis leukosit menunjukkan pengikatan protein yang lebih rendah pada LIP berlapis, dengan protein tertentu hanya muncul pada LIP yang tidak berlapis atau secara eksklusif pada yang berlapis. Variasi pada korona protein NP berlapis membantu mereka mempertahankan fungsi penargetan berbasis membran sel, menawarkan perlindungan terhadap pengenalan sistem imun dan meminimalkan sitotoksisitas [ 202 ]. Temuan ini menggarisbawahi peran protektif antarmuka membran asli dalam menahan penyerapan protein yang tidak diinginkan, sehingga meningkatkan waktu sirkulasi dan menjaga spesifisitas penargetan.
3.2.3 Imunomodulasi
Selain kemampuan CMC-LNP untuk menghindari sistem imun, CMC-LNP juga dapat meningkatkan respons imun tubuh dengan melibatkan sel imun, memberikan sinyal dan komponen seluler yang diwariskan untuk memodulasi respons imun secara dinamis. Mereka juga dapat mengatur ekspresi gen yang terlibat dalam respons pro- atau anti-inflamasi, mendorong perekrutan subtipe sel imun tertentu sambil menghambat aktivitas yang lain [ 173 , 206 ]. Ketika dilapisi dengan sel imun dan sel kanker, CMC-LNP dapat memodulasi sistem imun dengan menghadirkan reseptor seperti reseptor inflamasi dan reseptor CD, sehingga memicu dan meningkatkan respons imun dengan cara yang mendukung kemanjuran terapeutik [ 206 , 207 ]. Blokade protein terkait limfosit T sitotoksik 4 (CTLA-4) dan protein kematian sel terprogram 1 (PD1) sering disertakan untuk memulihkan pertahanan imun yang terganggu [ 173 ]. Pembentukan CMC-LNP dapat dimodifikasi untuk secara langsung meningkatkan imunoterapi dengan menambah respons imun antitumor melalui penggunaan terapeutik membran sel atau secara tidak langsung dengan meningkatkan kemanjuran agen terapeutik yang dimuat [ 208 ]. Misalnya, pelapisan NKCM dapat merangsang polarisasi makrofag M1, memulai respons imun yang menghilangkan perkembangan tumor primer dan juga menghambat pembentukan tumor jauh [ 209 , 210 ]. Wu et al. [ 211 ] menunjukkan bahwa protein permukaan, yang berfungsi sebagai imunoadjuvan, dapat dilapisi ke permukaan CMC-LNP, meningkatkan presentasi antigen, dan akibatnya memulai aksi imun antitumor yang ditandai dengan sekresi sitokin dan proliferasi limfosit. Lebih jauh lagi, pelapisan sel bakteri dilaporkan menunjukkan efek peningkatan imunitas yang cukup besar karena adanya beberapa imunoadjuvan dan molekul terkait patogen [ 149 , 210 ].
3.2.4 Komponen Membran Sel Lainnya dalam Penghantaran Obat
Sementara protein membran memainkan peran penting dalam fungsi membran sel, komponen lain juga memengaruhi penghantaran obat dan dapat dimodifikasi secara strategis untuk mencapai tujuan terapeutik tertentu. Membran sel terdiri dari tiga elemen utama: lapisan lipid ganda yang terdiri dari fosfolipid dan kolesterol, protein yang tertanam di dalam atau melekat pada lapisan lipid, dan karbohidrat yang hadir sebagai glikolipid atau glikoprotein. Masing-masing komponen ini berkontribusi secara unik terhadap dinamika membran, stabilitas, dan interaksi dengan sistem biologis, menjadikannya target yang berharga untuk mengoptimalkan strategi penghantaran obat [ 169 , 212 ].
Rantai hidrokarbon yang diperpanjang dari asam lemak dalam fosfolipid berkontribusi pada elastisitas dan kemampuan beradaptasi membran, menjadikannya antarmuka yang ideal untuk interaksi NP. Kolesterol memainkan peran penting dalam memodulasi dinamika membran dengan mengendalikan fluiditasnya. Menyesuaikan kadar kolesterol dapat mengubah keseimbangan antara fleksibilitas dan kekakuan membran. Misalnya, penambahan kolesterol meningkatkan integritas struktural CMV, meningkatkan stabilitas dan ketahanannya terhadap fluktuasi pH lingkungan [ 169 , 212 , 213 ].
Karbohidrat yang terkait dengan glikoprotein dan glikolipid membentuk sekitar 5–10% dari total komposisi membran dan sebagian besar terletak di permukaan luar, membentuk lapisan pelindung yang dikenal sebagai glikokaliks. Oligosakarida dalam struktur ini memainkan peran penting dalam memediasi interaksi sel-ke-sel, termasuk pensinyalan, pengenalan, dan adhesi. Sel kanker meningkatkan ekspresi karbohidrat untuk meningkatkan adhesi dan menghindari deteksi imun, sementara sel saraf memanfaatkan permukaan kaya karbohidrat untuk memfasilitasi pertumbuhan dan regenerasi. Selain itu, patogen seperti bakteri dan virus memanfaatkan struktur karbohidrat spesifik untuk masuk ke sel inang. Mengingat fungsi biologisnya yang beragam, karbohidrat berfungsi sebagai target yang berharga untuk mengembangkan pendekatan terapeutik yang inovatif [ 169 ]. Fosfatidilserina (PS) adalah fosfolipid penting yang terutama ditemukan pada lapisan dalam membran plasma, memainkan peran penting dalam pensinyalan seluler dan regulasi imun. Dalam vesikel membran plasma yang diekstraksi, PS dapat tetap terbatas pada lapisan dalam jika asimetri membran dipertahankan. Retensi ini penting untuk mencegah aktivasi imun yang tidak perlu, karena paparan PS berfungsi sebagai sinyal bagi fagosit untuk memulai respons antiinflamasi, yang mendorong toleransi imun terhadap komponen sel apoptotik. Selain itu, manipulasi distribusi PS yang terkontrol dapat memodulasi respons imun dengan menekan ekspansi sel T efektor sekaligus meningkatkan populasi sel T regulator, yang menyediakan strategi yang dapat disesuaikan untuk regulasi imun [ 214 , 215 ].
Zhang et al. [ 215 ] menunjukkan sifat bioaktif yang beragam dari NP berlapis membran neutrofil dalam mengatur respons inflamasi, bahkan tanpa adanya obat yang tertanam. CMC-NP ini mempertahankan komponen utama dari membran plasma neutrofil, termasuk reseptor kemokin dan sitokin, β-integrin, dan PS dari lapisan dalam. Pelestarian komponen fungsional ini memberi mereka kapasitas yang kuat untuk mengikat dan menetralkan sitokin proinflamasi, yang secara efektif mengurangi peradangan yang berlebihan [ 215 ].
Sifat-sifat CMV dapat disesuaikan melalui modifikasi yang diterapkan sebelum pembentukannya (pramodifikasi) atau setelah ekstraksi (pascamodifikasi). Pramodifikasi melibatkan penanganan sel induk untuk menyesuaikan komposisi lipid, mengatur ekspresi protein, atau merekayasa struktur rantai hidrokarbon di dalam membran. Sebaliknya, pascamodifikasi memperkenalkan molekul fungsional setelah ekstraksi vesikel, yang menawarkan fleksibilitas dalam pemilihan material. Berbagai strategi pascamodifikasi telah dieksplorasi, memanfaatkan komponen membran alami seperti protein, lipid, dan asam nukleat serta elemen sintetis untuk meningkatkan fungsionalitas [ 212 ].
3.3 Karakterisasi CMC-LNP
3.3.1 Sifat Fisikokimia
Hamburan cahaya dinamis (DLS) adalah metode yang andal, akurat, dan efisien secara ekonomi untuk memeriksa karakteristik fisikokimia CMC-LNP termasuk distribusi ukuran, potensi zeta, dan indeks polidispersitas (PDI). Sebagian besar penelitian telah menyatakan bahwa ukuran LNP meningkat setelah dilapisi dengan membran sel (Gambar 6a ) [ 199 , 200 , 216 , 217 ]. Menariknya, He et al. [ 218 ] melaporkan bahwa LIP yang dilapisi dengan leukosit dan CCM tidak menunjukkan perubahan yang nyata dalam diameter hidrodinamik dibandingkan dengan LIP yang tidak dilapisi (Gambar 6b ). Hal ini dijelaskan oleh kemampuan membran sel yang diekstraksi untuk bertindak sebagai blok pembangun lipid yang bergabung dengan fosfolipid LIP untuk membentuk CMC-LIP yang stabil, sebuah fenomena yang tidak diamati dalam PNP berlapis membran sel (CMC-PNP) [ 218 ]. Selain itu, Geng et al. [ 185 ] melaporkan penurunan diameter hidrodinamik saat mengembangkan LNP berlapis PCM (PCM-LNP). Hal ini disebabkan oleh fluiditas signifikan lapisan lipid dalam LNP yang memungkinkan reorganisasi ukuran partikel melalui ekstrusi [ 185 ]. Untuk potensi zeta, CMC telah terbukti mengubah muatan LNP, membuatnya lebih negatif dalam berbagai penelitian (Gambar 6c ) [ 191 , 198 , 218 ], karena pelapisan protein bermuatan negatif yang terkait dengan membran sel [ 218 ].
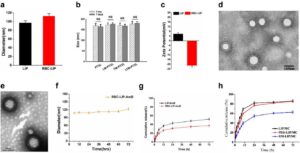
Stabilitas CMC-LNP sangat penting. Sepanjang proses sintesis dan penyimpanan, penting untuk menjaga integritas dan fungsionalitas membran untuk memastikan keberhasilan pembuatan CMC-LNP. CMC dapat menghasilkan bentuk LNP yang lebih stabil, kemungkinan karena stabilisasi sterik dan sifat tersembunyi yang mengurangi interaksi nonspesifik [ 219 , 220 ]. Stabilitas sering dinilai dalam berbagai kondisi dan metode. Misalnya, beberapa penelitian menyimpan CMC-LNP pada suhu 4 °C dan menggunakan DLS untuk memantau perubahan ukuran partikel, PDI, dan potensi zeta pada interval waktu tertentu [ 192 , 199 , 217 ]. Lebih lanjut, leukosit hibrida dan CMC-LIP kanker mempertahankan stabilitasnya pada suhu 4 °C selama 1 minggu tanpa perubahan signifikan dalam ukuran dan potensi zeta (Gambar 6e ) [ 218 ]. Baik LIP berlapis RCM (RCM-LIP) (Gambar 6f ) dan MCM-LIP menunjukkan stabilitas yang cukup besar selama 72 jam pada suhu kamar [ 198 , 200 ]. Stabilitas serum CMC-LNP dapat dievaluasi pada suhu 37°C dengan adanya FBS dengan mengukur absorbansi pada 560 nm menggunakan pembaca pelat. Metode ini melibatkan pemantauan peningkatan kerapatan optik pada 560 nm, yang menunjukkan agregasi partikel karena interaksi dengan protein serum. Agregasi tersebut juga menunjukkan potensi pembentukan korona protein pada permukaan partikel. NLC berlapis RCM (RCM-NLC) tidak menunjukkan perubahan absorbansi dalam 6 jam yang mengonfirmasi stabilitas serum yang baik [ 199 ]. NKCM-LIP juga tidak menunjukkan perubahan signifikan dalam absorbansi selama 3 jam [ 192 ]. Selain itu, Turbiscan Lab Expert dilaporkan mengevaluasi stabilitas dengan mengukur transmisi menggunakan FBS yang mengandung PBS (10%, v/v) pada suhu 37°C untuk mensimulasikan kondisi fisiologis alami [ 219 , 221 ].
Efisiensi penjebakan (EE%) dari CMC-LNP adalah parameter penting yang mencerminkan seberapa efektif agen terapeutik dienkapsulasi dalam sistem NP. Penentuan EE% yang akurat sangat penting untuk optimasi dan reproduktifitas formulasi. Salah satu teknik yang digunakan secara luas adalah ultrafiltrasi sentrifugal, di mana suspensi NP dimuat ke dalam tabung ultrafiltrasi dan disentrifugasi pada kecepatan tinggi (biasanya ≥14.000× g ) pada suhu 4°C. Proses ini memisahkan obat yang tidak dienkapsulasi (bebas) ke dalam filtrat, yang kemudian diukur menggunakan kromatografi cair kinerja tinggi (HPLC). EE% dihitung menggunakan rumus: EE% = [(total obat − obat bebas)/total obat] × 100%. Metode ini telah berhasil diterapkan dalam berbagai penelitian pada nanocarrier biomimetik dan berlapis MCM [ 199 , 222 ]. Ini sederhana dan efisien tetapi memerlukan kontrol kondisi sentrifugasi yang cermat untuk menghindari kerusakan struktur NP. Pendekatan lain adalah kromatografi pengecualian ukuran (SEC), yang memisahkan obat bebas dari formulasi yang dienkapsulasi berdasarkan perbedaan ukuran melalui matriks filtrasi gel. Obat yang dienkapsulasi, dielusi secara terpisah, kemudian dikuantifikasi dengan HPLC setelah persiapan sampel yang tepat [ 198 , 223 ]. SEC menawarkan presisi tinggi dalam memisahkan komponen tetapi mungkin melibatkan waktu pemrosesan yang lebih lama dan kolom khusus. EE% dari RCM-NLC dinilai menggunakan ultrafiltrasi sentrifugal dan menunjukkan EE% lebih tinggi dari 90% [ 199 ]. Studi lain melaporkan EE% yang lebih tinggi (lebih dari 90%) dari CMC-LNP [ 198 , 200 , 222 ]. NKCM-LIP menunjukkan EE% maksimum 80%, yang sebanding dengan LIP yang tidak dilapisi [ 192 ]. SLN berlapis MCM (MCM-SLN) menunjukkan EE% lebih tinggi dari 50%, yang tidak terpengaruh oleh modifikasi permukaan asparagine–glycine–arginine (NGR) dan/atau T7 [ 223 ]. EE% yang diukur dapat bervariasi tergantung pada faktor-faktor seperti jenis obat, asal membran, dan metode pemuatan yang digunakan. Oleh karena itu, pemilihan metode dan standardisasi analitis sangat penting untuk evaluasi EE% yang akurat dan dapat direproduksi dalam formulasi CMC-LNP.
Studi pelepasan obat in vitro sering dilakukan untuk memeriksa pengaruh CMC pada pola pelepasan obat. Berbagai studi melaporkan pola pelepasan berkelanjutan dari CMC-LNP tanpa ledakan pelepasan awal [ 219 , 221 , 223 ]. Hal ini disebabkan oleh difusi lambat kargo yang terperangkap melalui membran sel. Sifat pelepasan berkelanjutan dari CMC-LNP meningkatkan potensi obat yang terkandung, sehingga menghasilkan hasil yang lebih efektif [ 210 , 224 , 225 ]. Sifat pelepasan berkelanjutan yang ditingkatkan membantu meminimalkan kebocoran obat selama sirkulasinya melalui sistem [ 198 ].
Bahasa Indonesia: Dibandingkan dengan LIP yang tidak dilapisi, RCM-LIP menunjukkan profil pelepasan berkelanjutan yang lebih baik dari amfoterisin B (Gambar 6g ) [ 200 ]. MCM-LIP menunjukkan perilaku pelepasan berkelanjutan yang lebih baik daripada LIP polos dan PEG-LIP (Gambar 6h ) [ 198 ]. Selain itu, hibrida eksosom-LIP menunjukkan pelepasan DOX yang lebih jelas dalam lingkungan pH asam (pelepasan obat 83%) daripada dalam pH fisiologis (pelepasan obat 55%) ketika dinilai selama 48 jam [ 226 ]. Kemampuan untuk menunjukkan pelepasan obat yang lebih tinggi dalam lingkungan asam menguntungkan, terutama untuk pengobatan kanker karena lingkungan asam merupakan karakteristik umum sel kanker [ 227 , 228 ]. Pelepasan obat yang dipercepat dalam jaringan kanker yang dicapai pada kondisi pH yang lebih rendah menjamin lebih sedikit paparan obat ke organ sehat dalam kondisi fisiologis [ 229 ]. Lebih jauh lagi, verifikasi enkapsulasi obat yang efektif dalam LNP mungkin memerlukan penggunaan teknik lain seperti spektrometri massa, spektroskopi resonansi magnetik nuklir, dan spektroskopi inframerah.
3.3.2 Sifat Biologis
Kemanjuran CMC-LNP dalam menjalankan fungsi spesifiknya secara langsung dipengaruhi oleh integritas komponen yang membentuk membran sel dan pemeliharaan aktivitas protein. Untuk mengatasi retensi aktivitas membran, evaluasi komprehensif konsentrasi protein dan profilnya sangat penting. Kit uji asam bicinchoninic (BCA) telah digunakan untuk mengukur konsentrasi protein [ 216 , 223 ]. Memastikan transfer lengkap protein membran ke CMC-LNP sangat penting. Oleh karena itu, membandingkan profil protein dari membran sel yang diekstraksi dan CMC-LNP dapat dilakukan dengan menggunakan elektroforesis gel natrium dodecyl sulfate-polyacrylamide (SDS-PAGE) untuk memastikan bahwa CMC-LNP mempertahankan komposisi protein yang sama [ 182 , 217 ]. Dalam MCM-LIP yang dirancang oleh Cao et al. [ 216 ], pengawetan substansial komposisi protein dari MCM tercapai, sedangkan tidak ada sinyal protein yang diidentifikasi dalam LIP kosong. Selain itu, analisis penyortiran sel yang diaktifkan oleh fluoresensi dan imunofluoresensi dimanfaatkan untuk memverifikasi keberadaan integrin α4 dan β1 berbasis sel RAW 264.7 [ 216 ]. Western blotting digunakan untuk mengonfirmasi keberadaan penanda spesifik membran [ 200 , 217 ]. Selain itu, verifikasi protein membran dan mRNA dapat dicapai melalui flow cytometry dan qPCR. Uji sitotoksisitas, seperti uji MTT dan CCK-8, dilakukan untuk menilai toksisitas seluler dari sistem yang dikembangkan [ 199 , 217 , 219 ]. Penyerapan seluler CMC-LNP diselidiki untuk menilai selektivitas dan mengonfirmasi peningkatan penyerapan NP yang dikembangkan oleh sel-sel terpilih [ 216 , 217 , 223 ]. Uji transfer energi resonansi Förster (FRET) juga digunakan untuk menyelidiki secara langsung fusi LNP dengan membran sel [ 191 ]. Kolokalisasi lengkap inti LNP dan membran sel dikonfirmasi dengan baik menggunakan gambar mikroskop pemindaian laser confocal (CLSM) [ 182 , 191 , 199 ] Selain menggunakan CLMS, Xie et al. [ 200 ] menggunakan uji agregasi streptavidin dan biotin untuk menilai integritas lapisan RCM ke dalam LIP dengan memantau rasio membran terhadap LNP. Setelah mencapai lapisan membran penuh, pencegahan lengkap agregasi yang diinduksi oleh ikatan silang LNP terbiotinilasi yang dimediasi streptavidin dapat dicapai. Lapisan RCM sisi kanan juga ditegaskan melalui teknik pewarnaan imunogold yang berfokus pada berbagai domain CD47 yang banyak diekspresikan dalam sel darah merah [ 200 ].
Efek imunomodulatori CMC-LNP dapat dievaluasi menggunakan berbagai penanda dan metodologi, yang disesuaikan dengan tindakan spesifik yang diberikannya. Studi penghindaran imun sering menggunakan analisis penyerapan seluler pada makrofag, seperti sel RAW 264.7, sebagai pendekatan standar. Ini melibatkan pemeriksaan penyerapan CMC-LNP berlabel pewarna oleh makrofag melalui teknik seperti flow cytometry dan mikroskopi [ 198 – 200 , 221 ]. Ekspresi protein membran CD47, yang penting untuk penghindaran makrofag, dapat dinilai menggunakan Western blotting [ 199 , 200 ]. Profil sitokin adalah metode penting untuk menilai imunogenisitas dengan mengukur sitokin proinflamasi, biomarker utama yang digunakan untuk mengevaluasi efek imunomodulatori NP. [ 192 ] mengevaluasi imunogenisitas NKCM-LIP pada sel monosit darah tepi manusia (THP-1) menggunakan kit ELISA untuk mengukur sitokin proinflamasi, termasuk TNF-α, IL-1β, dan IL-6. Temuan tersebut mengungkapkan bahwa NKCM-LIP menunjukkan imunogenisitas minimal tanpa peningkatan kadar sitokin yang terdeteksi pada sel THP-1 setelah 24 jam inkubasi [ 192 ]. Ling dkk. [ 182 ] menggunakan berbagai metode untuk mengevaluasi efek imunostimulasi dari bakteri hantu yang dimuat CCM-LIP. Ini termasuk pewarnaan caspase-3 melalui imunohistokimia dan ELISA untuk mengukur sitokin proinflamasi seperti IL-4, TNF-α, dan IFN-γ. Studi ini juga meneliti subset sel T di limpa, karena sel T CD8a+ memainkan peran utama dalam respons imun spesifik tumor, dengan sel T CD4+ mendukung generasinya dan melepaskan sitokin seperti TNF-α dan IFN-γ. Homogenat limpa diinkubasi dengan antibodi sel penyaji antigen (APC)-CD4+ dan PE-CD8a+, diikuti oleh analisis fluoresensi menggunakan flow cytometry, yang menawarkan pemahaman terperinci tentang respons imun yang dipicu oleh nanosistem yang dikembangkan [ 182 ]. Polarisasi makrofag dapat dipelajari dengan memeriksa penanda spesifik, dengan CD86 dan iNOS mewakili fenotipe M1, dan CD163, CD206, dan Arg-1 yang dikaitkan dengan fenotipe M2. Berbagai teknik, termasuk flow cytometry, ELISA, imunofluoresensi, qPCR, dan Western blotting, umumnya digunakan untuk mendeteksi dan menganalisis penanda ini [ 198 , 230 ]. Pengujian lain membantu menjelaskan peran CMC-LNP dalam modulasi imun, dengan fokus pada sitotoksisitas sel T dan presentasi antigen. Pengujian ini dievaluasi melalui sistem kokultur dan flow cytometry untuk menilai ekspresi MHC-I dan MHC-II pada APC dan menggunakan penanda seperti CD25, CD69, dan CD137 untuk sel T, dan CD80, CD86, dan HLA-DR untuk pematangan sel dendritik [ 231 ].
Untuk menilai sirkulasi darah yang diperpanjang dari CMC-LNP, kurva konsentrasi-waktu plasma dianalisis untuk menentukan metrik farmakokinetik penting, termasuk AUC, C _max, dan T _max. Metode seperti HPLC, kromatografi cair-spektrometri massa, dan pelacakan fluoresensi umumnya digunakan untuk evaluasi ini. Xie et al. [ 200 ] menggunakan strategi ini untuk memeriksa waktu sirkulasi yang diperpanjang dari RCM-LIP yang dimuat amfoterisin B yang menunjukkan peningkatan dua kali lipat dalam konsentrasi darah dibandingkan dengan PEG-LIP. Pitchaimani et al. [ 192 ] menyelidiki waktu paruh NKCM-LIP dengan pemberian NKCM-LIP berlabel DiR secara intravena kepada tikus. Sampel darah kemudian dianalisis menggunakan spektrofluorometer untuk mengukur sinyal DiR. Analisis farmakokinetik menggunakan model dua kompartemen mengungkapkan bahwa NKCM-LIP menunjukkan waktu paruh sirkulasi yang jauh lebih lama dan pembersihan in vivo yang berkurang dibandingkan dengan LIP yang tidak dilapisi [ 192 ].
Berbagai teknik analisis telah diterapkan untuk mengkarakterisasi korona protein. Kandungan protein total biasanya dinilai melalui uji Bradford atau BCA [ 191 , 205 ], sementara SDS-PAGE memungkinkan pemisahan protein yang teradsorpsi. Untuk profil yang lebih rinci, proteomik berbasis spektrometri massa digunakan setelah pencernaan triptik pita yang diselesaikan SDS-PAGE [ 201 , 205 ]. DLS juga telah digunakan untuk memantau secara tidak langsung pembentukan korona protein melalui profil agregasi, dengan LNP berlapis mempertahankan distribusi ukuran yang lebih stabil dalam media yang mengandung serum dibandingkan dengan kontrol yang tidak dilapisi [ 190 ]. Alat karakterisasi ini penting untuk memahami bagaimana pelapisan membran memengaruhi komposisi korona dan untuk memandu strategi rekayasa masa depan yang bertujuan untuk meningkatkan penargetan dan meminimalkan pembersihan imun.
Pengujian penyerapan makrofag memberikan indikasi sirkulasi yang berkepanjangan, seperti yang ditunjukkan dalam berbagai penelitian [ 199 , 221 ]. Tingkat internalisasi CMC-LNP oleh makrofag dapat mencerminkan persistensi mereka dalam aliran darah dan kemampuan mereka untuk menghindari pembersihan imun.
3.4 Jenis Membran Sel dan Aplikasi Terapi
3.4.1 LNP berlapis RCM
Sel darah merah memimpin sebagai yang paling melimpah di antara berbagai entitas seluler [ 232 ]. RCM-LNP dapat memperluas sirkulasi darah dan menghindari deteksi imun karena penanda seperti CD47 [ 119 , 233 ]. Selain itu, efek pelepasan berkelanjutan dapat dicapai dengan pelepasan kargo tertutup secara bertahap dari sifat semi-permeabel RCM [ 144 ]. Namun, RCM mengalami teknik pemurnian yang rumit dan lama [ 234 ] dan potensi penargetan yang lebih sedikit [ 208 ]. Berbagai jenis LNP telah dilapisi dengan RCM. [ 199 ] merekayasa CMC-NLC, sebuah nanostruktur yang mengandung PTX yang diselimuti RCM, menunjukkan pelepasan obat yang berkepanjangan (29,02 ± 8,14% dilepaskan dari RCM-NLC dibandingkan dengan 48,98 ± 3,87% dilepaskan dari NLC yang tidak dilapisi selama 50 jam), peningkatan substansial dalam penyerapan sel kanker, dan peningkatan akumulasi dalam jaringan tumor. Han et al. [ 221 ] mengembangkan NLC yang menggabungkan kation trifenilfosfin dan glikoprotein virus rabies ke permukaan RCM dan obat antioksidan, resveratrol, sebagai pengobatan potensial untuk penyakit Alzheimer (AD). RCM-NLC mencapai sirkulasi darah yang diperpanjang, pelepasan obat yang diperpanjang, penargetan sel neuron yang tepat dengan intensitas fluoresensi tinggi di otak, dan lokalisasi berikutnya dalam mitokondria [ 221 ]. [ 219 ] merancang SLN berlapis RCM yang menampilkan peptida T7 dan NGR untuk menargetkan glioma dan mengatasi sawar darah-otak tumor (BBTB) dan BBB. NGR berfungsi sebagai ligan peptida untuk CD13, yang diekspresikan secara berlebihan selama angiogenesis, menjadikannya target yang menjanjikan untuk glioma. Dengan membungkus vincristine, sistem yang dikembangkan menunjukkan efek antitumor yang optimal, memanfaatkan mekanisme pengiriman penargetan ganda yang sinergis [ 219 ].
Xie et al. [ 200 ] mengembangkan RCM-LIP dengan konfigurasi RCM yang tepat (Gambar 7a ), untuk meningkatkan kontrol terapeutik atas jamur patogen, Candida albicans. RCM-LIP (dilambangkan “RBC-LIP”) menunjukkan kandungan protein yang sebanding dengan RCM yang diobati (dilambangkan “RBCm”) (Gambar 7b ) dengan keberhasilan preservasi CD47 dan pita 3 (Gambar 7c ). RBC-LIP melampaui durasi sirkulasi PEG-LIP tradisional dan menunjukkan stabilitas yang tinggi. Dalam menghindari penangkapan makrofag, RBC-LIP juga lebih unggul daripada PEG-LIP karena protein esensial yang ada dalam RCM. RCM-LIP yang dimuat Amfoterisin B (dilambangkan “RBC-LIP-AmB”) menunjukkan sirkulasi yang diperpanjang secara signifikan (konsentrasi darah ganda setelah 24 jam) dibandingkan dengan PEG-LIP 5% (Gambar 7d ). Dengan menggunakan model tikus in vivo dari candida albicans, kelangsungan hidup selama lebih dari 15 hari diamati pada 75% tikus yang terinfeksi dan diobati dengan RCM-LIP yang dimuat amfoterisin B, sedangkan pada kelompok yang tersisa, tingkat kelangsungan hidup menurun secara signifikan (Gambar 7e ), dan RCM-LIP secara efektif menurunkan unit pembentuk koloni (CFU) di paru-paru tikus yang terinfeksi dibandingkan dengan PEG-LIP (Gambar 7f ). Pencitraan langsung juga mengungkapkan akumulasi RCM-LIP yang jelas di paru-paru yang terinfeksi (Gambar 7g ). Selain itu, sinyal MRI di dalam paru-paru menunjukkan bahwa RCM-LIP yang dimuat amfoterisin B menunjukkan pemulihan penuh tanpa sinyal infeksi apa pun, melampaui hasil kelompok lain (Gambar 7h ).
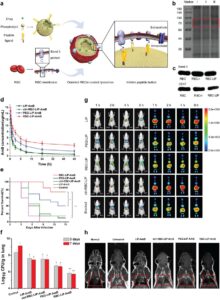
3.4.2 CMC-LNP imun
Neutrofil, limfosit, sel pembunuh alami (NK), makrofag, dan lainnya dalam sistem imun dapat berfungsi sebagai sumber membran sel. Dengan melapisi LNP dengan membran sel ini, CMC-LNP yang dihasilkan mewarisi fitur antigenik dari sel induk, yang memungkinkan mereka untuk secara efektif melawan berbagai komponen patologis yang rumit [ 235 ]. Membran sel yang berbeda ini, masing-masing disetel dengan baik untuk fungsionalitas yang optimal, telah digunakan untuk meningkatkan biokompatibilitas, meningkatkan waktu sirkulasi, memodulasi imunitas, dan memberikan kemampuan penargetan sel tertentu ke LNP [ 178 , 208 , 238 , 239 ]. Membran sel T memiliki reseptor permukaan khusus, seperti reseptor sel T, yang meningkatkan pengikatan antigen berbasis tumor serta sirkulasi darah [ 240 , 241 ]. Membran sel dendritik menunjukkan karakteristik yang terkait dengan presentasi antigen dan modulasi imun [ 242 ]. Makrofag berkontribusi secara signifikan terhadap regulasi respons imun. Mereka mengenali dan menghilangkan berbagai bahaya, termasuk sel tumor dan ancaman eksternal seperti virus dan bakteri melalui presentasi antigen dan fagositosis [ 243 ]. Jadi, MCM menunjukkan karakteristik modulasi imun dan inflamasi yang luar biasa, dan penargetan tumor yang efektif serta tempat yang meradang dan terinfeksi [ 177 , 241 ]. Lebih jauh lagi, makrofag adalah komponen penting dalam TME, di mana respons mereka terhadap sinyal menentukan kekebalan kanker dan memengaruhi perkembangan tumor [ 244 ]. Studi terbaru pada CMC-NP yang terdiri dari membran sel imun telah menunjukkan potensi yang signifikan untuk pengiriman yang ditargetkan pada keganasan dan kondisi inflamasi [ 245 , 246 ].
Tang et al. [ 198 ] mengembangkan MCM-LIP untuk mengeksploitasi sifat alami makrofag untuk terakumulasi di lokasi cedera sumsum tulang belakang (SCI) melalui reseptor kunci, integrin α4 dan Mac-1, di seluruh subtipe makrofag yang berbeda (Gambar 8a ). Mereka menunjukkan pengurangan signifikan sebesar 26% dalam internalisasi MCM-LIP (dilambangkan “RM-LIP”) oleh makrofag dibandingkan dengan PEG-LIP. Pengurangan ini bahkan lebih jelas daripada LIP polos (Gambar 8b ). Selain itu, MCM-LIP yang dimuat minocycline (dilambangkan “RM-LIP/MC”) menunjukkan waktu sirkulasi darah yang lebih lama dibandingkan dengan kelompok lain (Gambar 8c ) yang menunjukkan kemampuan sistem yang signifikan untuk memperpanjang waktu sirkulasi dan terakumulasi di lokasi SCI. Pencitraan sumsum tulang belakang secara eks vivo mengungkap peningkatan yang luar biasa dalam sinyal fluoresensi di lokasi cedera tikus SCI dalam kelompok RM-LIP. Ini melampaui level yang diamati pada kelompok perawatan lain, membuktikan selektivitas yang lebih tinggi untuk menargetkan lokasi cedera (Gambar 8d ). Menggunakan kumarin 6 (C6), analisis kuantitatif distribusi formulasi in vivo menunjukkan selektivitas RM-LIP yang lebih unggul tanpa penetrasi ke sumsum tulang belakang normal (Gambar 8e ). Dengan mengevaluasi level sitokin proinflamasi penting TNF-α dan IL-6 pada sumsum tulang belakang yang cedera, kelompok RM-LIP/MC menunjukkan pengurangan tertinggi dibandingkan dengan kelompok lain dalam penelitian ini (Gambar 8f ). Analisis melalui pewarnaan H&E mengungkap peningkatan signifikan dalam kondisi sumsum tulang belakang dalam kelompok RM-LIP/MC. Peningkatan ini ditandai dengan pengurangan yang luar biasa dalam volume rongga lesi, disertai dengan kecenderungan menonjol menuju integritas struktural (Gambar 8g ). Menariknya, level integrin α4 dan Mac-1 dalam makrofag, bersama dengan efisiensi penargetan sistem untuk SCI, diamati tidak berhubungan dengan status polarisasi makrofag. Hal ini tidak hanya menggarisbawahi potensi pengiriman obat yang ditargetkan dalam SCI tetapi juga menyoroti fleksibilitas dan kemanjuran sistem di berbagai keadaan aktivasi makrofag.
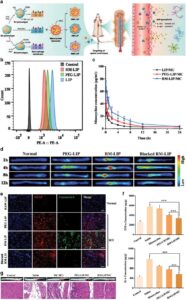
Studi lain oleh Cao et al. [ 216 ] menyarankan pendekatan pengobatan untuk metastasis paru-paru dalam model kanker payudara 4T1. Mereka mengembangkan MCM-LIP yang dimuat emtansine yang dilapisi dengan membran makrofag RAW 264.7. Dalam percobaan seluler, nanosistem yang dikembangkan menunjukkan peningkatan penyerapan seluler oleh sel kanker payudara 4T1 metastatik dibandingkan dengan LIP yang tidak dilapisi. Selain itu, MCM memiliki efek penghambatan pada viabilitas sel, yang menunjukkan potensi manfaat terapeutik. Percobaan in vivo menunjukkan bahwa MCM-LIP secara efektif menargetkan sel metastatik dan secara signifikan menekan metastasis paru-paru. Spesifisitas yang ditargetkan ini disebabkan oleh penanda integrin α4β1 dalam MCM [ 216 ].
Dengan memanfaatkan sumber yang sama untuk MCM dan model hewan, Liang dan timnya memperkenalkan MCM-LIP yang dimuat dengan DOX dan titik kuantum kuartener. MCM memainkan peran dalam melindungi struktur LIP dan mencegah kebocoran. LIP yang dilapisi menunjukkan sinyal fluoresensi yang lebih kuat dalam sel 4T1 dan sinyal yang lebih lemah dalam sel makrofag RAW 264.7 dibandingkan dengan LIP yang tidak dilapisi, yang menunjukkan penargetan tumor dan penghindaran imun yang lebih baik. Selain menunjukkan akumulasi yang signifikan dalam jaringan lesi paru-paru tikus dengan penargetan nodul metastasis yang tepat, MCM-LIP menunjukkan efek theranostik in vivo yang baik, yang menekankan kemampuannya untuk memandu dan memantau terapi secara efektif [ 248 ].
Lai et al. [ 249 ] merancang MCM-LNP yang diisi dengan IR-792, pewarna fluoresensi untuk melewati BBB dan mengobati glioblastoma. Mereka menunjukkan penumpukan selektif di lokasi tumor. Ketika dikombinasikan dengan perawatan laser, MCM-LNP ini tidak hanya menginduksi kematian sel U87L tetapi juga secara efektif menghambat pertumbuhan glioblastoma multiforme ortotopik. Khususnya, potongan organ dari tikus menunjukkan morfologi yang diawetkan dan tidak ada perubahan patologis yang signifikan 48 jam setelah injeksi intravena. Hal ini menggarisbawahi sitotoksisitas akut sistem yang rendah dan menyoroti potensi keamanannya untuk aplikasi terapeutik [ 249 ].
Sel NK dapat menargetkan dan menghilangkan sel kanker tanpa memerlukan sensitisasi sebelumnya [ 192 , 250 ]. Pitchaimani et al. [ 192 ] mengeksploitasi LIP yang dilapisi dengan NKCM (dilambangkan “NKsomes”) (Gambar 9a ). Studi in vitro dengan sel MCF-7, yang terpapar NKCM-LIP yang terkait dengan rhodamine, menunjukkan integritas dan penanda CD56 yang baik (Gambar 9b ). Uji aliran dan pewarnaan imunofluoresensi menunjukkan akumulasi NKCM-LIP yang lebih tinggi pada sel MCF-7 dibandingkan dengan LIP yang tidak dilapisi (bare LIPO), yang menunjukkan penargetannya yang efektif (Gambar 9c ). Selain itu, potensi terapeutik NKCM-LIP dinilai dengan memuatnya dengan DOX, yang menciptakan “DOX@NKsomes.” Evaluasi imunogenisitas NKCM-LIP menunjukkan respons imunogenik minimal dengan hanya kelompok DOX bebas yang menunjukkan peningkatan karena efek imunomodulatori obat (Gambar 9d ). Pada akhir periode pengobatan dalam model kanker payudara MCF-7, hewan yang diobati dengan NKCM-LIP DOX bebas dan yang dimuat DOX menunjukkan pengurangan volume tumor yang signifikan. Sebaliknya, pemberian NKCM-LIP tanpa muatan dikaitkan dengan pertumbuhan tumor yang berkelanjutan (Gambar 9e,f ).
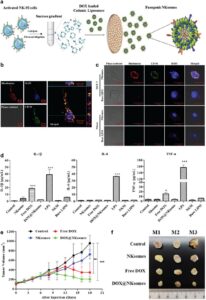
Di dalam aliran darah, trombosit berperan sebagai pemain kunci dalam hemostasis. Dengan mengatur serangkaian reaksi kaskade, trombosit ini secara tepat menavigasi menuju lokasi perdarahan, tidak hanya mencegah pembentukan trombus tetapi juga menjaga integritas keseluruhan sirkulasi darah [ 251 , 252 ]. Sama seperti RCM, PCM memiliki banyak protein “pengenalan diri”, yang secara signifikan mengurangi imunogenisitasnya di dalam tubuh dan memperpanjang waktu mereka dalam sirkulasi [ 251 ]. PCM memiliki ekspresi P-selectin tinggi yang menunjukkan kemampuan pengenalan dan pengikatan yang tepat dengan reseptor CD44, yang banyak terdapat dalam sel kanker. Interaksi ini mendorong trombosit di lingkungan sekitarnya untuk membuat semacam perisai, meningkatkan proliferasi dan kelangsungan hidup sel kanker dalam aliran darah [ 253 ]. Dengan memanfaatkan pengenalan khusus ini, aplikasi PCM-LNP menjanjikan untuk terapi kanker. Dengan memanfaatkan karakteristik trombosit, nanosistem berlapis PCM juga digunakan untuk kondisi penyakit vaskular dan bakteri [ 254 , 255 ]. Sayangnya, PCM menghadapi tantangan dengan proses pemurnian yang rumit, dan potensi penargetannya terbatas pada jenis tumor tertentu [ 208 , 234 ]. Peran trombosit dalam angiogenesis dan interaksi dengan sel tumor dimanfaatkan oleh Bang et al. [ 222 ] dengan mengembangkan PTX-loaded-PCM-NLCs. Pelapisan PCM yang efektif divalidasi melalui pengenalan CD41. Studi seluler in vitro mengungkapkan afinitas PCM-NLC yang lebih tinggi terhadap sel tumor dibandingkan dengan NLC yang tidak dilapisi [ 222 ].
Selain itu, Geng dan koleganya [ 185 ] menciptakan LIP yang dilapisi dengan PCM dan IR1048 terintegrasi, disebut sebagai “BLIPO-1048,” untuk fototerostik inframerah dekat (NIR-II). Mereka menerapkan nanosistem ini dalam berbagai model tumor seperti kanker payudara, kanker pankreas, dan glioma (Gambar 10a ). Susunan protein dari sistem yang direkayasa mencerminkan PCM sedangkan LIP yang tidak dilapisi yang disebut sebagai “LIPO-1048,” tidak menunjukkan kesamaan dalam profil proteinnya (Gambar 10b ). Karakteristik penargetan aktif sistem nano dinilai melalui metode in vitro dan in vivo, menggunakan fluoresensi untuk evaluasi in vitro dan teknik pencitraan fotoakustik (PA) NIR-II untuk penilaian in vivo. Protein membran CD47 pada PCM secara efektif menghambat fagositosis yang dimediasi makrofag dengan mengirimkan sinyal “jangan makan aku”. Properti antiphagocytic ini dikonfirmasi melalui flow cytometry (Gambar 10c ) dan pencitraan CLSM (Gambar 10d ). Intensitas fluoresensi yang diamati dalam sel yang diobati dengan LIP yang tidak dilapisi lebih tinggi daripada yang ada dalam kelompok yang terpapar LNP biomimetik, yang mengonfirmasi sifat penghindaran imunnya. Kehadiran reseptor CD44 pada PCM memfasilitasi pengiriman yang ditargetkan dan internalisasi dalam sel. Pencitraan NIR-II PA in vivo menunjukkan bahwa PCM-LIP memiliki intensitas sinyal tertinggi di lokasi tumor dibandingkan dengan kelompok lain, dengan peningkatan yang nyata pada sel glioma (Gambar 10e ). Lebih jauh lagi, kombinasi PCM-LIP dengan perawatan laser menyebabkan penghambatan pertumbuhan tumor yang paling signifikan (Gambar 10f ) dan menghasilkan tingkat kelangsungan hidup tertinggi untuk model glioma (Gambar 10g ).
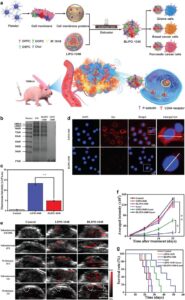
CCM digunakan secara luas untuk meningkatkan fungsionalitas NP. Strategi ini memanfaatkan kemampuan sel kanker untuk beragregasi dan membentuk tumor padat, didorong oleh protein adhesif pada permukaannya. Dengan membungkus LNP dengan CCM dan mengisinya dengan terapi, NP ini dapat secara efektif menargetkan dan menumpuk di lokasi kanker, sehingga meningkatkan presisi dan kemanjuran pemberian obat [ 256 , 257 ]. Potensi sel kanker untuk berkembang biak tanpa batas in vitro menyediakan sumber membran sel yang berharga. Ini sangat menguntungkan untuk mengeksploitasi sifat penargetan homolognya, di mana pemilihan jenis CCM yang sama sangat penting untuk penargetan yang efektif [ 256 , 258 ]. Kehadiran molekul adhesi pada CCM membantu memperpanjang waktu sirkulasi CCM-LNP. Ini dicapai melalui efek kamuflase CCM, yang dimediasi oleh protein seperti CD47, yang memungkinkan CCM-LNP untuk menghindari deteksi oleh sel imun [ 258 , 259 ]. Mengingat karakteristik CCM yang luar biasa ini, CCM-LNP memiliki potensi besar untuk meningkatkan kemanjuran pengobatan kanker [ 145 ]. Namun, CCM memiliki waktu sirkulasi yang lebih singkat dibandingkan dengan RCM [ 208 ], dan menimbulkan pertimbangan terkait keamanan [ 234 ].
Ling et al. [ 182 ] menciptakan bakteri hantu yang dimuat CCM-LIP dengan PTX (“LP@BG@CCM”) untuk meningkatkan imunomodulasi dan penargetan tumor untuk kanker paru metastasis (Gambar 11a ). Tidak seperti kontrol (dilambangkan “BG,” “LP,” dan “LP@BG”), bakteri hantu yang dimuat CCM-LIP menunjukkan ekspresi protein CD44 dan CD47 yang menonjol (Gambar 11b ), dikonfirmasi oleh pewarnaan Dil dan C6 (Gambar 11c ). Sistem ini meningkatkan faktor imun seperti sel T CD8a+/CD4+ (Gambar 11d,e ) dan sitokin (TNF-α, IL-4, IFN-γ) di paru-paru dan secara signifikan meningkatkan apoptosis sel tumor seperti yang ditunjukkan melalui penilaian ekspresi Caspase-3 dan TUNEL (Gambar 11f ). Sistem yang dikembangkan menunjukkan efek antitumor yang superior dalam model metastasis paru kanker payudara 4T1, dengan berat paru yang berkurang dan struktur paru yang jelas (Gambar 11g ). Selain itu, tidak menunjukkan perbedaan yang signifikan secara statistik dibandingkan dengan kelompok yang sehat, yang menegaskan peningkatan substansial pada paru-paru. Studi biodistribusi menunjukkan intensitas paru yang lebih tinggi dengan nanosistem berlapis dibandingkan dengan kelompok lain (Gambar 11h ). Akumulasi yang ditingkatkan dalam sel tumor dikaitkan dengan kemampuan penargetan homolog CCM, yaitu bersama dengan efek imunomodulatori, membentuk kemo-imunoterapi sinergis yang luar biasa.
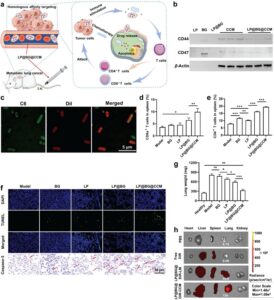
Untuk mengatasi buruknya penetrasi obat dalam pengobatan glioma, Chen et al. [ 217 ] mengembangkan CCM-NLC dengan melapisi NLC yang diisi dengan dihidroartemisinin dengan membran sel glioma. Mereka meningkatkan penargetan dengan menggabungkan ligan seperti NGR. CCM-NLC menunjukkan kemanjuran penargetan yang tinggi, berhasil melewati BBB dan BBTB. Dalam percobaan laboratorium dan model hewan, NLC berlapis ini menunjukkan efek antitumor yang signifikan, termasuk pengurangan pertumbuhan tumor dan perpanjangan kelangsungan hidup pada tikus [ 217 ].
Soprano et al. [ 260 ] mengeksplorasi kapasitas CCM-LNP untuk menyatu dengan membran plasma dan mengirimkan berbagai muatan ke dalam sitosol sel hidup. Mereka mengusulkan penggunaan fusogen—protein yang menginduksi fusi antara nanocarrier dan membran sel. Dengan menggabungkan kemampuan penargetan homotipe CCM dengan fitur fusogenik, mereka mencapai pengiriman kargo tertutup intraseluler yang cepat. Berbagai molekul kargo diuji, termasuk bisbenzimide, phalloidin, polimer dekstran, NP polistirena, dan Cas9/sgRNA. Nanosistem yang dihasilkan menunjukkan sifat fusogenik karena fitur seperti fusogen dari lipid eksogen yang dimasukkan, memungkinkan mereka untuk melewati penyimpanan lisosomal dan secara efektif mengirimkan kargo ke dalam sitosol, sehingga meningkatkan efek terapeutik [ 260 ].
3.4.5 LNP berlapis membran sel punca
Sel punca, yang dikenal karena kemampuan pembaruan diri dan diferensiasinya, menawarkan sifat-sifat unik melalui reseptor membran sel seperti reseptor faktor pertumbuhan dan kemokin [ 261 ]. Membran sel punca (SCM)-LNP, yang memadukan atribut sel punca ini dengan fitur-fitur LNP yang menguntungkan, memiliki potensi untuk mengatasi berbagai kondisi medis [ 262 ]. Mereka juga memiliki sifat imunoregulasi yang mengurangi penyerapan makrofag dan menunjukkan tropisme tumor, sehingga menjanjikan untuk terapi antitumor [ 263 ]. Meskipun SCM-LNP belum diterapkan secara luas, potensinya untuk penelitian di masa depan cukup signifikan.
3.4.6 LNP berlapis HCM
Untuk memperluas manfaat CMC, para peneliti telah mengeksplorasi pengembangan HCM-coated-NPs (HCM-NPs) dengan menggunakan beberapa membran sel. Ini dimulai dengan membuat NP yang dilapisi dengan membran trombosit dan sel darah merah yang menyatu [ 264 ]. Fusi RCM dan PCM yang berhasil dikonfirmasi melalui pemasangan FRET dan CLSM. Dalam studi terkait, Zhang dan rekannya [ 265 ] mengembangkan hibrida sel darah merah-kanker NP berlapis membran untuk kemoterapi gabungan dan pengobatan fototermal melanoma. Sistem ini menunjukkan penargetan sel melanoma yang lebih baik dan waktu sirkulasi yang lebih lama. Temuan ini menyoroti potensi untuk menciptakan berbagai kombinasi membran sel, yang berpotensi menghasilkan LNP berlapis multimembran baru dengan fungsionalitas yang ditingkatkan. Namun, persiapan dan pemurnian membran ini tetap merupakan proses yang rumit dan memakan waktu [ 234 ].
Dengan menggabungkan HCM sebagai pelapis pada LNP, Xie et al. [ 266 ] bertujuan untuk meningkatkan kemanjuran antitumor terhadap kanker payudara. Mereka menggabungkan chikusetsusaponin IVa metil ester, suatu fitokonstituen dari pengobatan tradisional Tiongkok, dengan klorin e6, suatu agen fotodinamik, dalam LIP. Sistem, yang dilapisi dengan HCM (komponen sel darah merah dan sel kanker) dan dimodifikasi dengan RGD, menunjukkan peningkatan penargetan, kelarutan, dan hasil pengobatan. Sistem ini berhasil menghindari fagositosis yang diinduksi makrofag, menunjukkan sirkulasi yang lebih lama, menargetkan tumor secara efektif tanpa merusak jaringan normal, dan menghambat metastasis kanker payudara. Pengenalan modifikasi RGD ke membran selanjutnya memperkuat efisiensi penargetan HCM-LIP. Selain itu, HCM-LIP menunjukkan kemanjuran yang lebih tinggi dalam menghambat metastasis kanker payudara, sebagaimana dibuktikan oleh berkurangnya intensitas sinyal fluoresensi yang diamati dalam pencitraan protein MMP9. Peningkatan khasiat ini dikaitkan dengan penghambatan pertumbuhan sel, induksi apoptosis, dan pengurangan metastasis tumor [ 266 ]. Kemajuan lain dalam LNP adalah pengembangan leutusome, yang terdiri dari lapisan ganda leukosit dan sel kanker untuk memanfaatkan manfaat dari kedua membran (Gambar 12a ) [ 218 ]. Uji in vitro mengonfirmasi bahwa leutusome meniru komponen membran plasma utama dari kedua jenis sel. PTXL yang dimuat leutusome (“LTM-PTXL”) dan PTXL yang dimuat CCM (“TM-PTXL”) menunjukkan khasiat penghambatan yang lebih unggul dibandingkan dengan PTXL yang dimuat membran leukosit (“LM-PTXL”), PTXL bebas, dan Taxol (Gambar 12b ). Efek antitumor yang ditingkatkan ini dikaitkan dengan peningkatan penyerapan seluler yang difasilitasi oleh penargetan CCM yang homotipe. Studi in vivo menggunakan model tikus kanker kepala dan leher menunjukkan bahwa leutusome secara efektif terakumulasi di lokasi tumor, mencapai 79,1 ± 6,6% ID per gram tumor (Gambar 12c ), dan menunjukkan sirkulasi darah yang berkepanjangan. DiRL yang dimuat leutusome dan DiRL yang dimuat CCM juga memiliki akumulasi jaringan tumor tertinggi dan distribusi yang berkurang ke organ lain dibandingkan dengan kelompok DiRL (Gambar 12c,d ). Dampak terapeutik yang signifikan dari PTXL yang dimuat leutusome dikonfirmasi dengan mengamati apoptosis sel tertinggi (Gambar 12e ) dan ukuran tumor terkecil (Gambar 12f ), yang menunjukkan manfaat terapeutik yang substansial dengan efek samping sistemik yang minimal.
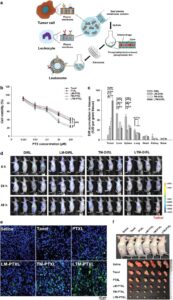
Kemajuan dalam teknik CMC dan beragamnya jenis sel yang tersedia telah membuka jalan untuk mengeksplorasi berbagai membran sel untuk modifikasi LNP. Eksosom yang dilepaskan oleh berbagai jenis sel seperti sel induk, sel epitel, sel imun, dan sel endotel merupakan kandidat yang menjanjikan untuk tujuan ini [ 267 – 269 ]. Mereka mengandung beragam protein terikat membran dan intraseluler, termasuk yang terlibat dalam fusi dan transportasi membran, tetraspanin, kompleks histocompatibilitas utama, protein syok panas, dan protein terkait rakit lipid [ 270 , 271 ]. Rayamajhi dkk. [ 226 ] menggabungkan LIP sintetis dengan eksosom untuk membuat eksosom hibrida (HE). Vesikel rekayasa ini mempertahankan atribut fungsional eksosom sambil meningkatkan pemuatan obat dan stabilitas koloid. Fusi vesikel makrofag tikus dengan LIP sintetis dikonfirmasi melalui eksperimen berbasis fluoresensi. Analisis protein selanjutnya memverifikasi keberadaan penanda penting, yaitu CD81, CD9, dan CD63. Setelah berinteraksi dengan sel normal dan sel kanker, HE menunjukkan respons seluler yang berbeda. HE yang dimuat DOX menunjukkan peningkatan toksisitas terhadap sel kanker dan pelepasan obat yang responsif terhadap pH dalam kondisi asam, meningkatkan pengiriman kargo ke lingkungan tumor yang asam [ 226 ]. Peneliti lain telah mengeksplorasi teknik fusi membran dengan sistem berbasis lipid, khususnya LIP, dan mencapai hasil yang menjanjikan [ 272 – 274 ]. Selain itu, membran bakteri, yang kaya akan antigen imunogenik, menawarkan jalan yang menjanjikan untuk modifikasi LNP. Melapisi LNP dengan membran bakteri menghadirkan strategi yang menarik untuk memerangi virus dan mengobati berbagai penyakit menular [ 153 , 275 , 276 ]. Lebih jauh lagi, fibroblas terkait kanker memainkan peran penting dalam TME berbagai kanker, sering mengubah mikrovaskulatur tumor dan menghambat pengiriman obat kemoterapi ke tumor pankreas. Untuk mengatasi hal ini, Zhang et al. [ 277 ] mengembangkan LIP berlapis fibroblast terkait kanker menggunakan sel A-NIH/3T3 sebagai sumber membran sel. Pendekatan ini bertujuan untuk mencapai penargetan homotipe dan meningkatkan akumulasi obat dalam jaringan tumor pankreas [ 277 ]. Selain itu, membran dengan kesamaan struktural dengan membran plasma, seperti yang berasal dari nukleus, mitokondria, dan lisosom, juga telah digunakan untuk memodifikasi NP [ 153 ], dan disarankan sebagai bahan pelapis potensial untuk LNP dalam aplikasi masa depan. Ringkasan aplikasi berbagai jenis CMC-LNP disajikan dalam Tabel 2 .
| Jenis membran | Sumber sel | Metode fusi | Inti LNP | Muatan | Ukuran (nm) | Model terapi | Fungsi utama | Tahun | Referensi | |
|---|---|---|---|---|---|---|---|---|---|---|
| Sel darah merah | Sampel darah dari tikus Kunming | Ekstrusi | Bahasa Indonesia: NLC | Obat Paclitaxel | 60,3 ± 3,0 | Tikus Kunming pembawa tumor S180 | Waktu sirkulasi darah yang diperpanjang dan kemampuan penargetan tumor yang ditingkatkan | Tahun 2020 | [ 199 ] | |
| Sampel darah dari tikus Kunming | Ekstrusi | BIBIR | Amfoterisin B | ≈100 | Model tikus yang terinfeksi paru-paru (Candida albicans) | Sirkulasi yang diperpanjang dan kemampuan penargetan | Tahun 2019 | [ 200 ] | ||
| Darah dari tikus ICR | Ekstrusi | Bahasa Indonesia: NLC | Obat Resveratrol | 152,4 ± 0,4 | Model tikus AD | Sirkulasi jangka panjang, menargetkan sel neuron dan meredakan gejala AD | Tahun 2020 | [ 221 ] | ||
| Darah dari tikus ICR | Ekstrusi | SLN | Vinkristin | 123,7 ± 0,7 | Model tikus pembawa glioma (sel C6) | Penetrasi BBB, menargetkan sel glioma dengan efek penghambatan yang lebih nyata. | Tahun 2019 | [ 219 ] | ||
| Trombosit | Darah dari vena jugularis tikus | Sonikasi | Bahasa Indonesia: NLC | Obat Paclitaxel | 171,0 ± 0,3 | Dalam tabung reaksi | Kemampuan menargetkan sel tumor | Tahun 2019 | [ 222 ] | |
| Darah dari tikus | Ekstrusi | BIBIR | pewarna IR 1048 | 119,8 ± 2,0 | Glioma (sel C6, kanker payudara 4T1 dan model tikus kanker pankreas SW1990) | Menargetkan jaringan tumor dan menghindari sistem imun | Tahun 2020 | [ 185 ] | ||
| Sel kekebalan tubuh | Makrofag | Sel RAW 264.7 | Ekstrusi | BIBIR | Minosiklin | 110,1 ± 2,0 | Model tikus SC | Waktu sirkulasi yang lama dan akumulasi di lokasi cedera tikus SCI | Tahun 2021 | [ 198 ] |
| Makrofag peritoneum yang berasal dari tikus C57BL/6J | Ekstrusi | SLN | Genistein | 123,2 ± 0,6 | Model tikus AD | Sirkulasi yang berkepanjangan, penargetan saraf, dan penundaan perkembangan AD. | Tahun 2021 | [ 223 ] | ||
| Sel RAW 264.7 | Ekstrusi | BIBIR | Saponin Panax Notoginseng dan Ginsenoside Rg3 | 177,7 ± 0,7 | Model tikus oklusi seni otak tengah | Peningkatan penargetan tumor dan kemanjuran terapi pada stroke | Tahun 2024 | [ 278 ] | ||
| Sel RAW 264.7 | Ekstrusi | BIBIR | Emtansina | 115.4 | Model tikus metastasis paru-paru kanker payudara | Menargetkan dan menekan situs metastasis paru-paru kanker payudara | Tahun 2016 | [ 216 ] | ||
| Sel J774A.1 | Ekstrusi | BIBIR | 7-etil-10-hidroksi kamptotesin (SN-38) | 129,5 ± 8,4 | Model tikus xenograft HCT116 ortotopik | Mencapai efek antitumor yang aman dan efisien pada kanker kolorektal | Tahun 2024 | [ 279 ] | ||
| Sel RAW 264.7 | Ekstrusi | BIBIR | Doksorubisin dan titik kuantum kuartener (QD) | 146,0 ± 2,3 | Model tikus metastasis paru-paru kanker payudara | Memperpanjang waktu sirkulasi dan secara efektif menargetkan lokasi tumor | Tahun 2020 | [ 248 ] | ||
| Sel pembunuh alami | Sel NK-92 | Ekstrusi | BIBIR | Doksorubisin | ≈90 | Model tumor padat yang berasal dari MCF-7 pada tikus NU/NU | Peningkatan aktivitas antitumor, afinitas yang lebih baik terhadap jaringan tumor, dan waktu tinggal plasma yang diperpanjang | Tahun 2018 | [ 192 ] | |
| Sel kanker | Membran sel adenokarsinoma payudara manusia (MCF-7) | Sonikasi | LIP-MSN yang dilapisi PEG | Doksorubisin dan mefuparib hidroklorida | 180 | Tikus telanjang yang mengandung tumor xenograft MCF-7 | Profil lolos dari kekebalan tubuh yang baik dan kemampuan menargetkan tumor yang homologus | Tahun 2019 | [ 191 ] | |
| Sel astrocytoma manusia U87MG | Ekstrusi | BIBIR | Doksorubisin | 91,1 ± 2,8 | Model tikus xenograft U87MG | Peningkatan penargetan tumor dan kemanjuran terapi | Tahun 2024 | [ 280 ] | ||
| Sel kanker payudara 4T1 | Ekstrusi | Hantu Bakteri (BG) yang dienkapsulasi LIP | Obat Paclitaxel | 719,2 ± 14,7 | Model tikus kanker paru metastasis kanker payudara 4T1 | Penargetan paru-paru yang baik, stimulasi kekebalan, dan efek membunuh sel kanker paru-paru metastatik | Tahun 2023 | [ 182 ] | ||
| Sel glioma C6 | Sonikasi | Bahasa Indonesia: NLC | Dihidroartemisinin | 130 | model tikus glioma C6 in situ | Efek penargetan tumor yang lebih baik dan penghambatan pertumbuhan tumor glioma. | Tahun 2021 | [ 217 ] | ||
| Sel melanoma B16-F10 | Ekstrusi | SLN | Metil 5-aminolevulinat dan desferioksamin | 200 | Model tikus melanoma B16-F10 | Peningkatan penargetan dan efektivitas pengobatan | Tahun 2024 | [ 281 ] | ||
| Sel Mia PaCa-2 | Ekstrusi | BIBIR | siRNA yang membungkam protein autofagi 5 (siATG5) yang memuat inti kalsium fosfat | 77.3 | Model tikus xenograft kanker pankreas Mia PaCa-2 | Meningkatkan pemberian kemoterapi pada kanker pankreas | Tahun 2024 | [ 282 ] | ||
| Sel glioma C6 | Ekstrusi | SLN | Indocyanine hijau (ICG) | 118,0 ± 1,1 | Model tikus glioma subkutan | Meningkatkan penargetan tumor, apoptosis, dan merangsang respon imun terhadap tumor | Tahun 2023 | [ 283 ] | ||
| Sel hibrida | RCM (darah yang diambil dari mata tikus atau manusia) dan CCM (4T1 dan MDA-MB 231) | Sonikasi | BIBIR | Chikusetsusaponin IVa metil ester dan klorin e6 | 100–120 | Model tikus kanker payudara 4T1 | Waktu paruh diperpanjang, peningkatan penghindaran kekebalan dan kemampuan penargetan | Tahun 2021 | [ 266 ] | |
| Leukosit (sel murine J774A.1) dan CCM (sel tumor kepala dan leher HN12) | Ekstrusi | BIBIR | Obat Paclitaxel | ≈160 | Model tikus kanker kepala dan leher | Sirkulasi darah yang berkepanjangan, akumulasi di lokasi tumor, dan penghambatan pertumbuhan tumor | Tahun 2018 | [ 218 ] | ||
| Yang lain | Eksosom | Sel J774A.1 | Ekstrusi | BIBIR | Doksorubisin | 177 ± 21 | Dalam tabung reaksi | Peningkatan penargetan tumor dan sitotoksisitas | Tahun 2019 | [ 226 ] |
3.5 Keamanan dan Biokompatibilitas CMC-LNP
Karena komponen alami dan biokompatibel yang digunakan dalam mendesain CMC-LNP, sistem ini menunjukkan kompatibilitas dan keamanan biologis yang luar biasa. Uji sitotoksisitas in vitro telah menunjukkan hal ini, dengan RCM-NLC kosong yang dikembangkan oleh Han et al. [ 221 ] menunjukkan lebih dari 90% viabilitas sel di sel bEnd.3 dan HT22 setelah 24 jam inkubasi. Selain itu, persentase hemolisis darah yang terpapar RCM-NLC kosong ini tetap tidak berubah dibandingkan dengan kelompok kontrol, yang menunjukkan kompatibilitas darah yang tinggi [ 221 ]. MCM-SLN kosong juga menunjukkan viabilitas sel yang sama di kedua jenis sel [ 223 ]. MCM-LIP yang dikembangkan oleh Liang et al. [ 248 ] untuk pengobatan kanker payudara metastatik diuji pada sel L02 normal untuk menilai selektivitas dan biokompatibilitasnya. Pada berbagai konsentrasi formulasi yang dimuat obat, tingkat kelangsungan hidup sel normal tetap di atas 84%, yang menyoroti toksisitas rendah formulasi terhadap sel normal. Selain itu, formulasi kosong memiliki dampak minimal pada sel kanker 4T1, dengan tingkat kelangsungan hidup melebihi 85% [ 248 ]. Studi lain melaporkan bahwa CMC-LNP kosong memiliki dampak minimal pada lini sel yang relevan, yang menunjukkan biokompatibilitasnya [ 192 , 216 , 219 ]. Biodistribusi CMC-LNP sangat penting untuk kemanjuran terapeutiknya, karena distribusi selektif memungkinkan pengiriman yang ditargetkan dengan toksisitas minimal di luar target. Zhou et al. [ 199 ] menyelidiki biodistribusi in vivo dengan memberi label RCM-NLC dengan pewarna DiR dan menggunakan model tumor S180. RCM-NLC menunjukkan akumulasi yang lebih tinggi pada jaringan tumor yang ditargetkan dibandingkan dengan organ lain [ 199 ]. Pemeriksaan histopatologi berbagai organ—paru-paru, hati, jantung, limpa, otak, dan ginjal—dilakukan untuk menilai dampak in vivo dari RCM-NLC dan MCM-SLN yang dirancang untuk menargetkan sel-sel saraf dan mengobati AD. Tidak ada kerusakan yang diamati pada organ-organ ini dibandingkan dengan kelompok kontrol salin setelah pengobatan [ 221 , 223 ]. MCM-LIP yang dikembangkan oleh Tang et al. [ 198 ] untuk mengobati SCI menunjukkan selektivitas yang signifikan untuk sumsum tulang belakang yang rusak, dengan penetrasi minimal ke area yang sehat, yang mengonfirmasi keamanannya yang luar biasa. Dalam studi terkait keamanan lainnya, RCM-LIP yang dikembangkan oleh Xie et al. [ 200 ] untuk mengobati infeksi Candida albicans secara efektif menetralkan hemotoksin yang disekresikan oleh patogen, yang menyebabkan toksisitas hemolisis. Sebaliknya, LIP yang tidak dilapisi tidak menawarkan perlindungan yang memadai.
3.6 Aplikasi Lintas Disiplin CMC-LNP
3.6.1 Imunoterapi Kanker dan Nanovaccine
CMC-LNP telah muncul sebagai alat yang menjanjikan dalam imunoterapi kanker, dengan aplikasi dalam vaksin terapeutik dan pengobatan imunomodulatori. Dalam vaksin kanker, CMC-LNP memungkinkan pengiriman beragam antigen spesifik tumor, yang sangat mirip dengan profil antigenik sel sumbernya. Heterogenitas ini membantu mengatasi variasi spesifik pasien dalam ekspresi protein, sehingga membuat vaksin berbasis CMC-LNP lebih efektif daripada pendekatan antigen tunggal [ 173 ].
Selain itu, CMC-LNP dapat berfungsi sebagai agen imunomodulator dengan secara langsung memengaruhi respons imun atau memfasilitasi pengiriman agen terapeutik yang ditargetkan ke TME. Penargetan yang tepat ini meningkatkan presentasi antigen, memperkuat aktivasi sel T, dan mendorong respons imun yang kuat terhadap tumor [ 284 , 285 ].
Salah satu keuntungan utama CMC-LNP dalam imunoterapi adalah kemampuannya untuk mengangkut antigen terkait tumor ke sel dendritik secara efisien, sehingga meningkatkan presentasi antigen dan aktivasi sel T. Selain itu, CMC spesifik, seperti yang berasal dari sel NK, dapat digunakan untuk menginduksi polarisasi makrofag M1, yang mengarah pada penghancuran sel tumor secara langsung dan pemrograman ulang TME imunosupresif. Pendekatan ini tidak hanya meningkatkan kekebalan antitumor tetapi juga meningkatkan kemanjuran imunoterapi lain dengan mendorong respons proinflamasi [ 209 , 210 , 286 ].
Meskipun imunoterapi berpotensi, tingkat respons yang rendah tetap menjadi tantangan karena penghindaran imun tumor, heterogenitas tumor, TME imunosupresif, dan variabilitas individu dalam respons imun [ 284 , 287 ]. CMC-LNP membantu mengatasi tantangan ini dengan memfasilitasi penargetan dan akumulasi tumor yang tepat. Melalui penargetan homologus, CMC-LNP dapat meningkatkan pengenalan imun dengan memberikan spektrum antigen terkait tumor yang lebih luas. Selain itu, dengan membungkus obat imunomodulator, mereka dapat memodifikasi TME untuk meningkatkan efektivitas vaksin dan memperkuat tingkat respons imun [ 284 ].
Dengan memanfaatkan kemampuan imunomodulatori dari CMC tertentu, prinsip vaksin yang sudah ada, dan pendekatan terapi seluler yang canggih, CMC-LNP berpotensi untuk mengubah lanskap penyaringan tahap awal vaksin di negara-negara berkembang, sehingga meningkatkan keamanan dan kemanjuran [ 2 , 16 , 288 ].
3.6.2 Pengobatan Regeneratif
CMC-LNP menarik perhatian dalam pengobatan regeneratif karena kemampuannya untuk meningkatkan pengiriman yang ditargetkan, meningkatkan stabilitas agen terapeutik, dan memfasilitasi integrasi dengan sistem biologis. Properti ini membuatnya sangat cocok untuk mengatasi tantangan kompleks dalam perbaikan dan regenerasi jaringan [ 284 ]. Misalnya, CMC-NP telah menunjukkan potensi dalam mengurangi kehilangan tulang dengan menetralkan racun dan membersihkan sitokin inflamasi atau autoantibodi yang terlibat dalam perkembangan osteoporosis [ 289 ]. MCM-LNP, khususnya, telah menunjukkan kemampuan untuk mengisolasi ligan reseptor aktivator faktor nuklir kappa-Β (RANKL) dan TNF-α, memulihkan keseimbangan antara osteoblas dan osteoklas. Hal ini menjadikannya kandidat yang menjanjikan untuk manajemen osteoporosis [ 290 ]. Demikian pula, LNP berlapis membran neutrofil menunjukkan afinitas alami untuk sendi yang meradang karena ekspresi CD11a, menjadikannya berharga untuk pengiriman obat yang ditargetkan dalam terapi osteoartritis [ 291 ]. SCM menghadirkan jalur lain yang menjanjikan untuk pengobatan regeneratif. SCM mengekspresikan berbagai macam reseptor untuk sitokin, kemokin, faktor pertumbuhan, dan interaksi ECM, yang membuat membrannya sangat serbaguna. SCM-LNP telah menunjukkan potensi untuk mengobati osteoartritis, meningkatkan regenerasi tulang rawan, dan memfasilitasi perbaikan tulang karena sifat homing intrinsik dan fungsi pengaturan imunnya [ 261 , 292 , 293 ]. Dalam pengobatan osteoartritis, mempertahankan konsentrasi obat terapeutik dalam sendi tetap menjadi tantangan karena pembersihan cepat melalui kapiler sinovial dan drainase limfatik. LNP berlapis membran kondrosit memberikan solusi dengan meniru sifat alami kondrosit, yang bertanggung jawab untuk produksi dan pemeliharaan ECM. CMC-LNP ini mengekspresikan penanda permukaan seperti CD44, yang memungkinkannya untuk mengikat secara spesifik ke hialuronan dalam ECM tulang rawan. Hal ini meningkatkan retensi obat dalam sendi, memfasilitasi penetrasi tulang rawan yang lebih dalam, dan melindungi kondrosit dari degenerasi, yang pada akhirnya meningkatkan kemanjuran pengobatan [ 181 ].
Neutrofil, sebagai leukosit yang paling responsif, tertarik ke jaringan otak yang rusak dan berinteraksi dengan sel endotel mikrovaskular otak yang meradang melalui integrin β2, Mac-1, dan LFA-1 pada membrannya. Studi menunjukkan bahwa setelah stroke iskemik, transitosis yang dimediasi reseptor dapat memungkinkan zat yang terikat erat untuk masuk ke parenkim otak. Dengan memanfaatkan ini, LNP berlapis membran neutrofil dapat meningkatkan pengiriman yang ditargetkan ke sel endotel yang meradang, menawarkan strategi yang menjanjikan untuk mengobati stroke iskemik dan cedera otak lainnya [ 294 ]. Membran sel leukemia promielositik manusia (HL-60) juga dapat direkayasa untuk meniru perilaku neutrofil, berfungsi sebagai lapisan pelapis untuk meningkatkan pengiriman yang ditargetkan ke daerah otak yang meradang [ 295 ]. Lebih jauh lagi, kemampuan CMC-NP neutrofil untuk menargetkan peradangan digunakan untuk meringankan cedera paru akut yang disebabkan oleh LPS, sambil menghindari toksisitas pada jaringan sehat [ 296 ].
NP berlapis MCM telah menunjukkan potensi yang signifikan, tidak hanya dalam mengobati cedera sistem saraf pusat (SSP) [ 198 ] tetapi juga dalam terapi target berbagai kondisi kardiovaskular, termasuk iskemia-reperfusi, aterosklerosis, dan infark miokard (MI) [ 297 ]. MCM-LNP, yang mengekspresikan IL-6R, TNF-αR, dan IL-1βR secara berlebihan, menawarkan strategi yang menjanjikan untuk mengobati MI, karena peningkatan kadar sitokin inflamasi seperti TNF-α, IL-1, dan IL-6 diketahui berkontribusi terhadap cedera miokard dan kematian sel. Dengan menargetkan dan memblokir sitokin ini, fungsi jantung dapat dipulihkan [ 298 ].
Penggunaan membran trombosit yang diekstraksi dapat mereplikasi beberapa fitur penting trombosit alami, termasuk kemampuannya untuk melekat pada pembuluh darah yang cedera dan secara selektif menargetkan pembuluh darah yang rusak [ 154 ]. Selain itu, neutrofil bergantung pada trombosit untuk memfasilitasi migrasinya ke daerah otak yang terkena selama stroke iskemik. Dengan melekat pada pembuluh darah yang meradang, neutrofil memperluas mikrodomain kaya PSGL-1 yang mendeteksi trombosit yang diaktifkan melalui P-selectin, memicu pengikatan trombosit dan meningkatkan infiltrasi neutrofil ke lokasi cedera. Tang et al. [ 299 ] memanfaatkan fitur ini untuk merancang sistem NP berlapis PCM untuk meningkatkan pengobatan stroke yang ditargetkan sambil memungkinkan pemantauan terapeutik waktu nyata, menawarkan strategi yang menjanjikan untuk intervensi stroke yang lebih baik. Dengan memanfaatkan sifat penargetan peradangan PCM melalui CD47 dan afinitas homing membran sel stellata hati yang diaktifkan, Bai et al. [ 300 ] menciptakan NP yang dilapisi dengan membran sel trombosit dan sel stellata hati, dan menunjukkan efek terapi yang baik dalam mengobati fibrosis hati pada tikus.
Kemampuan khas RCM untuk berinteraksi dengan hemoglobin telah menginspirasi pengembangan NP biomimetik untuk penyembuhan luka. Hemoglobin, sebagai pembawa oksigen utama, memainkan peran ganda dengan menargetkan makrofag yang terkait dengan tumor sekaligus mengurangi hipoksia dengan melepaskan oksigen secara lokal di dalam jaringan tumor. Zhou et al. [ 301 ] mengintegrasikan protein hemoglobin/IFI6 dengan RCM dan mR181a eksternal. Platform ini menunjukkan potensi luar biasa dalam meningkatkan penyembuhan luka dan mengurangi kerusakan kulit akibat radiasi dengan mengurangi peradangan dan mempercepat perbaikan jaringan [ 301 ].
3.6.3 Pengiriman Terapi Asam Nukleat dan Protein
Mengingat potensi LNP yang menjanjikan dalam pemberian terapi berbasis asam nukleat, CMC-LNP menawarkan kemajuan yang menarik dalam bidang ini. Dengan menggabungkan membran sel ke dalam struktur LNP, LNP yang dimodifikasi ini dapat secara signifikan meningkatkan efisiensi pemberian berbagai molekul terapeutik, termasuk siRNA, mRNA, dan protein. Pendekatan ini tidak hanya meningkatkan penyerapan seluler tetapi juga memfasilitasi pemberian yang lebih terarah dan efisien, mengatasi beberapa keterbatasan sistem pemberian tradisional.
siRNA bekerja dengan mengikat urutan mRNA tertentu, yang menyebabkan degradasinya dan menghentikan sintesis protein yang berkontribusi terhadap penyakit. Mekanisme ini telah terbukti efektif dalam pengobatan berbagai kondisi medis. Namun, pengiriman siRNA sistemik yang efektif masih menjadi tantangan karena masalah seperti penyerapan seluler yang buruk, degradasi yang cepat, targetabilitas yang buruk, dan imunogenisitas. Dengan menggunakan CMC, efisiensi pengirimannya meningkat secara signifikan yang mengarah pada hasil terapi yang lebih efektif [ 295 , 296 ].
Yan et al. [ 282 ] menggunakan CCM yang berasal dari sel Mia Paca-2 untuk meningkatkan pengiriman liposomal-siATG5. Hal ini mengakibatkan berkurangnya pengenalan oleh fagosit dan peningkatan penyerapan pengobatan ke dalam jaringan tumor [ 282 ]. Cao et al. [ 296 ] menggunakan CMC neutrofil untuk meningkatkan penargetan dan efektivitas NP yang dimuat si-TLR4 untuk mengobati cedera paru akut yang diinduksi LPS. Membran sel neutrofil membantu NP untuk secara efisien menargetkan tempat peradangan paru, yang mengarah pada pengurangan substansial dalam ekspresi TLR4, NF-κB, TNF-α, dan IL-1β, sementara tidak menunjukkan toksisitas pada jaringan sehat [ 296 ]. Berdasarkan penelitian sebelumnya yang melibatkan sel HL-60, yang dapat diinduksi untuk berdiferensiasi menjadi sel seperti neutrofil yang mampu berinteraksi dengan sel endotel yang diaktifkan, Wang et al. [ 295 ] menggunakan membran sel HL-60 sebagai lapisan pelapis untuk NP yang dimuat siNOX4. Pendekatan ini menghasilkan peningkatan signifikan dalam kelangsungan hidup jaringan dan mempercepat pemulihan setelah cedera iskemik akut [ 295 ].
Untuk meningkatkan pengiriman mRNA, Xu et al. [ 302 ] menggunakan membran sel dendritik untuk melapisi NP yang mengandung mRNA, meningkatkan kemampuannya untuk terakumulasi di kelenjar getah bening dan menyajikan lebih banyak antigen tumor. Selain itu, MCM telah terbukti melindungi mRNA dari degradasi oleh RNase, menawarkan perlindungan lebih lanjut dan memastikan pengiriman mRNA terapeutik yang lebih stabil [ 303 ]. Studi-studi ini menggarisbawahi potensi CMC-LNP yang menjanjikan dalam memajukan pengembangan terapi berbasis asam nukleat yang lebih efektif.
4 Tantangan dan Perspektif Terkait Analisis Komparatif dan Penerjemahan Klinis
4.1 Analisis Perbandingan
Pilihan inti LNP untuk CMC disorot oleh kemampuannya untuk meniru komposisi alami membran sel secara dekat. Peniruan ini tidak hanya meningkatkan kompatibilitas tetapi juga mengurangi respons imun potensial, menjadikan LNP sebagai pilihan yang lebih disukai. Dibandingkan dengan NP lain, LNP menawarkan keuntungan signifikan dalam enkapsulasi obat dan bioavailabilitas sambil meminimalkan efek samping yang tidak diinginkan [ 304 ]. Preferensi untuk LNP daripada PNP berasal dari kemampuannya untuk mengatasi beberapa tantangan yang terkait dengan yang terakhir, seperti sitotoksisitas, penggunaan pelarut organik dalam pembuatan, kapasitas pemuatan obat yang terbatas, dan kesulitan dalam meningkatkan produksi [ 305 , 306 ]. Selain itu, fleksibilitas LNP ditegaskan oleh kemampuannya untuk menggabungkan dan memberikan berbagai macam agen terapeutik, termasuk obat genetik—suatu pendekatan yang relatif belum dieksplorasi dengan PNP [ 2 ]. Sebaliknya, PNP menawarkan kemungkinan organisasi struktural tambahan dengan menggabungkan berbagai kelompok kimia dan memanfaatkan interaksi kovalen dan nonkovalen. Mereka dapat mencapai polidispersitas yang lebih rendah dan memberikan kontrol lebih besar atas stabilitas, pelepasan obat, dan modifikasi permukaan dibandingkan dengan LNP [ 307 , 308 ].
Sebagai perbandingan, PEGylation adalah metode pelapisan yang mapan dengan sejarah yang lebih panjang dan lebih banyak persetujuan FDA AS di berbagai terapi, kosmetik, dan produk makanan [ 309 , 310 ], sedangkan CMC masih dalam tahap awal, dengan banyak fitur potensialnya yang belum sepenuhnya dieksplorasi [ 178 , 311 ]. PEGylation adalah metode yang sederhana dan hemat biaya dengan stabilitas jangka panjang yang mapan, sementara CMC lebih kompleks, relatif mahal, dan tidak memiliki data yang cukup tentang stabilitas dan toksisitas jangka panjang [ 311 , 312 ]. Namun, CMC menawarkan potensi penargetan kanker yang lebih unggul dan menghilangkan kebutuhan reaksi kimia untuk menempelkan peptida penargetan, tidak seperti PEGylation, yang sering kali memerlukan reaksi tersebut untuk penargetan berbasis peptida [ 311 , 313 ].
Meskipun CMC-LNP menawarkan keuntungan yang signifikan, mereka juga datang dengan kelemahan yang nyata. Pengembangan CMC-LNP melibatkan proses multi langkah yang kompleks yang membuatnya lebih mahal dan menantang untuk ditingkatkan dibandingkan dengan formulasi NP lainnya. Meskipun dirancang untuk menghindari pengawasan imun, ketidakkonsistenan dalam pelapisan membran masih dapat memicu respons imun yang tidak diinginkan. Studi oleh Bang et al. dan Pitchaimani et al. [ 192 , 222 ] telah melaporkan akumulasi PCM-NLC dan NKCM-LIP yang tinggi pada organ RES, seperti hati dan limpa, selama studi biodistribusi in vivo. Hal ini menunjukkan bahwa pelapisan membran yang tidak lengkap atau heterogen dapat berkontribusi pada pengenalan dan pembersihan imun.
Selain aktivasi imun, CMC-LNP menimbulkan masalah keamanan tambahan terkait dengan potensi imunogenisitas dan transfer patogen. Sumber material membran sel dapat memicu respons imun pada penerima, terutama jika membran sel alogenik atau xenogenik digunakan. Selain itu, proses isolasi dan pelapisan membran dapat menimbulkan kontaminan atau komponen seluler residual, yang selanjutnya dapat berkontribusi pada reaksi imun yang tidak diinginkan dan toksisitas [ 220 , 246 ]. Untuk mengurangi risiko ini, sangat penting untuk menerapkan langkah-langkah pemurnian membran yang sangat terkontrol, termasuk sterilisasi yang ketat, filtrasi, dan penghilangan protein imunogenik secara enzimatik. Selain itu, merekayasa garis sel donor universal dengan imunogenisitas yang dikurangi dapat memberikan solusi yang layak untuk meningkatkan kompatibilitas imun.
Tantangan utama lain yang membatasi kemanjuran CMC-LNP adalah hilangnya protein atau degradasi fungsional selama ekstraksi membran, fusi, dan penyimpanan. Banyak protein dan ligan membran esensial yang secara inheren sensitif terhadap suhu, gaya geser, dan paparan pelarut, sehingga rentan terhadap denaturasi atau hilangnya bioaktivitas. Penanganan yang tidak tepat, kondisi penyimpanan yang tidak optimal, atau teknik ekstraksi yang keras dapat mengganggu arsitektur membran, sehingga membahayakan integritas dan fungsionalitas CMC-LNP. Untuk mengatasi keterbatasan ini, penelitian di masa mendatang harus difokuskan pada pengoptimalan teknik stabilisasi dan pelapisan membran. Metode ekstraksi dan fusi membran yang terstandarisasi harus diterapkan untuk memastikan denaturasi protein minimal dan pelestarian struktural. Protokol ekstraksi yang terkontrol dengan baik menggunakan deterjen ringan, krioprotektan, dan perawatan enzimatik dapat membantu menjaga stabilitas protein sekaligus mengurangi kontaminasi. Selain itu, penambahan agen penstabil dapat meningkatkan integritas membran dan memperpanjang fungsionalitas protein. Teknologi fusi tingkat lanjut, seperti elektroporasi mikrofluida atau pencampuran terkontrol dengan bantuan pusaran, dapat lebih meningkatkan keseragaman membran dan memastikan pelapisan NP yang konsisten.
Evaluasi pasca-pelapisan yang ketat sangat penting untuk mengonfirmasi keberadaan, orientasi, dan aktivitas biologis protein fungsional pada CMC-LNP. Teknik analisis, termasuk Western blotting, flow cytometry, dan ELISA, harus digunakan untuk mengukur retensi protein membran, sementara analisis pelacakan NP dan DLS dapat memverifikasi stabilitas partikel dan distribusi ukuran. Integrasi teknologi pemantauan waktu nyata, seperti pencitraan berbasis FRET, dapat lebih menyempurnakan validasi pelapisan membran, memastikan reproduktifitas tinggi dan retensi fungsional. Dengan mengatasi tantangan kritis ini melalui strategi stabilisasi membran tingkat lanjut, teknik pelapisan yang dioptimalkan, dan kontrol kualitas yang ketat, CMC-LNP dapat lebih disempurnakan untuk aplikasi klinis, yang pada akhirnya meningkatkan potensi terapeutiknya sekaligus meminimalkan komplikasi terkait imun.
Aspek keamanan lainnya melibatkan inti LNP itu sendiri. Sementara inti LNP, yang terutama terdiri dari lipid alami, umumnya dianggap aman, inert secara farmakologis, dan cocok untuk CMC, ada kekhawatiran ketika LNP mengandung senyawa yang tidak alami. Komponen-komponen ini berpotensi menimbulkan toksisitas dan mempengaruhi sel manusia secara buruk [ 8 ]. Telah diamati bahwa konsentrasi LNP biasa yang melebihi 1 mg/mL umumnya ditoleransi dengan baik oleh sebagian besar sel, tanpa kerusakan DNA yang signifikan atau kehilangan viabilitas sel yang nyata [ 314 ]. Meskipun demikian, beberapa lipid kationik berpotensi membahayakan integritas membran sel endogen pada konsentrasi tinggi [ 315 ]. Mereka juga telah dilaporkan membahayakan protein seluler penting, termasuk protein kinase C [ 8 ]. Hal ini mungkin disebabkan oleh peran lipid kationik dalam menghasilkan sitokin proinflamasi dan spesies oksigen reaktif [ 6 ]. Dalam beberapa penelitian, pemberian LNP pada hewan pengerat menyebabkan cedera paru-paru dan hati karena aktivasi berbagai faktor proinflamasi [ 6 , 316 , 317 ]. Keamanan bahan lipid bergantung pada faktor-faktor seperti konsentrasi, sifat lipid, dan jenis sel spesifik yang terlibat [ 6 , 318 ].
Meskipun strategi CMC memiliki potensi untuk meningkatkan stabilitas LNP, stabilitas koloid yang tidak memadai dapat muncul selama penyimpanan jangka panjang karena interaksi fisik dan kimia dalam cairan biologis [ 319 ], terutama ketika CMC parsial dominan. Liu et al. [ 193 ] melaporkan bahwa hingga 90% CMC-NP menunjukkan lapisan parsial. Lipid tak jenuh dalam LNP rentan terhadap oksidasi, yang dapat mengurangi masa simpannya [ 320 ]. Oleh karena itu, pemilihan komposisi dan konsentrasi lipid yang cermat sangat penting. Pengujian stabilitas rutin dalam berbagai kondisi iklim juga penting [ 304 ]. Selain itu, nasib jangka panjang dan biodegradabilitas CMC-LNP dalam tubuh belum sepenuhnya dipahami, meningkatkan kekhawatiran tentang keamanan keseluruhan sistem ini [ 311 ].
4.2 Tantangan dan Perspektif dalam Penerjemahan Klinis CMC-LNP
Kemajuan translasi terkini menunjukkan peningkatan potensi CMC-NP, termasuk varian berbasis lipid, untuk bergerak melampaui studi praklinis. Tim peneliti Zhang berhasil memajukan CTI-005, formulasi NP berlapis RCM, ke tahap Investigational New Drug (IND). FDA AS telah menyetujui kandidat ini untuk langsung memasuki uji klinis Fase Ib/IIa. Selain itu, formulasi kedua, CE120, yang memanfaatkan NP berlapis PCM, juga telah menyelesaikan diskusi pra-IND dengan FDA AS, yang menggarisbawahi minat dan momentum regulasi di bidang ini [ 321 – 323 ]. Meskipun tonggak sejarah yang menjanjikan ini, translasi klinis CMC-LNP masih menghadapi tantangan besar. Salah satu hambatan utama terletak pada kurangnya teknik manufaktur yang dapat diskalakan dan direproduksi yang menjaga integritas struktural dan fungsional membran sel selama perakitan NP. Kontrol kualitas merupakan perhatian penting lainnya, khususnya berkenaan dengan retensi protein membran, orientasi permukaan, dan konsistensi antar-batch. Keamanan imunologi merupakan masalah kompleks lainnya. Meskipun pelapisan membran dapat memberikan sifat penghindaran dan penargetan imun, pelapisan ini juga menimbulkan kekhawatiran mengenai biokompatibilitas jangka panjang, potensi efek di luar target, dan modulasi imun pada berbagai populasi pasien. Selain itu, sebagian besar kerangka regulasi masih berkembang untuk mengakomodasi fitur unik nanocarrier biomimetik. Mengatasi hambatan ini akan memerlukan upaya terkoordinasi lintas berbagai disiplin ilmu, termasuk rekayasa biomaterial, farmakologi, imunologi, dan ilmu regulasi.
4.2.1 Standardisasi dan Peningkatan Skala
Penerjemahan CMC-LNP ke dalam aplikasi klinis memerlukan standarisasi yang kuat dan metode produksi yang dapat diskalakan. Mempertahankan integritas membran sel dan memastikan penyelarasan protein membran yang benar selama perakitan NP sangat penting untuk mempertahankan kemanjuran terapeutiknya. Pada setiap tahap, validasi dan pengoptimalan yang ketat diperlukan untuk memastikan konsistensi.
Peningkatan produksi CMC-LNP sambil mempertahankan fungsi biologisnya merupakan tantangan besar. Misalnya, penelitian tentang peningkatan skala nanomedicine telah menunjukkan bahwa peningkatan waktu agitasi dan kecepatan impeller dapat mengurangi ukuran partikel tanpa mengurangi efisiensi enkapsulasi obat [ 324 ]. Parameter penilaian standar—seperti potensi zeta, distribusi ukuran partikel, integritas membran, dan komposisi protein permukaan—sangat penting untuk menjamin reproduktifitas dari batch ke batch.
Meskipun biaya produksi tinggi, efisiensi produksi dapat ditingkatkan dengan mengoptimalkan isolasi membran, kondisi penyimpanan, dan protokol pemurnian. Mengingat CMC-LNP ditujukan untuk studi klinis, kepatuhan ketat terhadap praktik produksi yang baik (GMP) diperlukan untuk memastikan keamanan dan konsistensi produk [ 325 ].
Pengadaan membran sel menghadirkan tantangan logistik lainnya. Sementara trombosit, sel darah merah, dan sel imun dapat diperoleh dari bank darah atau pemasok komersial, jenis sel yang memerlukan kultur in vitro (misalnya, sel kanker) memerlukan bioreaktor untuk perluasan skala besar [ 326 ]. Mempertahankan konsistensi antar-batch untuk sel yang dikultur memerlukan fenotipe, genotipe, dan penyimpanan sel induk yang berkelanjutan. Lebih jauh, liofilisasi menawarkan strategi yang layak untuk memperpanjang masa simpan [ 154 ]. Memanfaatkan produk darah kedaluwarsa yang tidak sesuai untuk transfusi tetapi masih layak untuk pembuatan NP dapat membantu mengurangi pemborosan sumber daya.
Untungnya, strategi produksi NP skala industri dapat diadaptasi untuk CMC-LNP [ 327 , 328 ]. Perangkat mikrofluida, misalnya, menyediakan metode yang menjanjikan untuk manufaktur yang dapat diskalakan dan hemat biaya, mempertahankan presisi dalam pelapisan membran dan perakitan partikel [ 160 ]. Namun, transisi dari produksi skala mililiter ke skala liter memerlukan optimalisasi dinamika fluida dan parameter pencampuran yang cermat untuk menjaga homogenitas partikel.
4.2.2 Pertimbangan Keselamatan
Memastikan keamanan dan biokompatibilitas CMC-LNP sangat penting untuk penerapan klinisnya. Karena NP ini menggabungkan membran biologis, maka NP ini membawa risiko inheren terkait imunogenisitas, kontaminasi, efek yang tidak sesuai target, dan biodistribusi jangka panjang. Mengatasi masalah ini memerlukan pendekatan multifaset yang melibatkan produksi aseptik, kontrol kualitas yang ketat, penilaian imunotoksisitas, dan karakterisasi nasib in vivo.
Menjaga kondisi steril selama proses produksi sangat penting untuk mencegah kontaminasi bakteri atau virus. Hal ini melibatkan penerapan protokol yang sesuai dengan GMP dan mengintegrasikan uji analitis resolusi tinggi untuk memantau integritas protein, kadar endotoksin, dan kontaminasi mikroba di setiap tahap produksi. Teknik pemurnian tingkat lanjut juga harus digunakan untuk menghilangkan sisa sel atau vesikel membran yang tidak terikat, memastikan produk CMC-LNP akhir tetap stabil secara fungsional dan aman untuk pemberian [ 329 ].
Imunogenisitas tetap menjadi perhatian utama, terutama ketika CMC-LNP berasal dari sumber sel alogenik. Jika ketidakcocokan imun muncul, hal itu dapat memicu respons imun yang tidak diinginkan, yang berpotensi menyebabkan hipersensitivitas, aktivasi komplemen, atau peradangan [ 330 ]. Salah satu strategi untuk mengurangi risiko ini adalah menggunakan membran autologus, terutama untuk CMC-LNP yang berasal dari sel darah, di mana pencocokan donor-pasien dapat mengurangi kemungkinan penolakan. Untuk membran alogenik atau xenogenik, pendekatan alternatif, seperti merekayasa garis sel donor universal dengan menyingkirkan protein imunogenik (misalnya, molekul MHC) atau mengekspresikan HLA-E polimorfik minimal secara berlebihan, telah dieksplorasi untuk meningkatkan kompatibilitas imun [ 331 , 332 ]. Aspek penting lain dari evaluasi keamanan adalah memahami biodistribusi dan farmakokinetik CMC-LNP secara in vivo. Sementara pelapis membran memberikan sifat biomimetik yang memengaruhi interaksi biologisnya, pelapisan tersebut juga dapat menimbulkan akumulasi di luar target yang tidak diinginkan. Hal ini memerlukan studi biodistribusi yang komprehensif menggunakan teknik seperti pencitraan in vivo, pelabelan fluoresensi, dan tomografi emisi positron untuk melacak nasib NP pasca pemberian. Lebih jauh lagi, model organ-on-a-chip telah muncul sebagai alat yang menjanjikan untuk mempelajari interaksi antara CMC-LNP dan penghalang biologis, memberikan wawasan tentang penyerapan seluler, mekanisme pembersihan, dan sirkulasi sistemik [ 333 ].
Nasib jangka panjang dan profil degradasi CMC-LNP juga harus dinilai dengan cermat. Tidak seperti NP sintetis, CMC-LNP menggabungkan membran biologis, yang dapat menunjukkan kinetika degradasi yang bervariasi dalam lingkungan fisiologis yang berbeda. Studi praklinis harus mencakup histopatologi jaringan, analisis fungsi organ, dan pemantauan respons imun sistemik untuk mendeteksi potensi toksisitas atau masalah terkait akumulasi. Evaluasi ini akan sangat penting dalam menetapkan profil keamanan jangka panjang CMC-LNP dan menentukan kesesuaiannya untuk aplikasi terapeutik kronis.
4.2.3 Aspek Regulasi dan Etika
Keberhasilan penerapan CMC-LNP secara klinis tidak hanya bergantung pada kemajuan ilmiah dan teknis, tetapi juga pada kepatuhan terhadap pedoman regulasi dan standar etika. Kompleksitas NP biomimetik menimbulkan tantangan unik dalam klasifikasi regulasi, yang memerlukan kolaborasi erat antara peneliti, mitra industri, dan lembaga regulasi.
Keterlibatan awal dengan badan-badan regulasi, seperti FDA AS, EMA (Eropa), dan TGA (Australia), sangat penting untuk menetapkan pedoman yang jelas tentang keamanan, kemanjuran, dan kontrol kualitas CMC-LNP. Mengingat sifat hibridanya, CMC-LNP dapat diklasifikasikan sebagai biologik daripada nanomedicine konvensional, yang memerlukan kerangka regulasi baru untuk mengakomodasi sifat-sifatnya yang unik, kompleksitas fungsional, dan variabilitas antar-batch [ 20 ]. Pelajaran dari terapi berbasis vesikel ekstraseluler yang sedang berlangsung dapat memberikan wawasan berharga dalam menavigasi persetujuan regulasi CMC-LNP, khususnya dalam mengatasi tantangan yang terkait dengan karakterisasi, stabilitas, dan skalabilitas [ 334 , 335 ].
Tantangan regulasi utama lainnya melibatkan validasi praklinis. Otoritas regulasi biasanya memerlukan data in vivo yang substansial untuk mengonfirmasi perilaku biomimetik, kemanjuran terapeutik, dan potensi toksisitas. Sementara model in vitro memberikan wawasan awal, model tersebut gagal untuk sepenuhnya menangkap interaksi NP sistemik. Untuk meningkatkan efisiensi penyaringan tahap awal, strategi barcode berthroughput tinggi [ 336 ] dan model organ-on-a-chip tingkat lanjut [ 337 – 339 ] dapat membantu menyempurnakan pemilihan formulasi sebelum melanjutkan ke studi hewan dan uji klinis.
Dari sudut pandang etika, keselamatan pasien tetap menjadi prioritas utama dalam uji klinis CMC-LNP. Protokol persetujuan yang jelas harus ditetapkan untuk memastikan bahwa peserta sepenuhnya memahami potensi risiko dan manfaat terapi berbasis CMC-LNP. Selain itu, program farmakovigilans jangka panjang harus dilaksanakan untuk memantau efek samping yang tertunda dan memastikan keselamatan pasien selama dan setelah fase uji klinis [ 334 ].
Seiring dengan perkembangan bidang ini menuju pengobatan presisi berbasis CMC-LNP, para peneliti juga harus mempertimbangkan implikasi etis dari terapi yang dipersonalisasi. Penyesuaian CMC-LNP untuk masing-masing pasien menimbulkan pertanyaan tentang aksesibilitas, keterjangkauan, dan distribusi yang adil. Kerangka regulasi harus mendukung pendekatan yang terstandarisasi namun fleksibel yang menyeimbangkan inovasi ilmiah dengan kesetaraan pasien, memastikan bahwa terapi canggih ini tetap dapat diakses oleh berbagai populasi.
5 Pandangan
Kemajuan dalam CMC-LNP membuka kemungkinan baru untuk merekayasa nanocarrier multifungsi dengan kemampuan terapeutik dan diagnostik yang ditingkatkan. Beberapa area utama memerlukan eksplorasi lebih lanjut untuk memaksimalkan potensinya dalam aplikasi biomedis.
5.1 Sumber Membran yang Mengembang: Sel Punca dan Membran Bakteri
Pemanfaatan jenis membran yang belum dieksplorasi, seperti SCM dan vesikel membran luar bakteri (OMV), menghadirkan peluang signifikan untuk meningkatkan fungsionalitas CMC-LNP. OMV, yang secara alami diperkaya dengan protein imunomodulatori, menjanjikan pengembangan vaksin, terapi antibakteri, dan imunoterapi kanker. Sementara itu, SCM, yang dikenal karena sifat imunoregulatori dan ekspresi ligannya yang unik, dapat meningkatkan penargetan tumor, pengendalian peradangan, dan aplikasi pengobatan regeneratif [ 334 , 340 ].
5.2 Membran Hibrida dan Rekayasa Genetika
Membran sel hibrida dan rekayasa genetika muncul sebagai alat yang ampuh untuk mengoptimalkan kinerja CMC-LNP. Membran hibrida, yang dibentuk dengan menggabungkan komponen dari berbagai jenis sel, dapat mengintegrasikan sifat-sifat yang saling melengkapi, seperti penghindaran kekebalan yang lebih baik, ketepatan penargetan yang lebih baik, dan pelepasan obat yang terkendali. Sementara itu, membran rekayasa genetika menawarkan kustomisasi yang tepat dengan secara selektif mengekspresikan atau membungkam penanda permukaan, ligan, atau protein, yang memungkinkan aplikasi yang sangat disesuaikan di seluruh terapi kanker, imunomodulasi, dan pemberian obat yang ditargetkan.
5.3 CMC-LNP Theranostic: Platform Fungsi Ganda
CMC-LNP memiliki potensi besar sebagai agen theranostic, yang mengintegrasikan kemampuan terapeutik dan diagnostik dalam satu nanoplatform. Kemampuannya untuk terakumulasi secara selektif di lokasi penyakit memungkinkan pengobatan lokal sekaligus memfasilitasi pemantauan waktu nyata melalui teknik pencitraan canggih seperti pencitraan fluoresensi dan MRI. Fungsi ganda ini merupakan langkah maju yang besar dalam pengobatan presisi, yang meningkatkan akurasi deteksi penyakit dan kemanjuran terapi yang ditargetkan [ 341 ].
5.4 Pengobatan Pribadi dan Nanosistem Khusus Pasien
Transisi menuju pengobatan yang dipersonalisasi semakin cepat, dengan CMC-LNP diposisikan sebagai platform yang dapat disesuaikan untuk perawatan khusus pasien. Penelitian di masa mendatang harus difokuskan pada penyesuaian nanocarrier ini dengan profil imun individu, predisposisi genetik, dan karakteristik khusus penyakit. Kemajuan dalam teknologi diagnostik dan pencitraan akan semakin memungkinkan formulasi CMC-LNP yang disesuaikan, yang mengarah pada intervensi terapeutik yang lebih tepat dan efektif.
5.5 Manufaktur yang Dapat Diskalakan dan Direproduksi
Agar CMC-LNP dapat beralih dari penelitian ke aplikasi klinis, proses produksi yang dapat diskalakan dan terstandarisasi harus dikembangkan. Penelitian di masa mendatang harus memprioritaskan pengoptimalan isolasi membran dan teknik pelapisan, memastikan konsistensi antar-batch dalam sifat fisik dan fungsional. Menetapkan metode produksi yang sesuai dengan GMP akan sangat penting untuk persetujuan regulasi dan komersialisasi skala besar.
5.6 Profil Nasib dan Keamanan In Vivo
Pemahaman yang lebih mendalam tentang perilaku CMC-LNP secara in vivo sangat penting untuk penerapannya secara klinis. Penelitian harus difokuskan pada upaya menjelaskan biodistribusi, interaksi seluler, mekanisme pembersihan, dan keamanan jangka panjang. Wawasan dari penelitian ini akan memberikan informasi mengenai desain nanocarrier yang rasional, yang memungkinkan pengembangan aplikasi biomedis yang lebih aman dan lebih efektif.
Dengan mengatasi tantangan utama dan arah penelitian ini, CMC-LNP dapat berkembang menjadi platform transformatif untuk pengobatan presisi, terapi terarah, dan sistem pengiriman obat canggih. Inovasi berkelanjutan di bidang ini akan membuka jalan bagi aplikasi klinis baru, yang pada akhirnya meningkatkan hasil terapi dan perawatan pasien.
6 Kesimpulan
Menggabungkan fitur-fitur menarik dari LNP dengan CMC merupakan pendekatan yang menjanjikan yang mensinergikan sifat-sifat biomimetik dan memanfaatkan berbagai fungsi biologis, yang sulit untuk direplikasi secara sintetis. Strategi ini memiliki potensi yang signifikan untuk memajukan pemberian obat yang ditargetkan, pencitraan, dan intervensi terapeutik dalam nanomedicine. Berbagai jenis sel yang tersedia untuk pelapisan membran, dikombinasikan dengan berbagai jenis LNP, memperluas penerapan platform ini di berbagai kondisi penyakit. Meskipun kemajuan telah dibuat dalam pengembangan CMC-LNP, masih banyak aspek yang perlu dieksplorasi. Fungsionalitas dan karakteristik membran sel dan inti LNP dapat disesuaikan untuk memenuhi persyaratan tertentu. Sementara setiap jenis membran sel menawarkan keuntungan yang berbeda, ada keterbatasan yang melekat pada masing-masing. Menyelidiki HCM baru akan meningkatkan kemampuan CMC-LNP. Meskipun ada tantangan seperti skalabilitas, standardisasi, dan pemahaman yang komprehensif tentang perilaku seluler in vivo, penelitian interdisipliner yang sedang berlangsung dan uji coba translasi siap untuk memajukan nanocarrier inovatif ini menuju aplikasi klinis. Kemajuan ini membuka jalan bagi era baru dalam pengobatan yang dipersonalisasi dan presisi.
