Abstrak
Karya ini secara sistematis menyelidiki penangkapan CO 2 dengan pelarut eutektik alami bebas halogen hidrofobik (NADES) sebagai penyerap dari perspektif termodinamika dan molekuler. Serangkaian NADES yang terdiri dari asam dekanoat, mentol, timol, dan lidokain sebagai akseptor/donor ikatan hidrogen (HBA/HBD) disiapkan, dan kelarutan CO 2 di dalamnya ditentukan secara eksperimental. Teori Fluida Asosiasi Statistik Rantai-Terganggu pertama kali diperluas untuk secara bersamaan memprediksi sifat termodinamika (yaitu, konstanta Henry, perubahan entalpi, perubahan energi bebas Gibbs, dan perubahan entropi untuk penyerapan CO 2 dalam NADES) serta viskositas dengan menggabungkan dengan teori penskalaan entropi. Wawasan molekuler ke dalam hubungan struktur-sifat antara berbagai struktur HBA/HBD dan kelarutan CO 2 diungkapkan oleh kalkulasi kimia kuantum dan simulasi dinamika molekuler. Karya ini memberikan panduan teoritis untuk pengembangan dan penyaringan NADES baru untuk penangkapan CO yang efisien.
1. PENDAHULUAN
Pemanasan global yang disebabkan oleh gas rumah kaca mempengaruhi seluruh dunia, dengan kondisi cuaca ekstrem seperti kekeringan, gelombang panas, hujan lebat, banjir, dan tanah longsor menjadi lebih sering, naiknya permukaan air laut, pengasaman laut, dan hilangnya keanekaragaman hayati. Target “netralitas karbon” pada pertengahan abad ke-21 harus dicapai untuk mengendalikan kenaikan suhu global dalam 1,5 K (ambang batas aman) yang disarankan oleh Panel Antarpemerintah untuk Perubahan Iklim dan perjanjian Paris. CO 2 adalah gas rumah kaca yang paling penting, dan dengan demikian, perawatan dan pengendaliannya sangat penting dalam meringankan perubahan iklim. Teknologi penangkapan dan penyimpanan karbon (CCS) adalah salah satu metode karbon negatif yang paling efektif. CCS berkontribusi untuk mengurangi emisi CO 2 dengan menangani lokasi emisi CO 2 skala besar seperti pembangkit listrik tenaga termal 1 , 2 untuk lebih jauh mencapai tujuan “netralitas karbon.” Sebagian besar langkah dalam rantai CCS, seperti transportasi, kompresi, dan penyimpanan, telah ditetapkan dan layak secara teknis. Salah satu kendala utama pengembangan CCS skala besar adalah tahap penangkapan karbon, yang mencakup hampir dua pertiga dari total biaya CCS. Untuk penangkapan CO 2 , metode penyerapan paling banyak digunakan karena mudah dioperasikan dan kompatibel dengan fasilitas industri yang ada. Penyerap yang umum digunakan adalah larutan amina organik; meskipun menunjukkan kapasitas penyerapan CO 2 yang tinggi dan selektivitas yang tinggi, permintaan energinya untuk regenerasi pelarut tinggi, dan memiliki efek buruk pada lingkungan karena hilangnya dan degradasi pelarut. Oleh karena itu, sangat penting untuk mengembangkan penyerap/bahan baru dan lebih meningkatkan proses penangkapan CO 2 yang sesuai.
Cairan ionik (IL) telah menunjukkan kinerja yang baik dalam penangkapan dan pemisahan CO2 yang memanfaatkan fitur dan struktur molekulnya yang unik, termasuk stabilitas yang baik, volatilitas yang sangat rendah, desain yang mudah, dan kelarutan/selektivitas CO2 yang tinggi. 3 – 5 Khususnya , nonvolatilitas dan penyesuaian struktural IL membuat proses desorpsi CO2 yang hemat energi menjadi layak jika dibandingkan dengan amina organik konvensional. 6 – 8 Namun, ada juga beberapa masalah yang tak terelakkan yang muncul dalam penangkapan CO2 ; yaitu, proses berbasis fisisorpsi menggunakan IL masih belum dapat bersaing dengan amina yang tersedia secara komersial saat ini karena kapasitas penyerapan CO2 yang lebih rendah . 8 , 9 Meskipun IL yang difungsionalkan akan meningkatkan kapasitas penyerapan CO2 , IL ini juga dapat meningkatkan viskositas, sehingga memperlambat laju penyerapan. 10 , 11 Lebih jauh lagi, ikatan kimia yang kuat antara CO2 dan IL dalam fungsionalisasi IL akan meningkatkan permintaan energi dalam proses regenerasi pelarut. 12
Pelarut eutektik dalam (DES) dianggap sebagai jenis “pelarut hijau” yang sedang berkembang, yang dianggap sebagai kelas campuran dari dua atau lebih komponen yang terdiri dari akseptor ikatan hidrogen (HBA) dan donor ikatan hidrogen (HBD), dan disebut analog IL. 13 – 16 Titik leleh DES ditekan secara signifikan dibandingkan dengan komponen penyusun murni (yaitu, HBD/HBA). Sejak pertama kali dilaporkan oleh Abbott et al., 17 DES telah menerima perhatian yang semakin meningkat selama dekade terakhir karena DES memiliki fitur yang sangat baik dengan IL seperti penyesuaian desain yang layak, dapat didaur ulang, tidak mudah terbakar, stabilitas termodinamika tinggi, dan penguapan yang dapat diabaikan. Selain itu, sintesis DES murah dan mudah. Karakteristik yang disebutkan di atas telah menjadikan DES kandidat yang menjanjikan untuk menggantikan senyawa organik konvensional yang ada yang diterapkan secara luas di seluruh penelitian dan industri. 13 , 14 Jika dibandingkan dengan IL, DES bersifat biokompatibel, tidak beracun, murah, dan lebih mudah disiapkan dalam skala besar hanya dengan mencampur HBA (misalnya, garam amonium kuarterner dan fosfonium kuarterner) dan HBD (misalnya, asam karboksilat, amina, gula, amina, alkohol, dan logam halida), menjadikannya alternatif ekonomis untuk IL. 18 Saat ini, DES telah dipelajari secara ekstensif di banyak bidang teknik kimia dan lingkungan, dan ilmu material seperti pemisahan dan penangkapan gas, 19 metalurgi dan elektrokimia, sistem tenaga dan teknologi baterai, 20 biokatalisis dan kimia organik, pemrosesan biomassa, penelitian farmasi dan medis, dan sintesis nanomaterial. 14 Khususnya, ada upaya penelitian yang sangat besar yang berfokus pada penangkapan CO 2 dengan DES menuju kapasitas penyerapan yang tinggi. Misalnya, penelitian Sarmad et al. menunjukkan bahwa DES memiliki kelarutan CO 2 yang lebih besar daripada beberapa IL. 21 Liu et al. 22 digunakan (ChCl + urea) untuk melakukan studi pemisahan CO 2 /H 2 S dan CO 2 /CH 4 , menunjukkan bahwa kelarutan CO 2 dan selektivitasnya dapat disesuaikan dengan mengubah rasio HBA/HBD, dan kelarutan CO 2 berada pada orde 1:2 > 1:1,5 > 1:2,5 (rasio molar). Li et al. 23 mempelajari kelarutan CO 2 dalam DES berbasis ChCl pada tekanan dan temperatur yang berbeda, mengonfirmasi bahwa tekanan yang lebih tinggi dan temperatur yang lebih rendah bermanfaat untuk meningkatkan kelarutan CO 2 . Penelitian yang dilaporkan oleh Leron dan Li 24 menunjukkan bahwa CO 2kelarutan dalam ChCl–urea (1:2) mencapai 0,3 mol CO2 / mol DES pada kondisi yang diteliti. Adeyemi et al. 25 mempelajari kinerja penangkapan CO2 dalam DES dari ChCl–monoethanolamine (1:6), menunjukkan bahwa kelarutan CO2 adalah 0,48 mol CO2 / mol DES pada 313,5 K dan 101 kPa. Sejauh ini, sebagian besar DES yang digunakan untuk menangkap CO2 berbasis halogen dengan menggunakan DES hidrofilik. Kerugian besar dari hal ini adalah potensi korosi peralatan dalam proses aplikasi masing-masing serta dampak lingkungan dari DES, yang selanjutnya mengurangi potensi aplikasi industrinya. Oleh karena itu, pengembangan DES alami bebas halogen hidrofobik (NADES) sangat penting untuk mencapai penangkapan karbon hijau dengan dampak lingkungan yang berkurang untuk mengatasi korosi peralatan dan permintaan energi ekstra untuk menghilangkan kelembapan dalam regenerasi DES. 26 , 27 Sejauh ini telah ada beberapa penelitian tentang penangkapan CO 2 dengan DES hidrofobik yang dilaporkan. Misalnya, Zubeir et al. 28 mengukur kelarutan CO 2 dalam enam DES hidrofobik berbeda yang terdiri dari asam dekanoat (Dea) dan amonium klorida kuarterner dengan rantai alkil panjang, menemukan bahwa kelarutan CO 2 dalam DES hidrofobik bahkan lebih tinggi daripada yang ada dalam DES hidrofilik ChCl–urea dan [N 444 Cl]–asam laktat, dan mirip dengan yang ada dalam IL terfluorinasi terkenal seperti [BMIM][BF 4 ] dan [BMIM][Tf 2 N]. Selain itu, entalpi dan entropi penyerapan CO 2 sebanding dengan pelarut nonpolar seperti heptana dan benzena, menunjukkan bahwa DES hidrofobik adalah kelas kandidat pelarut fisik yang menjanjikan untuk penangkapan CO 2 karena permintaan energi desorpsi yang rendah. Sejauh pengetahuan kami, NADES bebas halogen hidrofobik belum dipelajari sebagai pelarut potensial untuk penangkapan CO2 .
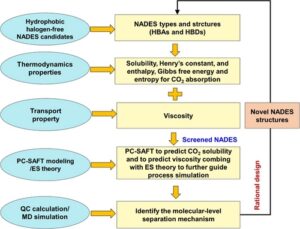
Untuk memeriksa potensi aplikasi NADES untuk menangkap CO 2 , perilaku termodinamik untuk penyerapan CO 2 dalam beberapa NADES representatif 29 yang terdiri dari Dea, mentol (Men), timol (Thy), dan lidokain (Lid) dipelajari secara sistematis dalam pekerjaan ini. Secara khusus, Dea diperlakukan sebagai satu HBD, Men dan Thy dapat diperlakukan sebagai HBD dan HBA, yang bergantung pada komponen lain yang membentuk NADES, dan Lid umumnya dianggap sebagai satu HBA. Keempat zat yang disebutkan di atas bebas halogen dan hidrofobik, dan berasal dari alam, dan dengan demikian, NADES bersifat biokompatibel dan ramah lingkungan. Kami akan fokus pada empat isu untuk penangkapan CO 2 dengan NADES: (i) kelarutan CO 2 dalam NADES diukur secara eksperimental dan mengidentifikasi efek sifat kimia NADES (yaitu, HBA dan HBD), rasio HBD/HBA, suhu operasi, dan tekanan pada kapasitas penangkapan CO 2 ; (ii) melaksanakan pemodelan Perturbed-Chain Statistical Associating Fluid Theory (PC-SAFT) untuk menggambarkan secara kuantitatif kesetimbangan gas–cair (GLE) dari sistem CO 2 + NADES, dan untuk memperkirakan sifat transpor (di sini: viskositas) dengan menggabungkan dengan teori penskalaan entropi (ES); (iii) mengungkap karakteristik termodinamika (yaitu, konstanta Henry, perubahan entalpi, perubahan energi bebas Gibbs dan perubahan entropi untuk penyerapan CO 2 dalam NADES) dari sistem CO 2 + NADES; dan (iv) mengeksplorasi interaksi antarmolekul CO 2 -NADES, distribusi struktural dan perilaku difusi HBA, HBD, dan CO 2 dari sudut pandang mikro-molekul dengan melakukan kalkulasi kimia kuantum (QC) dan simulasi dinamika molekuler (MD) dari sistem CO 2 + NADES. Studi ini bertujuan untuk memberikan panduan teoritis untuk NADES yang diterapkan untuk penangkapan CO 2 dari perspektif termodinamika molekuler. Kerangka penelitian untuk karya ini diilustrasikan dalam Skema 1 .
2 BAGIAN EKSPERIMENTAL
2.1 Bahan Kimia
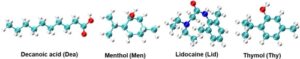
Dea, Men, Lid, dan Thy digunakan untuk sintesis NADES. Informasi terperinci tentang pemasok dan kemurnian ditunjukkan pada Tabel S1 , dan struktur molekul ditunjukkan pada Gambar 1. CO 2 (mol.% ≥ 99,9%) dibeli dari Linde (sebelumnya AGA).
2.2 Persiapan NADES
Awalnya, HBD/HBA yang digunakan dalam penelitian ini dicampur dalam rasio molar tertentu (yaitu, 1:1, 2:1, 3:1) dalam gelas kimia. Campuran tersebut kemudian dipanaskan dan diaduk selama 30 menit dalam penangas minyak pada suhu 333,15 K untuk memperoleh cairan yang homogen dan transparan. Selanjutnya, campuran yang disebutkan di atas didinginkan perlahan hingga suhu ruangan, dan tidak adanya kristalisasi mengonfirmasi keberhasilan penyiapan NADES. NADES yang diperoleh kemudian mengalami dehidrasi dalam oven pengering vakum pada suhu 333,15 K selama 8 jam. Rincian semua spesies NADES yang disintesis dirangkum dalam Tabel S2 .
2.3 Sifat fisikokimia NADES
Viskositas dan densitas NADES diukur dengan alat analisis otomatis Anton Paar DMA 4500 M. Stabilitas termal NADES diukur pada TGA209 Libra (NETZSCH, Jerman) di bawah atmosfer nitrogen, dengan laju pemanasan 10 K/menit pada kisaran suhu 300–700 K.
2.4 Pengukuran Eksperimental Kelarutan CO2 di NADES
Kelarutan CO 2 dalam NADES ditentukan secara eksperimental, dan rincian pengaturan eksperimental dan metodologi pengukuran dapat ditemukan dalam penelitian kami sebelumnya. 30 Selama proses tersebut, NADES diasumsikan tidak hadir dalam fase gas karena tekanan uapnya dapat diabaikan. Setiap titik data diukur tiga kali, dan hasil akhir dirata-ratakan dengan ketidakpastian pengukuran keseluruhan ±1,5%.
3 MODEL TERMODINAMIKA DAN PERHITUNGAN TEORITIS
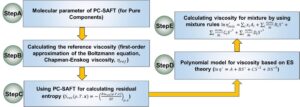
3.1 Pemodelan PC-SAFT
3.1.1 Teori Fluida Asosiasi Statistik Rantai Terganggu
PC-SAFT, yang pertama kali dikembangkan oleh Gross dan Sadowski, telah menjadi salah satu model persamaan keadaan paling maju yang tersedia, dengan kemampuan kuat untuk secara akurat memprediksi zat murni dan sistem campuran. Dalam studi ini, kami menggunakan PC-SAFT untuk memprediksi kelarutan CO 2 dalam berbagai NADES. Dalam teori PC-SAFT, sebuah molekul diperlakukan sebagai rantai keras yang tersusun dari segmen-seg bulat. Untuk molekul i tertentu , molekul tersebut berisi dua parameter khusus, yaitu, jumlah segmen bulat ( m i seg ) dan diameter segmen bulat ( σ i ). Dengan demikian, interaksi antara molekul dipandang sebagai interaksi antara segmen bulat, yang dapat diukur dengan energi Helmholtz residual ( a res ). Dalam pemodelan PC-SAFT, res dari suatu sistem merupakan gabungan dari tiga kontribusi, yaitu kontribusi referensi rantai keras ( a hc ), interaksi dispersi ( a disp ), interaksi asosiasi ( a assoc ), dan interaksi kuadrupolar ( a qq ) (misalnya, CO 2 dianggap sebagai molekul kuadrupolar) seperti yang ditunjukkan pada Persamaan ( 1 ) 31 :

Interaksi asosiasi silang antara komponen asosiasi i dan j dijelaskan menggunakan aturan penggabungan yang diusulkan oleh Wolbach dan Sandler. 33

Pengenalan dan persamaan terperinci untuk PC-SAFT dapat ditemukan di makalah asli. 34
3.1.2 Pendekatan pemodelan
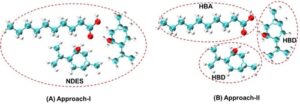
Dalam studi ini, kami menggunakan dua pendekatan untuk memproses pelarut NADES untuk pemodelan PC-SAFT. Pendekatan I adalah memperlakukan setiap NADES sebagai komponen pseudo-murni, dan Pendekatan II adalah memperlakukan NADES sebagai campuran biner yang terdiri dari dua komponen terpisah, HBA dan HBD (Gambar 2 ). Perlu dicatat bahwa Pendekatan I memiliki proses pemodelan yang lebih nyaman, sementara Pendekatan II dapat secara fleksibel menanggapi efek rasio molar HBA/HBD, dan dengan demikian lebih dapat digeneralisasikan. Kedua metode yang disebutkan di atas dibandingkan untuk lebih memvalidasi kemampuan prediksi PC-SAFT untuk GLE sistem CO 2 -NADES. Dalam studi ini, baik NADES (Pendekatan I) dan HBA/HBD (Pendekatan II) dianggap sebagai komponen asosiasi dan dijelaskan dengan skema asosiasi 2B seperti yang diusulkan oleh Huang dan Radosz. 35 Molekul CO 2 dijelaskan sebagai molekul kuadrupolar dengan kemampuan asosiasi terinduksi tambahan untuk prediksi yang lebih akurat. Dalam pemodelan Pendekatan I, lima parameter komponen murni untuk NADES Dea:Lid (1:1), Men:Lid (2:1), Men:Dea (2:1), Men:Dea (3:1), dan Thy:Men (2:1) diperoleh dengan mencocokkan data densitas eksperimen (lihat Tabel S3 ) yang dikombinasikan dengan data tekanan uap, 36 sementara dua metode untuk yang satu tanpa k ij dinamakan PC-SAFT (I) dan yang lainnya dengan k ij dinamakan PC-SAFT (I + k ij ) ( k ij dikorelasikan melalui data kelarutan eksperimen) digunakan. Dalam pemodelan Pendekatan II, parameter komponen murni Men, Lid, Thy, dan Dea diambil dari literatur, 36 – 38 sementara k ij dikorelasikan melalui data kelarutan eksperimen (di mana untuk Thy diasumsikan nol sebelumnya) dinamakan PC-SAFT (II). Keseluruhan parameter komponen murni dan k ij yang digunakan dalam penelitian ini ditunjukkan pada Tabel 1 dan 2 .
| Komponen | saya seg | saya (Å ) | kamu aku / k B | N saya berasosiasi | εAiBj/kB | kAiBj/kB | Q (Hari) | Referensi |
|---|---|---|---|---|---|---|---|---|
| Pria | 3.038 | 4.244 | 217.550 | 2B | 3530.680 | 0,057 tahun | Ref.36 | |
| Dea | 7.388 | 3.284 | 244.170 | 2B | 5479.900 | 3.85E-06 | Ref.37 | |
| Tutup | 5.294 | 2.585 | 323.000 | 4C | 0,020 | 1830.73 | Ref.36 | |
| Engkau | 4.012 | 3.816 | 290.220 | 2B | 1660.000 | 0,0616 tahun | Ref.38 | |
| Tutup:Dea (1:1) | 5.633 | 3.736 | 238.825 | 2B | 3699.529 | 0,014832 | Karya ini | |
| Tutup:Dea (2:1) | 6.802 | 3.473 | 249.440 | 2B | 2423.000 | 0,01275 | Ref.39 | |
| Dea:Tutup a (3:1) | 6.037 | 3.591 | 247.800 | 2B | 2818.000 | 0,00703 | Ref.39 | |
| Kelopak matamu (2:1) | 6.214 | 3.419 | 222.820 | 2B | 2409.000 | 0,0955 pukul 0,0955 | Ref.39 | |
| Pria:Dea (1:1) | 4.897 | 3.721 | 229.720 | 2B | 2682.000 | 0,0956 pukul | Ref.39 | |
| Pria:Dea (2:1) | 5.760 | 3.521 | 244.368 | 2B | 1993.710 | 0,022245 | Karya ini | |
| Pria:Dea (3:1) | 5.648 | 3.535 | 243.643 | 2B | 2064.860 | 0,023823 | Karya ini | |
| Orang-orangmu (2:1) | 5.528 | 3.444 | 258.721 | 2B | 2162.416 | 0,003 | Karya ini | |
| Pria:Tutup (2:1) | 6.055 | 3.555 | 249.134 | 2B | 1680.306 | 0,006671 tahun | Karya ini | |
| CO2 | 1.513 | 3.187 | 163.330 | 2B | — | 0.1 | 4.4 | Ref.31 |
Singkatan: Dea, asam dekanoat; Lid, lidokain; Men, mentol; PC-SAFT, Teori Fluida Asosiasi Statistik Rantai Terganggu; Thy, timol. Catatan , pada publikasi asli, Ref. 39 terdapat kesalahan ketik pada parameter m i seg
| Saya | J | k aku j | Referensi |
|---|---|---|---|
| Tutup:Dea (1:1) | CO2 | — | Karya ini |
| Tutup:Dea (2:1) | CO2 | -0,024 | Karya ini |
| Tutup:Dea (3:1) | CO2 | — | Karya ini |
| Pria:Dea (1:1) | CO2 | 0,02 | Karya ini |
| Pria:Dea (2:1) | CO2 | — | Karya ini |
| Pria:Dea (3:1) | CO2 | 0,015 | Karya ini |
| Orang-orangmu (2:1) | CO2 | -0,01 | Karya ini |
| Kelopak matamu (2:1) | CO2 | 0,015 | Karya ini |
| Pria:Tutup (2:1) | CO2 | 0,015 | Karya ini |
| Pria | CO2 | 0.1 | Karya ini |
| Engkau | CO2 | — | Karya ini |
| Dea | CO2 | -0,06 | Karya ini |
| Tutup | CO2 | -0,2 | Karya ini |
Singkatan: Dea, asam dekanoat; Lid, lidokain; Men, mentol; PC-SAFT, Teori Fluida Asosiasi Statistik Rantai Terganggu; Thy, timol.
3.1.3 Memprediksi kelarutan CO 2 dengan PC-SAFT
Metode phi–phi ( φ–φ ) diterapkan untuk menggambarkan GLE sistem gas + pelarut seperti yang ditunjukkan pada persamaan berikut:

3.1.4 Teori PC-SAFT dan ES untuk memprediksi viskositas


3.2 Perhitungan QC
Perhitungan QC dilakukan menggunakan perangkat lunak Gaussian 09 (versi D.01), 42 untuk menyelidiki interaksi antarmolekul dalam campuran C
![]()
di mana E A–B , E A , dan E B merujuk pada energi elektronik (dalam kJ/mol) untuk kompleks A–B, individu A, dan individu B, masing-masing. Alat Multiwfn (versi 3.8) yang dirancang oleh Lu dan Chen 43 digunakan untuk menganalisis interaksi lemah, termasuk potensial elektrostatik (ESP) pada permukaan van der Waals molekuler (vdW) dan model gradien independen (IGM). 44 Hasil simulasi MD divisualisasikan oleh perangkat lunak VMD. 45 Informasi terperinci tentang perhitungan QC ditunjukkan pada Bagian II dalam Informasi Pendukung.
3.3 Simulasi MD
Perangkat lunak GROMACS (versi 2018.4) 46 digunakan untuk simulasi MD guna mempelajari interaksi antarmolekul dan distribusi mikro untuk sistem campuran. Dalam pekerjaan ini, berbagai sistem campuran yang terlibat dengan NADES dan CO 2 diselidiki. Konfigurasi awal untuk simulasi MD ditetapkan melalui perangkat lunak PACKMOL. 47 Molekul CO 2 dimodelkan menggunakan parameter medan gaya EMP2. 48 Perangkat lunak AmberTools18 menghasilkan medan gaya GAFF dan digunakan untuk molekul Men dan Dea. 49 Profil kerapatan nomor atom (AND), fungsi distribusi radial (RDF), dan koefisien difusi-sendiri dianalisis. Proses simulasi terperinci ditunjukkan di Bagian III dalam Informasi Pendukung, dan struktur molekul dan sistem terperinci yang disimulasikan diilustrasikan dalam Gambar S1 dan Tabel S5 .
4 HASIL DAN PEMBAHASAN
4.1 Kelarutan CO 2 secara eksperimental dalam NADES dan prediksi dengan PC-SAFT
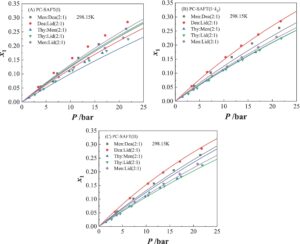
Kelarutan CO2 dalam lima NADES (dengan kesamaan struktural) ditentukan secara eksperimental pada 298,15 K, dan hasilnya ditunjukkan pada Gambar 3. Dapat dilihat bahwa efek konstituen kimia dalam lima NADES ini terhadap besarnya kelarutan CO2 relatif kecil , dengan nilai kelarutan hingga 0,3 (fraksi molar) dalam rentang tekanan hingga 22 bar. Lebih jauh, dapat dilihat bahwa perbedaan kelarutan CO2 antara Men:Lid (2:1), Thy:Lid (2:1), dan Thy:Men (2:1) sangat kecil, dikaitkan dengan kesamaan interaksi molekuler dalam tiga campuran NADES + CO2 ini . Khususnya, kelarutan CO 2 dalam Men:Dea (2:1) dan Dea:Lid (2:1) lebih tinggi daripada kelarutan dalam tiga NADES yang disebutkan di atas, dengan Dea:Lid (2:1) memiliki kelarutan CO 2 tertinggi di antara kelima DES ini. Selain itu, kami menggunakan PC-SAFT (I), PC-SAFT (I + k ij ), dan PC-SAFT (II) untuk memperkirakan atau mengorelasikan kelarutan CO 2 dalam kelima NADES ini. Untuk PC-SAFT (I) (Gambar 3A ), prediksi kuantitatif yang pasti dicapai hanya dengan menggunakan parameter komponen murni CO 2 dan NADES, dengan total deviasi relatif rata-rata (ARD) sebesar 14,88% antara PC-SAFT dan data eksperimen. Meskipun orde besaran berkenaan dengan kelarutan CO 2 yang diprediksi dalam DES sedikit berbeda dari hasil eksperimen, sangat menarik bahwa akurasi tersebut dapat dicapai untuk k ij = 0, yang cukup untuk menunjukkan kemampuan prediktif PC-SAFT. Untuk PC-SAFT (I + k ij ) (Gambar 3B ), prediksi kuantitatif yang sangat kuat dicapai, dengan ARD serendah 4,08% dengan mengkorelasikan dengan k ij . Ini sepenuhnya menunjukkan bahwa interaksi tarik-menarik dispersi antara molekul CO 2 dan NADES memiliki efek signifikan pada kelarutan CO 2 , tetapi bagaimanapun, parameter k ij yang diperoleh sangat mendekati nol. PC-SAFT (II) (Gambar 3C ) menunjukkan kemampuan prediksi kuantitatif yang lebih baik daripada PC-SAFT (I) dengan ARD 4,85%, yang hampir pada tingkat akurasi PC-SAFT (I + k ij ). Selain itu, PC-SAFT (II) memungkinkan pemeriksaan fleksibel terhadap efek rasio HBD/HBA pada kelarutan CO 2 dan dengan demikian memiliki generalisasi yang kuat. Singkatnya, PC-SAFT memiliki kemampuan prediksi kuantitatif yang kuat untuk CO 2kelarutan dalam spesies NADES yang secara struktural serupa. Ketiga metode berbeda yang disebutkan di atas dapat dipilih secara fleksibel sesuai dengan kebutuhan spesifik, dan PC-SAFT (II) mungkin merupakan pendekatan yang paling menjanjikan dengan mempertimbangkan akurasi dan fleksibilitas.
Selanjutnya, dua NADES teratas Men:Dea dan Dea:Lid dalam hal kelarutan CO 2 dipilih untuk mengeksplorasi efek suhu dan rasio HBD/HBA pada kelarutan CO 2 . Efek suhu pada kelarutan ditunjukkan pada Gambar 4 . Dapat dilihat bahwa kelarutan CO 2 di Men:Dea dan Dea:Lid menurun dengan meningkatnya suhu, yang konsisten dengan pola umum kelarutan gas konvensional dalam pelarut. PC-SAFT juga digunakan untuk menggambarkan efek suhu pada kelarutan CO 2 , yang menunjukkan bahwa tiga metode PC-SAFT dapat secara kuantitatif memprediksi kelarutan CO 2 pada suhu yang berbeda. Untuk sistem CO 2 + Men:Dea (2:1) dan CO 2 + Dea:Lid (2:1), PC-SAFT (II) (ARD = 5,64%) memiliki akurasi prediksi yang sangat mendekati PC-SAFT (I + k ij ) (ARD = 7,72%), dan secara signifikan lebih tinggi daripada PC-SAFT (I) (ARD = 14,26%). Perlu dicatat bahwa PC-SAFT (I + k ij ) menggunakan k ij yang tidak bergantung pada suhu .
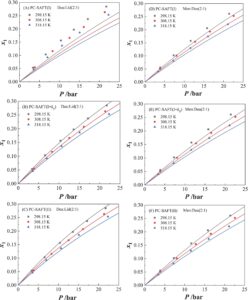
Efek rasio HBD/HBA pada kelarutan CO 2 ditunjukkan pada Gambar 5. Secara keseluruhan, dapat dilihat bahwa kelarutan CO 2 di kedua NADES menurun dengan meningkatnya rasio HBD/HBA, yang mungkin menarik karena ini juga memengaruhi viskositas sistem (dibahas kemudian). Perlu dicatat bahwa PC-SAFT dengan tepat menggambarkan pengaruh rasio HBD/HBA pada kelarutan CO 2 . Hasil menunjukkan bahwa akurasi prediksi PC-SAFT (I + k ij ) (ARD = 4,91%) sedikit lebih tinggi daripada PC-SAFT (II) (ARD = 6,20%), dan PC-SAFT (I) (ARD = 7,2%). Bagaimanapun, temuan yang disebutkan di atas mengonfirmasi bahwa PC-SAFT menunjukkan prediksi kuantitatif yang kuat dari kelarutan CO 2 dalam NADES. Pemodelan PC-SAFT (Pendekatan I dan Pendekatan II) untuk sistem NADES, termasuk tiga metode PC-SAFT (I), PC-SAFT (I + k ij ), dan PC-SAFT (II), digunakan untuk memprediksi sistem CO 2 + NADES, di mana PC-SAFT (I + k ij ) menunjukkan akurasi prediksi yang sangat dekat dengan PC-SAFT (II). PC-SAFT (II) mungkin merupakan metode universal yang lebih disukai dibandingkan dengan PC-SAFT (I + k ij ) karena yang pertama dapat mencerminkan perubahan dalam rasio molar HBA:HBD dalam sistem DES berdasarkan pada serangkaian parameter komponen murni yang identik, dan lebih dapat diperluas daripada PC-SAFT (I + k ij ). Data kelarutan CO 2 terperinci untuk eksperimen dan prediksi dari PC-SAFT ditunjukkan pada Tabel S6 .
4.2 Analisis termodinamika
4.2.1 Konstanta Henry
Untuk lebih memahami perilaku termodinamika sistem CO 2 -NADES, konstanta Henry untuk CO 2 dalam NADES (sebagai sifat termodinamika yang tidak bergantung pada tekanan yang dapat secara langsung mengukur kapasitas penangkapan CO 2 ) dihitung. Formalisme perhitungan konstanta Henry adalah sebagai berikut:
![]()
di mana f 1 dan P 1 masing-masing mewakili fugasitas dan tekanan kesetimbangan kelarutan CO 2 dalam sistem biner CO 2 (1) + NADES (2) pada suhu yang diberikan, x 1 mengacu pada kelarutan CO 2 . Dalam penelitian ini, diasumsikan bahwa f 1 = P 1 karena tekanan kesetimbangan CO 2 yang relatif rendah . Konstanta Henry dapat diperoleh dengan melakukan pencocokan linier data kelarutan CO 2 melalui Persamaan ( 13 ) (Gambar S2 untuk keterangan lebih rinci).
Efek spesies NADES, suhu, dan rasio HBD/HBA pada konstanta Henry dipelajari, seperti yang ditunjukkan pada Tabel 3. Dapat dilihat bahwa konstanta Henry menunjukkan tren yang berlawanan dengan kelarutan, yaitu, semakin besar konstanta Henry, semakin rendah kelarutan CO2 pada suhu tertentu. Untuk dua NADES teratas Men:Dea dan Dea:Lid, suhu yang lebih tinggi sesuai dengan konstanta Henry yang lebih besar, dan dengan demikian, suhu yang tinggi tidak menguntungkan bagi penangkapan CO2 dari sudut pandang termodinamika. Untuk NADES Men:Dea dan Dea:Lid, rasio Men:Dea dan Dea:Lid yang lebih tinggi sesuai dengan konstanta Henry yang lebih besar . Sementara itu, PC-SAFT (Pendekatan I dan Pendekatan II) juga digunakan untuk memprediksi konstanta Henry. Hasil penelitian menunjukkan bahwa PC-SAFT dapat mengkarakterisasi dengan baik pengaruh temperatur dan rasio HBD/HBA terhadap konstanta Henry, dan ARD (5,30%) dari PC-SAFT (I + k ij ) sangat mendekati ARD (6,81%) dari PC-SAFT (II).
| NAPZA | T /K | Percobaan | PC-SAFT (saya) | RD, % | PC-SAFT (I + k ij ) | RD, % | PC SAFT (II) | RD, % | |
|---|---|---|---|---|---|---|---|---|---|
| H 1,2 (batang) | Pria:Dea (2:1) | 298.15 | 73.73 | pukul 76.30 | 3.49 | pukul 76.30 | 3.49 | 72.90 | 1.13 |
| 308.15 | 82.9 | 84.49 | 1.92 | 84.49 | 1.92 | 81.00 | 2.29 | ||
| 318.15 | 89.27 | 92.77 | 3.92 | 92.77 | 3.92 | 89.67 | 0,45 | ||
| Tutup:Dea (2:1) | 298.15 | 68.47 | 81.32 | 18.77 | 64.26 | 6.15 | 60.74 | Tanggal 11.29 | |
| 308.15 | 79.29 | 89.55 | 12.94 | 70.34 | Tanggal 11.29 | 69.74 | tanggal 12.04 | ||
| 318.15 | 80.46 | 97.86 | 21.63 | 77.67 | 3.47 | 77.59 | 3.57 | ||
| Orang-orangmu (2:1) | 298.15 | 90.04 | 96.57 | 7.25 | 86.72 | 3.69 | 77.25 | tanggal 14.20 | |
| Kelopak matamu (2:1) | 298.15 | 92.28 | 73.77 | tanggal 20.06 | 85.49 | 7.36 | 89.44 | 3.08 | |
| Pria:Tutup (2:1) | 298.15 | 87.26 | 71.25 | 18.35 | 82.72 | 5.20 | 84.68 | 2.96 | |
| Pria:Dea (1:1) | 298.15 | 71.6 | 59.67 | 16.66 | 70.03 | 2.19 | 77.95 | 8.87 | |
| Pria:Dea (3:1) | 298.15 | 80.52 | 75.31 | 6.47 | 87.43 | 8.58 | 76.09 | 5.50 | |
| Tutup:Dea (1:1) | 298.15 | 63.96 | 57.94 | 9.41 | 57.94 | 9.41 | 66.73 | 4.33 | |
| Tutup:Dea (3:1) | 298.15 | 72.25 | 70.67 | 2.19 | 70.67 | 2.19 | 58.64 | 18.84 | |
| ARD, % | Jam 11.00 | Jam 5.30 | 6.81 |
Singkatan: ARD, deviasi relatif rata-rata; Dea, asam dekanoat; Lid, lidokain; Men, mentol; NADES, pelarut eutektik dalam alami; PC-SAFT, Teori Fluida Asosiasi Statistik Rantai Terganggu; Thy, timol; RD, deviasi relatif.
4.2.2 Entalpi penyerapan CO 2 , entropi dan energi bebas
Perubahan entalpi (Δ H ), perubahan energi bebas Gibbs (Δ G ), dan perubahan entropi (Δ S ) pelarutan CO 2 dalam NADES dapat dihitung dengan persamaan berikut.
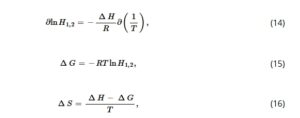
di mana T dan R masing-masing merujuk pada suhu dan konstanta gas ideal. Δ H dapat dihitung melalui penyesuaian linier antara ln H 1,2 dan 1/ T . Dapat dilihat bahwa Δ H eksperimental untuk Men:Dea (2:1) (−7,56 kJ/mol) sedikit lebih negatif daripada Dea:Lid (2:1) (−6,42 kJ/mol), yang menunjukkan bahwa yang pertama memiliki interaksi yang lebih kuat dengan CO 2 daripada yang terakhir, menghasilkan kelarutan CO 2 yang lebih tinggi . Nilai Δ H dari Men:Dea (2:1) dan Dea:Lid (2:1) sedikit lebih rendah daripada energi interaksi HB yang berkisar dari −10 hingga −20 kJ/mol, 50 yang mengonfirmasi penyerapan fisik CO 2 dalam NADES (nilai yang jauh lebih negatif diharapkan untuk kemisorpsi). Δ G negatif (−39,20 dan −39,02 kJ/mol, berturut-turut) dan Δ S positif (106,12 J/(mol·K) dan 109,33 J/(mol·K), berturut-turut) untuk Men:Dea (2:1) dan Dea:Lid (2:1) pada 298,15 K semakin menegaskan bahwa penyerapan CO 2 dalam NADES adalah proses eksotermik yang spontan dan teratur. Khususnya, PC-SAFT juga dapat memprediksi sifat termodinamika ini dengan baik. Informasi terperinci ditunjukkan pada Tabel S7 .
4.3 Analisis sifat transportasi (viskositas)
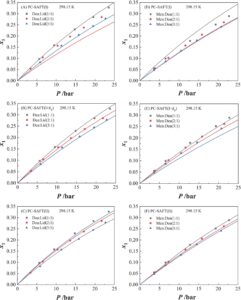
Selain sifat termodinamika seperti kelarutan dan konstanta Henry untuk CO 2 , viskositas sebagai salah satu parameter kinetik yang sangat penting harus dipertimbangkan untuk penangkapan CO 2 . Oleh karena itu, viskositas dari berbagai NADES pada suhu yang berbeda ditentukan secara eksperimental seperti yang ditunjukkan pada Gambar 6A . Dapat dilihat bahwa viskositas mereka menunjukkan perbedaan yang signifikan. Perbedaan dalam sifat viskositas ini disebabkan oleh interaksi intermolekul HB dalam NADES murni serta efek sterik. Viskositas diurutkan Dea:Lid (2:1) > Thy:Lid (2:1) > Men:Lid (2:1) > Thy:Men (2:1) > Men:Dea (2:1). Perlu dicatat bahwa viskositas Dea:Lid (2:1) sekitar orde besaran lebih tinggi daripada Men:Dea (2:1). Khususnya, viskositas Dea:Lid (2:1) dan Men:Dea (2:1) masing-masing adalah 258,68 dan 27,69 mPa·s, pada 293,15 K. Pada saat yang sama, efek rasio HBD/HBA pada viskositas kedua NADES ini diselidiki. Hasilnya diilustrasikan dalam Gambar 6B,C . Dapat dilihat bahwa viskositas Men:Dea (2:1) dan Dea:Lid (2:1) dapat meningkat dengan meningkatnya rasio Men:Dea (atau Dea:Lid), tetapi efeknya lebih besar untuk yang pertama. Karena viskositas rendah lebih disukai, penggunaan NADES Dea:Lid tidak direkomendasikan, terutama juga dengan mempertimbangkan biaya yang terkait dengan Lid.
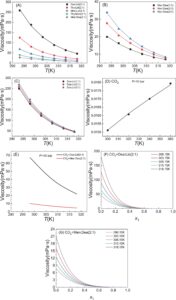
Selain itu, kami menggunakan PC-SAFT untuk mengorelasikan viskositas NADES murni dan CO 2 murni pada suhu yang berbeda (Gambar 6A–D ). Hasilnya menunjukkan bahwa PC-SAFT dan teori ES menghasilkan hasil pemodelan kuantitatif untuk NADES murni dan CO 2 murni serta pengaruh suhu pada viskositas. Berdasarkan keandalan PC-SAFT, dapat diperluas lebih lanjut untuk memprediksi viskositas sistem biner CO 2 -NADES (Gambar 6E–G ) sebagai respons terhadap perubahan viskositas setelah menyerap CO 2 . Ini kemudian berguna untuk memandu penyetelan parameter kinetik dalam desain menara penyerapan untuk aplikasi industri. Dapat diamati bahwa viskositas sistem biner berkurang secara signifikan setelah penambahan CO 2 , yang mencerminkan fakta bahwa molekul CO 2 bertindak sebagai agen pengencer. Urutan ukuran viskositas sistem biner pada dasarnya konsisten dengan sistem NADES murni. Oleh karena itu, dengan mempertimbangkan sifat termodinamika penyerapan CO 2 dan viskositas kinetik, NADES Men:Dea dipilih sebagai kandidat terbaik. Lebih jauh lagi, Men:Dea juga memiliki stabilitas termal yang lebih tinggi daripada Dea:Lid (lihat Gambar S3 ), yang meningkatkan potensinya untuk aplikasi industri. Tidak ada data campuran untuk viskositas NADES ini dengan CO 2 , yang sangat dibutuhkan di masa mendatang. Data viskositas terperinci untuk eksperimen dan prediksi dari PC-SAFT ditunjukkan pada Tabel S8 .
4.4 Mengungkap mekanisme penyerapan CO2
4.4.1 Analisis energi pengikatan
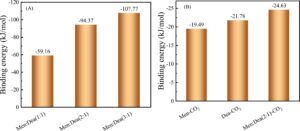
Energi pengikatan berbagai gugus molekul dianalisis dengan perhitungan QC untuk mengidentifikasi secara kuantitatif kekuatan interaksi antarmolekul (konfigurasi geometri, lihat Gambar S4 ). Gambar 7A mengungkapkan bahwa ketika rasio Men:Dea meningkat dari 1:1 menjadi 3:1, kekuatan energi pengikatan antara Men dan Dea meningkat secara signifikan dari -59,16 menjadi -107,77 kJ/mol. Ini menunjukkan bahwa peningkatan fraksi Men dalam MenDea mengarah pada struktur NADES yang lebih stabil. Gambar 7B menunjukkan energi pengikatan antara Dea, Men, dan NADES (Men: Dea [2:1] sebagai contoh) dengan CO 2 . Khususnya, energi pengikatan Dea-CO 2 (−21,78 kJ/mol) sangat mirip dengan Men-CO 2 (−19,49 kJ/mol), yang menunjukkan bahwa Dea dan Men memiliki kemampuan penyerapan CO 2 yang cukup besar , dengan Dea menunjukkan afinitas yang sedikit lebih kuat terhadap CO 2 daripada Men. Hebatnya, energi pengikatan Men:Dea (2:1)-CO 2 (−24,63 kJ/mol) secara signifikan lebih kuat daripada pasangan HBA-CO 2 dan HBD-CO 2 , yang menunjukkan efek sinergis HBA dan HBD pada kelarutan CO 2 .
4.4.2 Analisis visualisasi interaksi lemah
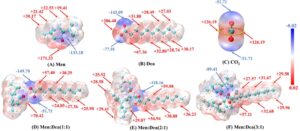
Karakteristik, kekuatan, dan lokasi interaksi antara berbagai gugus molekul dapat diidentifikasi secara visual dengan menganalisis ESP dan IGM. Seperti yang ditunjukkan pada Gambar 8A , untuk molekul Men, baik nilai ESP global maksimum (+171,33 kJ/mol) dan minimum global (−133,18 kJ/mol) terlokalisasi di sekitar hidroksil, membuatnya sangat rentan terhadap interaksi dengan situs dengan nilai ESP minimum/maksimum untuk molekul lain. Untuk Dea (Gambar 8B ), ESP maksimum terkonsentrasi pada hidrogen dari gugus karboksil (+206,48 kJ/mol) untuk dengan mudah membentuk HB dengan ESP minimum (O dalam hidroksil) Men, sedangkan minimum berada pada O dari ikatan CO (−143,09 kJ/mol). Lebih jauh lagi, Dea menunjukkan nilai maksimum ESP yang lebih positif dan nilai minimum yang lebih negatif daripada Men, yang menyebabkan yang pertama memiliki interaksi tarik yang lebih kuat dengan CO 2 (Gambar 8C ) yang menghasilkan kelarutan CO 2 yang lebih tinggi . Gambar 8D–F menunjukkan bahwa dengan peningkatan rasio Dea:Men dari 1:1 ke 3:1, nilai absolut minimum dan maksimum ESP secara bertahap menurun (dari −149,70 ke −89,41 kJ/mol untuk nilai minimum, dari +70,42 ke +57,11 kJ/mol untuk nilai minimum), yang menunjukkan peningkatan interaksi HBD-HBA dalam NADES dan penurunan interaksi tarik dengan CO 2 . Temuan ini sejalan dengan hasil kelarutan CO 2 .
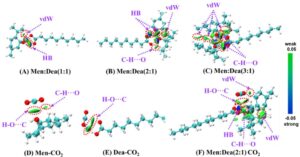
Analisis IGM diperlihatkan dalam Gambar 9. Dapat dilihat dari Gambar 9A bahwa keberadaan isosurface biru-hijau besar dan isosurface hijau yang lebih kecil antara Dea dan Men masing-masing mewakili interaksi HB dan dispersi vdW. Interaksi HB adalah alasan utama pembentukan NADES. Peningkatan kuantitas Men menyebabkan pertumbuhan yang nyata dalam distribusi isosurface biru-hijau, membentuk berbagai interaksi (HB, C H⋯O, vdW) dan menghasilkan pengikatan yang lebih kuat dan NADES yang lebih stabil. Interaksi utama antara Men dan CO 2 adalah H O⋯C dan C H⋯O, dengan H O⋯C menjadi jenis yang dominan (Gambar 9D ). Sebagai perbandingan, isosurface biru yang lebih dalam antara Dea dan CO 2 menunjukkan interaksi H O⋯C yang lebih kuat (Gambar 9E ), yang berkontribusi pada kelarutan CO 2 yang lebih besar dari Dea relatif terhadap Men. Perlu dicatat bahwa NADES yang terbentuk dari Men:Dea dalam rasio 2:1 (Gambar 9F ) menunjukkan banyak interaksi dengan CO 2 (H O⋯C, vdW, HB), yang menghasilkan peningkatan yang nyata dalam kelarutan CO 2 dibandingkan monomer Dea dan Men. Temuan ini konsisten dengan analisis energi pengikatan dan ESP.
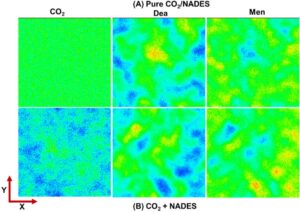
4.4.3 Distribusi AND
Distribusi 2D AND dalam bidang x – y berdasarkan simulasi MD diamati untuk mengidentifikasi perilaku pencampuran mikroskopis pada tingkat molekuler massal. Seperti yang dapat dilihat pada Gambar 10A , CO 2 murni menunjukkan tingkat homogenitas atau isotropi yang tinggi karena daerah distribusi densitas yang kecil. Namun, NADES Men:Dea (2:1) menunjukkan karakteristik distribusi yang tidak homogen atau anisotropik dari Men dan Dea, yang mengonfirmasi bahwa perilaku pencampuran NADES pada tingkat mikro-molekul didominasi oleh interaksi HB antara Men dan Dea. Untuk sistem NADES-CO 2 (Gambar 10B ), distribusi AND CO 2 dalam NADES memiliki perilaku agregasi yang sangat anisotropik. Hal ini disebabkan oleh interaksi antarmolekul antara CO 2 dan NADES, yang mengganggu sistem CO 2 murni dalam interaksi antarmolekul asli yang homogen. Hal ini pada gilirannya menjadi alasan untuk kelarutan CO 2 yang baik dalam NADES. Distribusi AND Dea dan Men dalam sistem NADES-CO 2 tampaknya sedikit lebih anisotropik daripada distribusi dalam sistem NADES tunggal, yang disebabkan oleh keberadaan CO 2 yang memengaruhi, sampai batas tertentu, jaringan HB antara molekul Dea dan Men. Sebagai kesimpulan, temuan di atas memberikan pemahaman yang lebih mendalam tentang penyerapan CO 2 dalam NADES dari perspektif distribusi mikro molekul massal. Pada prinsipnya, perilaku distribusi mikro disebabkan oleh interaksi antarmolekul CO 2 -CO 2 dan Men-/Dea-CO 2 , seperti yang dibahas selanjutnya.
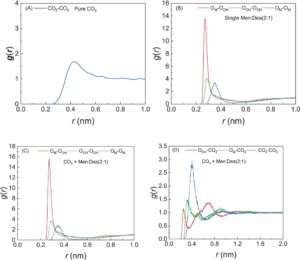
RDF adalah distribusi probabilitas atom atau posisi yang dihitung di sekitar posisi referensi pusat atau atom. Analisis RDF selanjutnya dapat mengidentifikasi distribusi struktur mikro dan interaksi antarmolekul CO 2 -NADES. Seperti yang dapat dilihat dari Gambar 11A , RDF dari sistem CO 2 murni hanya memiliki satu puncak pada sekitar r = 0,42 nm, yang mewakili interaksi vdW yang lemah antara molekul CO 2 CO 2 . Tidak ada puncak lain di luar, yang menunjukkan homogenitas sistem, yang konsisten dengan analisis AND. Seperti yang dapat dilihat dari Gambar 11A , untuk sistem NADES Men:Dea (2:1), puncak yang sangat kuat muncul dalam kurva RDF oksigen (O M ) dalam Men dan oksigen hidroksil terminal (O OH ) dalam Dea pada sekitar r = 0,27 nm, yang menunjukkan interaksi HB yang kuat antara Men–Dea, yang merupakan mekanisme pembentukan NADES. Puncak muncul pada kurva RDF antara hidroksil terminal O di Dea pada sekitar r = 0,29 nm, yang mewakili interaksi HB di antara molekul Dea. Puncak RDF O O dalam molekul Men muncul pada r = 0,34 nm, yang mewakili interaksi HB Men–Men. Dengan membandingkan ketiga jenis RDF ini, dapat diamati bahwa RDF Men–Dea memiliki intensitas puncak tertinggi dan jarak terdekat. Ini menunjukkan bahwa efek HB yang lebih kuat dari Dea–Men menghancurkan jaringan HB asli Men–Men dan Dea–Dea, membentuk NADES. Gambar 11C,D menunjukkan karakteristik RDF yang relevan dalam sistem CO 2 + NADES. Dari Gambar 11C , dapat dilihat bahwa intensitas puncak RDF Men–Dea sedikit meningkat, sedangkan intensitas puncak RDF Men-Men dan Dea-Dea sedikit melemah dibandingkan dengan sistem NADES tunggal (Gambar 11B ), yang menunjukkan bahwa penambahan CO 2 telah mengubah struktur jaringan HB di dalam DES asli, yang menyebabkannya direkonstruksi. Perubahan ini disebabkan oleh interaksi antara CO 2 dan Men/Dea. Pada Gambar 11D , dapat dilihat bahwa RDF Men-CO 2 dan Dea-CO 2 memiliki puncak pada r = 0,25 dan r = 0,32 nm, masing-masing, yang mewakili interaksi dengan CO 2 , dan yang pertama lebih kuat daripada yang terakhir, yang konsisten dengan hasil perhitungan QC. Posisi puncak RDF CO 2 murni CO 2 tidak berubah dibandingkan dengan CO 2 murnisistem, tetapi intensitasnya meningkat secara signifikan, yang disebabkan oleh interaksi antara CO 2 dan NADES, yang konsisten dengan hasil analisis AND.
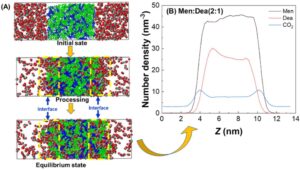
Selain itu, perilaku antarmuka penangkapan CO 2 oleh NADES diselidiki melalui simulasi MD. Hasilnya ditunjukkan pada Gambar 12. Dapat dilihat bahwa molekul CO 2 pertama-tama bergerak terus menerus dari fase massal ke antarmuka, dan kemudian berdifusi dari antarmuka ke fase utama NADES selama proses penyerapan CO 2 (Gambar 12A ). Konsentrasi molekul CO 2 di daerah yang terlibat terkonsentrasi di antarmuka, dan di sini juga merupakan konsentrasi resistansi utama dari proses penyerapan. Seperti yang ditunjukkan pada Gambar 12B , distribusi kerapatan jumlah menunjukkan bahwa molekul Men lebih terdesentralisasi; namun, molekul Dea menunjukkan distribusi konsentrasi yang lebih tinggi di antarmuka, mungkin karena interaksi yang lebih kuat antara molekul Dea dan CO 2 , yang mendorong mereka untuk terus menangkap molekul CO 2 dari antarmuka ke fase utama NADES. Sebagai kesimpulan, mekanisme mikroskopis antarmuka penyerapan CO 2 oleh NADES dapat memberikan panduan teoritis untuk penyerapan CO 2 yang ditingkatkan secara antarmuka .
4.4.5 Properti transportasi dan volume bebas berdasarkan simulasi MD
Selain perilaku termodinamika, seperti kelarutan dan koefisien Henry, sifat transpor merupakan kriteria evaluasi penting untuk proses penyerapan CO 2 , dan besarnya koefisien difusi dalam campuran CO 2 + NADES dapat membantu memprioritaskan kandidat penyerap. Dalam penelitian ini, koefisien difusi diri ( Di ) dari CO 2 , Men, dan Dea dihitung menggunakan persamaan Einstein berdasarkan simulasi MD sebagai berikut
![]()
Di mana
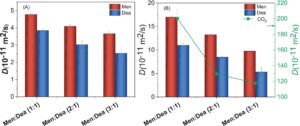
menunjukkan perpindahan kuadrat rata-rata (MSD) molekul/spesies i . Sebenarnya, D i diperoleh dengan memasang kurva linier pada MSD dari waktu ke waktu 20 ns terakhir untuk lintasan MD. Seperti dapat dilihat dari Gambar 13 (Tabel S9 untuk detail data lebih lanjut), nilai D i Men lebih tinggi daripada nilai D i Dea dalam sistem NADES tunggal dan NADES + CO 2 , dan nilai D i Men dan Dea menurun dengan meningkatnya rasio HBD/HBA dalam urutan Men:Dea (1:1) > Men:Dea (2:1) > Men:Dea (3:1). Urutan ini berlawanan dengan urutan yang ditemukan untuk viskositas sistem, yaitu, nilai D i yang lebih tinggi sesuai dengan sistem dengan viskositas yang lebih rendah (Gambar 6 ). Nilai D i molekul CO 2 , Men, dan Dea dalam sistem NADES + CO 2 juga menunjukkan kecenderungan serupa untuk menurun dengan meningkatnya rasio Men/Dea. Khususnya, nilai D i dari Men dan Dea dalam sistem NADES + CO 2 lebih tinggi daripada nilai D i dalam NADES bebas CO 2 yang sesuai . Ini menunjukkan bahwa penambahan CO 2 membuat sistem lebih longgar dan mengurangi viskositas sistem. Mekanisme di balik fenomena ini dapat dikaitkan dengan efek volume bebas (efek entropi) kecuali untuk efek interaksi (efek entalpi), yaitu, sistem yang kurang kental memiliki volume bebas dan fraksi volume bebas yang lebih besar (Tabel S10 ). Ini konsisten dengan urutan viskositas yang diprediksi oleh PC-SAFT untuk sistem NADES + CO 2 , yaitu, Men:Dea (1:1) < Men:Dea (2:1) < Men:Dea (3:1). Dengan demikian, NADES Men:Dea dengan fraksi Men terendah (maks 1:1 dipelajari dalam karya ini) direkomendasikan sebagai penyerap optimal untuk penyerapan CO 2 yang efisien karena memungkinkan kelarutan CO 2 dan koefisien difusi yang tinggi dan viskositas rendah.
5 KESIMPULAN
Kami secara sistematis menyelidiki sifat-sifat penangkapan CO 2 dengan NADES hidrofobik bebas halogen sebagai penyerap hijau dari perspektif termodinamik dan molekuler. Lima NADES yang terdiri dari Dea, Men, Thy, dan Lid sebagai HBA/HBD disiapkan, dan kelarutan CO 2 dalam NADES ini ditentukan secara eksperimental. Hasilnya menunjukkan bahwa NADES Men:Dea dapat diperlakukan sebagai penyerap terbaik di antara NADES yang dipelajari dalam penelitian ini. PC-SAFT secara bersamaan digunakan untuk memprediksi sifat termodinamik (kelarutan CO 2 , konstanta Henry, perubahan entalpi, perubahan energi bebas Gibbs, dan perubahan entropi untuk penyerapan CO 2 dalam NADES) dan untuk memprediksi sifat transpor (viskositas) untuk pertama kalinya. Dalam pemodelan PC-SAFT, dua strategi (yaitu, Pendekatan I, NADES sebagai komponen pseudo-murni dan Pendekatan II, DES sebagai campuran biner yang terdiri dari HBA dan HBD individual) untuk menangani komposisi NADES, termasuk tiga metode PC-SAFT (I), PC-SAFT (I + k ij ) dan PC-SAFT (II), digunakan untuk memprediksi sistem CO 2 + NADES, di mana PC-SAFT (I + k ij ) memiliki akurasi prediksi yang sangat dekat dengan PC-SAFT (II). PC-SAFT (II) mungkin merupakan metode universal yang lebih disukai dibandingkan dengan PC-SAFT (I + k ij ) karena yang pertama dapat mencerminkan perubahan dalam rasio molar HBA/HBD dalam sistem DES berdasarkan pada serangkaian parameter komponen murni yang identik dan lebih dapat diperluas daripada PC-SAFT (I + k ij ). Mekanisme molekuler di balik CO 2 ditangkap dengan NADES Men:Dea oleh perhitungan QC dan simulasi MD. Hasil penelitian menunjukkan bahwa Men:Dea menunjukkan beberapa interaksi dengan CO 2 (misalnya, interaksi H O⋯C, vdW, HB). Sementara itu, NADES dengan rasio Men:Dea yang lebih rendah memiliki koefisien difusi diri dan volume bebas yang lebih besar, yang mengarah pada peningkatan viskositas (rendah).
Pendekatan penelitian berdasarkan perspektif mikro-mekanisme molekuler termodinamika yang disajikan dalam studi ini memberikan panduan teoritis untuk pengembangan dan desain DES baru lainnya untuk penangkapan CO 2 yang efisien dan juga memperluas jendela aplikasi NADES. DES yang diharapkan harus memiliki kelarutan CO 2 yang tinggi dan koefisien difusi yang tinggi (viskositas rendah). Dari sudut pandang interaksi antarmolekul mikroskopis yang berasal dari perhitungan DFT dan simulasi MD, jaringan HB antarmolekul di dalam DES perlu lebih longgar, sedangkan interaksi antara HBA/HBD-CO 2 (misalnya, interaksi H O⋯C, vdW dan HB) perlu lebih lemah untuk berhasil mencapai koefisien difusi yang lebih rendah. Berdasarkan DES Men:Dea yang dipelajari dalam karya ini, ini dapat dicapai dengan mengubah jumlah atau jenis gugus kunci HBA/HBD (misalnya, COOH, CO dan cincin benzena). Selain itu, prediksi kelarutan CO 2 dilakukan menggunakan PC-SAFT (II) untuk HBA/HBD baru (parameter PC-SAFT komponen murni dari HBA dan HBD). Teori ES disarankan untuk digunakan (berdasarkan semata-mata pada parameter HBA/HBD komponen murni yang tersedia) untuk prediksi viskositas, yang akan memungkinkan validasi cepat potensi DES baru untuk penangkapan CO 2 dari perspektif termodinamika dan transportasi. Akhirnya, teori tersebut akan memerlukan eksperimen untuk validasi lebih lanjut. Strategi penelitian yang diusulkan ini, jika diikuti dengan sukses, akan berfungsi sebagai metode sistematis yang efisien untuk pendekatan desain dan penyaringan DES guna menyingkirkan eksperimen coba-coba yang mahal.
