ABSTRAK
Spillback—di mana spesies non-asli meningkatkan prevalensi patogen asli—berpotensi menjadi mekanisme penting yang dengannya spesies non-asli berkontribusi pada kemunculan penyakit zoonosis. Namun, spillback belum ditunjukkan secara langsung karena sulit untuk melepaskan diri dari faktor-faktor pengganggu yang berkorelasi dengan kelimpahan spesies non-asli dan prevalensi patogen asli. Di sini, kami memanfaatkan pelepasan burung pegar non-asli (Phasianus colchicus) yang direplikasi dan eksperimental untuk membandingkan kelimpahan vektor dan prevalensi patogen asli antara lokasi dengan kondisi lokal yang serupa tetapi kepadatan non-asli yang berbeda. Prevalensi Borrelia spp. (agen penyebab penyakit Lyme) pada kutu yang mencari hampir 2,5x lebih tinggi di hutan tempat burung pegar dilepaskan dibandingkan dengan hutan kontrol, dengan efek yang sangat kuat pada Borrelia garinii, genospesies spesialis burung. Lebih jauh lagi, kutu dewasa (tetapi bukan nimfa) cenderung lebih melimpah di hutan pelepasan burung pegar. Karya ini memberikan bukti bahwa spesies non-asli dapat memengaruhi prevalensi patogen zoonosis melalui dampak balik dalam konteks yang relevan secara ekologis.
1 Pendahuluan
Hilangnya keanekaragaman hayati yang semakin cepat dan perluasan perdagangan internasional telah membuat ekosistem rentan terhadap masuknya, terbentuknya, dan menyebarnya spesies non-asli (Kennedy et al. 2002 ; Sardain et al. 2019 ; Stachowicz et al. 2002 ). Bukti semakin banyak menunjukkan bahwa proses-proses ini memainkan peran kunci dalam kemunculan dan kemunculan kembali penyakit zoonosis (Roy et al. 2023 ; Zhang et al. 2022 ), dengan memberikan peluang bagi terbentuknya interaksi parasit-inang baru atau dengan mengubah dinamika jalur penularan penyakit yang ada (Young et al. 2017 ). Non-asli dapat memperkenalkan patogen dari daerah asalnya ke inang baru (‘spillover’; Power dan Mitchell 2004 ; Nanetti et al. 2021 ), memperbanyak patogen asli (‘spillback’; Kelly et al. 2009 ), atau mengubah dinamika penyakit dengan mengubah komposisi komunitas inang/vektor asli (Burkett-Cadena et al. 2021 ; Hoyer et al. 2017 ).
Spillback kemungkinan merupakan mekanisme yang paling umum, namun mekanisme ini kurang mendapat perhatian dibandingkan spillover dan secara umum kurang dipahami dengan baik (Kelly et al. 2009 ). Salah satu alasan potensial adalah spillback sulit untuk dibuktikan secara meyakinkan. Pengamatan spesies non-asli yang menjadi inang patogen asli sering digunakan sebagai bukti spillback (Bezerra-Santos et al. 2023 ). Namun, untuk memengaruhi dinamika penyakit melalui spillback, spesies non-asli tidak hanya harus rentan terhadap infeksi oleh patogen asli tetapi juga harus menularkan patogen secara efektif (Downs et al. 2019 ). Lebih jauh lagi, mengingat keragaman efek yang dapat diberikan oleh non-asli pada komposisi komunitas inang asli (Hoyer et al. 2017 ), efek keseluruhan non-asli pada prevalensi patogen asli sulit diprediksi (Swei et al. 2012 ). Untuk menunjukkan adanya spillback, pengukuran prevalensi patogen zoonosis pada inang/vektor asli sangat penting dan, dalam kasus patogen yang ditularkan melalui vektor, pengukuran dan penghitungan perubahan dalam kelimpahan vektor juga sangat penting.
Demonstrasi spillback juga rumit karena efek spesies non-asli pada dinamika penyakit sering kali tercampur dengan faktor-faktor yang berkorelasi (Carlson et al. 2022 ; Halliday et al. 2020 ; Young et al. 2017 ; Zhang et al. 2022 ). Misalnya, gangguan antropogenik dikaitkan dengan kelimpahan non-asli yang tinggi (MacDougall et al. 2014 ) dan peningkatan prevalensi penyakit yang terlepas dari pengenalan spesies, misalnya, dengan mengubah komposisi komunitas inang asli (Ostfeld 2009 ), menimbulkan stres pada inang asli (Narayan 2019 ) atau mengubah kepadatan inang asli (Mbora dan McPeek 2009 ). Mempelajari spesies non-asli yang sengaja diperkenalkan untuk kegiatan rekreasi atau komersial, seperti berburu atau memancing, memberikan kesempatan untuk mengatasi komplikasi ini. Pengenalan yang disengaja ini umum terjadi: > 20% spesies non-asli diperkirakan telah ditranslokasi dan akan diisi kembali untuk kegiatan rekreasi (Carpio et al. 2017 ; Jeschke dan Strayer 2006 ). Dibandingkan dengan spesies yang diperkenalkan secara tidak sengaja, non-asli yang diperkenalkan secara sengaja ini cenderung tidak menyebar (Jeschke dan Strayer 2006 ), dan dengan demikian cenderung memiliki distribusi yang mengelompok dalam suatu lanskap. Dengan demikian, prevalensi patogen pada inang/vektor asli dapat dibandingkan antara lokasi dengan kepadatan non-asli yang tinggi dan rendah, tetapi dengan kondisi lokal yang serupa (yaitu, iklim, gangguan antropogenik, dan penggunaan lahan). Lebih jauh lagi, dalam konteks biologi invasi, non-asli yang diperkenalkan secara sengaja juga bertindak sebagai model yang lebih relevan secara ekologis daripada spesies non-asli yang sepenuhnya domestik, yang juga sering berinteraksi dengan siklus penularan penyakit satwa liar (Bouwmeester et al. 2021 ; Ayala et al. 2020 ).
Di Inggris, sekitar 47 juta burung pegar biasa ( Phasianus colchicus Linnaeus 1758) dilepaskan setiap tahun untuk berburu rekreasi (Aebischer 2019 ). Biomassa burung pegar di akhir musim panas diperkirakan setara dengan semua burung asli Inggris yang berkembang biak secara gabungan (Blackburn dan Gaston 2021 ), tetapi konsekuensi ekologis dari pelepasan ini masih kurang dipahami (Madden et al. 2023 ). Salah satu konsekuensi potensial dari pelepasan burung pegar adalah amplifikasi patogen zoonosis, khususnya Borrelia burgdorferi sensu lato (Johnson et al. 1984 ; Kurtenbach, Carey, et al. 1998 ; Kurtenbach, Peacey, et al. 1998 ). Borrelia burgdorferi sl adalah agen penyebab penyakit Lyme, penyakit zoonosis yang ditularkan melalui vektor yang paling umum di belahan bumi utara (Lindgren dan Jaenson 2006 ). Burung pegar dapat menampung ratusan kutu Ixodes ricinus (Linnaeus 1758) (Hoodless et al. 2002 ), vektor B. burgdorferi sl, dan uji coba eksperimental di penangkaran telah menunjukkan bahwa burung pegar dapat tertular dan menularkan kembali B. burgdorferi sl ke dan dari I. ricinus (Craine et al. 1997 ; Kurtenbach, Carey, et al. 1998 ; Kurtenbach, Peacey, et al. 1998 ). Namun, dampak pelepasan burung pegar pada kelimpahan kutu dan prevalensi Borrelia sp. pada kutu, dalam konteks yang relevan secara ekologis, belum diukur.
Di sini kami menguji apakah pelepasan burung-burung non-asli ini mempengaruhi amplifikasi patogen zoonosis. Secara khusus, kami membandingkan kelimpahan kutu dan prevalensi B. burgdorferi sl pada kutu antara hutan (selanjutnya disebut sebagai ‘hutan’) tempat burung pegar dilepaskan, dan hutan berpasangan tempat tidak ada burung pegar yang dilepaskan. Untuk lebih memahami kepentingan relatif dari efek spillback langsung vs. efek tidak langsung (misalnya, perubahan dalam komposisi komunitas inang), kami juga menentukan genospesies Borrelia mana yang paling terpengaruh oleh pelepasan burung pegar. Kami memperkirakan prevalensi B. burgdorferi sl yang lebih tinggi pada kutu dari hutan pelepasan burung pegar dan untuk spesialis burung Borrelia garinii (Baranton et al. 1992 ) (Hanincová et al. 2003 ) yang paling kuat diperkuat.
2 Bahan dan Metode
2.1 Pelepasan Burung Pegar untuk Menembak Rekreasi
Di Inggris Raya, burung pegar biasa ( P. colchicus ) dilepaskan setiap tahun untuk tujuan berburu rekreasi (Aebischer 2019 ). Organisasi yang melepaskan burung pegar disebut sebagai ‘shoots’. Di musim panas, shoots melepaskan burung pegar muda ke ‘kandang pelepasan’—kandang berpagar di dalam hutan. Jumlah burung pegar yang dilepaskan sangat bervariasi, mulai dari beberapa ratus hingga lebih dari 100.000 ekor per sesi pelepasan. Kandang pelepasan dilengkapi gerbang kecil tempat burung pegar dapat keluar ke hutan di sekitarnya dan masuk kembali dengan bebas sejak dilepaskan. Shoots dapat menggunakan satu kandang di hutan tunggal, beberapa kandang di hutan tunggal, atau beberapa kandang di hutan terpisah. Karena kandang mahal untuk dibangun, kandang digunakan kembali setiap tahun hingga 20 tahun sebelum dibangun kembali atau direlokasi (Draycott et al. 2006 ; Sage et al. 2005 ).
Di kandang pelepasan, burung pegar diberi makanan, air, dan tempat berteduh. Pemberian makanan biasanya berlanjut hingga akhir musim berburu pada tanggal 1 Februari. Beberapa tempat berburu terus menyediakan makanan bagi burung pegar setelah musim berburu berakhir, dengan tujuan untuk membangun populasi liar, sementara yang lain secara proaktif memusnahkan burung pegar yang tersisa dalam upaya untuk mengurangi penularan penyakit antar-tahunan di antara kelompok burung pegar. Dalam kedua skenario tersebut, tingkat kematian burung pegar tinggi. Diperkirakan hanya 9% burung pegar yang masih hidup di musim semi dibandingkan dengan jumlah puncaknya di akhir musim panas (Blackburn dan Gaston 2021 ).
2.2 Lokasi Pengambilan Sampel
Dua puluh lima pucuk dari barat daya Inggris disertakan dalam studi ini, yang menangkap kisaran besarnya pelepasan burung pegar (median: 5000; IQR: 2000—20.500; kisaran: 300–105.000 burung yang dilepaskan) yang ada di seluruh pucuk. Setiap pucuk dikunjungi selama periode aktivitas kutu tinggi (10 Mei—16 Juli 2022). Di setiap pucuk, kami bertujuan untuk mengumpulkan kutu dari dua hutan tempat burung pegar dilepaskan selama musim panas sebelum pengumpulan kutu (selanjutnya disebut sebagai ‘hutan pelepasan’) dan dua hutan tempat tidak ada burung pegar yang dilepaskan (selanjutnya disebut sebagai ‘hutan kontrol’). Hutan kontrol berada antara 1 dan 2,5 km dari kandang pelepasan terdekat yang diketahui, jarak di luar kisaran penyebaran burung pegar pasca-pelepasan yang umum (Turner 2008 ; Gambar 1 ). Hutan kontrol dan pelepasan dapat berupa empat bagian dari satu habitat hutan yang bersebelahan atau hutan terisolasi yang dipisahkan oleh ladang atau jalan. Kami memverifikasi kesesuaian hutan kontrol dengan mengonfirmasi tidak adanya tanda-tanda yang terlihat dari pelepasan burung pegar menggunakan peta Google (misalnya, pagar atau tanaman penutup di dekatnya; Madden dan Sage 2020 ), berkonsultasi dengan pengelola rebung lokal untuk mengonfirmasi tidak ada riwayat pelepasan burung pegar yang diketahui, dan memeriksa tanda-tanda yang terlihat dari pelepasan burung pegar di masa lalu atau saat ini ketika hutan dikunjungi untuk pengambilan sampel kutu (misalnya, tempat makan tambahan, pagar kandang pelepasan). Di tujuh rebung, hanya satu hutan kontrol yang diambil sampelnya yang memenuhi kriteria ini. Di empat rebung, hanya satu hutan pelepasan yang diambil sampelnya karena semua burung pegar dilepaskan dari satu kandang. Secara total, kutu dikumpulkan dari 89 hutan (46 hutan pelepasan dan 43 hutan kontrol).
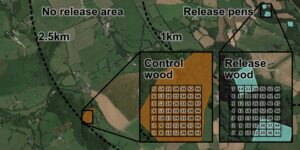
2.3 Pengambilan Sampel Kutu
Bahasa Indonesia: Untuk mengukur kelimpahan I. ricinus di hutan kontrol dan hutan lepas, kami menyeret kain katun putih 1 m 2 sepanjang transek 5 m di atas vegetasi lantai hutan (yaitu, meliputi area seluas 5 m 2 ). Untuk setiap transek (selanjutnya disebut sebagai ‘seretan’), kami mengumpulkan semua kutu nimfa dan dewasa yang menempel pada kain dan menyimpannya dalam etanol 97%. Kami menyelesaikan 10 seretan terstruktur di setiap hutan. Lokasi setiap seretan dipilih secara acak dari kisi 7 × 7 sel 10 m 2 yang dibuat menggunakan QGIS (QGIS Association, nd ) (Gambar 1 ). Hanya satu seretan yang diselesaikan di setiap sel. Untuk meningkatkan akurasi estimasi prevalensi Borrelia sp. kami, di hutan tempat < 20 kutu dikumpulkan selama 10 seretan terstruktur awal ( n = 59), kami melanjutkan dengan penyeretan ad hoc hingga setidaknya 20 kutu dikumpulkan. Perkiraan kelimpahan kutu diperoleh secara eksklusif menggunakan data dari 10 tarikan terstruktur awal. Kami tidak mengumpulkan kutu pada tahap kehidupan pertama mereka (larva), karena B. burgdorferi sl sangat jarang ditularkan dari kutu betina dewasa ke keturunannya, dan dengan demikian larva memainkan peran kecil dalam penularan penyakit Lyme (Richter et al. 2012 ; Rollend et al. 2013 ). Dengan menggunakan kunci morfologi (Hillyard 1996 ), kami mengidentifikasi semua kutu hingga tingkat spesies dan menentukan tahap kehidupan mereka.
2.4 Variabel Ekologi
Bahasa Indonesia: Untuk memungkinkan kami mengendalikan faktor-faktor yang dapat memengaruhi kelimpahan kutu dan prevalensi Borrelia spp. terlepas dari pelepasan burung pegar, kami mencatat beberapa variabel ekologi untuk setiap tarikan. Kami mencatat tanggal saat setiap kutu dikumpulkan. Kami mengukur suhu sekitar sebelum setiap tarikan (Kahl dan Gray 2023 ; Macleod 1936 ). Karena pengaruhnya pada iklim mikro dan akibatnya, aktivitas kutu (Macleod 1936 ), kami mengkarakterisasi vegetasi lantai hutan dengan mengukur tinggi vegetasi di titik tengah setiap tarikan menggunakan pasak kayu yang ditandai pada interval 10 cm dari 0 hingga 100 cm (Nelson et al. 2015 ) dan dengan memperkirakan secara visual persentase tanah gundul di area yang diseret. Kami mencatat apakah pohon terdekat adalah spesies konifer atau berdaun lebar dan mencatat apakah seretan dilakukan di tepi (≤ 2 m dari habitat non-hutan) atau bagian dalam hutan (> 3 m dari habitat non-hutan) (Hansford et al. 2017 , 2022 ). Tidak ada seretan yang dilakukan antara 2 dan 3 m dari tepi hutan. Akhirnya, menggunakan QGIS (QGIS Association, nd ) kami mengukur total luas kontinu (m 2 ) dari hutan yang kami sampel (yaitu, tidak terputus oleh ladang, jalan besar atau sungai).
2.5 Penyaringan dan Diferensiasi Genospesies Borrelia spp.
Kami mengekstrak DNA dari kutu menggunakan protokol yang diterbitkan sebelumnya (Hansford et al. 2015 ). Kami kemudian menggunakan uji pan- Borrelia qPCR yang menargetkan gen 16 s rRNA untuk menyaring kutu untuk semua genospesies Borrelia patogen (Medlock et al. 2022 ; Parola et al. 2011 ). Untuk mengurangi biaya penyaringan, kami mengumpulkan kutu sebelum ekstraksi DNA dan penyaringan Borrelia sp. Setiap kumpulan berisi dua kutu dari tahap kehidupan yang sama, dikumpulkan dari kayu yang sama dan pada jarak yang sama dari tepi hutan. Kutu tunggal yang tersisa setelah pengumpulan diekstraksi dan disaring secara individual. Kami menganggap semua sampel dengan nilai CT < 39 sebagai Borrelia spp. positif. Probabilitas kutu individu yang membawa Borrelia spp. dimodelkan secara statistik menggunakan hasil gabungan dan individu (Metode S1 ). Untuk mengukur Borrelia spp. deteksi dan kontaminasi silang selama ekstraksi DNA atau qPCR, setiap pelat qPCR mencakup satu kontrol positif ( DNA Borrelia sp. yang dimurnikan), satu kontrol qPCR negatif (air suling), dan 12 kontrol ekstraksi (hanya amonium hidroksida). Untuk menentukan genospesies Borrelia , sampel positif diurutkan pada daerah pengatur jarak antargenik rRNA 5S-23S seperti yang dijelaskan oleh Hansford et al. ( 2023 ).
2.6 Analisis Statistik
Analisis statistik diselesaikan dalam kerangka Bayesian. Untuk setiap variabel, kami melaporkan estimasi koefisien rata-rata dari distribusi posterior beserta interval kepadatan posterior tertinggi (HPDI) sebesar 95%.
Model terpisah dibangun untuk menguji efek pelepasan burung pegar pada kelimpahan kutu, prevalensi Borrelia spp. pada kutu, dan prevalensi Borrelia spesifik genospesies pada kutu. Untuk meningkatkan kemampuan kami dalam mendeteksi efek ini, dan untuk memisahkan efek langsung pelepasan burung pegar dari efek yang dimediasi oleh variasi ekologi di seluruh hutan, kami menyertakan variabel ekologi sebagai kovariat. Untuk mengidentifikasi variabel ekologi mana yang akan disertakan, kami membuat model yang hanya menampilkan variabel ekologi sebagai prediktor, kemudian mengecualikan variabel dengan 79% HPDI yang mencakup nol, sehingga menyisakan apa yang kami sebut sebagai ‘model nol ekologi’ (detail dalam Hasil S1 , Gambar S1 ).
2.7 Model Kelimpahan Kutu
Kelimpahan kutu dimodelkan sebagai respons binomial negatif multivariat, dengan kelimpahan nimfa dan dewasa dimodelkan sebagai pengamatan terpisah dari tarikan tunggal. Model nol ekologis mencakup ukuran hutan (area dalam m 2 ), kedalaman vegetasi, spesies pohon terdekat (konifer vs. berdaun lebar), dan persentase tanah gundul (Gambar S1A , B ). Kami kemudian menambahkan pelepasan burung pegar (hutan pelepasan vs. kontrol) sebagai prediktor biner untuk menentukan perbedaan dalam kelimpahan dewasa dan nimfa antara hutan kontrol dan hutan pelepasan burung pegar. Kami menggunakan kontras posterior (yaitu, perbedaan dalam distribusi posterior) untuk menentukan apakah efek pelepasan burung pegar berbeda antara dua tahap kehidupan. Model tersebut mencakup efek acak untuk memperhitungkan non-independensi dalam hutan ( n = 89) dan pucuk ( n = 25), dan proses Gaussian untuk memperhitungkan autokorelasi spasial di antara pucuk.
2.8 Model Prevalensi Borrelia sp.
Prevalensi kutu Borrelia sp. (yaitu, prevalensi non-genospesies-spesifik) dimodelkan sebagai respons binomial pada tingkat kutu individu. Model nol ekologis mencakup jarak dari tepi hutan (Gambar S1C ). Kami kemudian menambahkan tahap kehidupan kutu (nimfa vs. dewasa) dan pelepasan burung pegar (kayu pelepasan vs. kayu kontrol) sebagai prediktor biner dan menguji interaksi antara keduanya. Kami menggunakan distribusi binomial khusus untuk memperhitungkan dua sumber potensial kesalahan klasifikasi Borrelia spp. (McElreath 2020 , Bab 17). Ini adalah: positif palsu yang terjadi karena kutu negatif dan positif Borrelia spp. digabungkan bersama, dan positif palsu karena peluang kontaminasi silang 0,05% selama ekstraksi DNA/qPCR (Metode S1 ). Pendekatan ini memungkinkan kami untuk mendapatkan estimasi ukuran efek yang lebih akurat daripada yang mungkin dilakukan dengan menggunakan prevalensi minimum/maksimum yang mungkin (Fracasso et al. 2023 ). Model ini juga menyertakan efek acak untuk memperhitungkan non-independensi dalam hutan ( n = 89) dan pucuk ( n = 25), dan proses Gaussian untuk memperhitungkan autokorelasi spasial di antara pucuk.
2.9 Model Prevalensi Borrelia Spesifik Genospesies
Bahasa Indonesia : Untuk menentukan apakah genospesies Borrelia yang berbeda merespons secara berbeda terhadap pelepasan burung pegar, kami menggunakan model multinomial dengan lima hasil: terinfeksi B. garinii , terinfeksi B. afzelii (Canica et al. 1993 ), terinfeksi B. valaisiana (Wang et al. 1997 ), lainnya/tidak teratasi, dan tidak terinfeksi. Kami tidak dapat menjelaskan kesalahan klasifikasi dalam model ini; sebaliknya, kami menggunakan prevalensi maksimum yang mungkin sebagai variabel respons, dengan pengimbang untuk ukuran kumpulan kutu. Prevalensi maksimum yang mungkin adalah perkiraan karena genospesies dari 25 sampel tidak dapat diselesaikan. Kami menyertakan prediktor tahap kehidupan kutu (nimfa vs. dewasa) dan pelepasan burung pegar (hutan kontrol vs. hutan pelepasan), dan efek acak kayu ( n = 89) dan pucuk ( n = 25). Untuk memastikan eksplorasi posterior yang tidak bias, model ini tidak menampilkan proses Gaussian yang memperhitungkan autokorelasi spasial di antara pucuk.
2.10 Analisis Sensitivitas dan Efek Besaran Pelepasan
Kami menyelesaikan analisis sensitivitas untuk menentukan apakah perkiraan dampak pelepasan burung pegar terhadap kelimpahan kutu dan prevalensi Borrelia spp. bergantung pada penyertaan variabel ekologi tertentu (Hasil S2 , Gambar S2 ). Lebih jauh, kami melakukan analisis tambahan untuk mengeksplorasi dampak besaran pelepasan (yaitu, jumlah burung pegar yang dilepaskan saat pemotretan) terhadap kelimpahan kutu dan prevalensi Borrelia sp. (Hasil S3 ; Gambar S3 ).
Semua analisis diselesaikan dalam versi R 4.1.0 (Tim Inti R 2023 ), menggunakan paket ‘rethinking’ (McElreath 2020 ) dan ‘brms’ (Bürkner 2021 )—kompiler untuk platform pemodelan STAN (Tim Pengembangan Stan 2023 ). Semua model diimplementasikan menggunakan 4000 sampel dari empat rantai. Diagnostik model, termasuk plot jejak dan nilai R-hat (<1,01), tidak menunjukkan masalah dengan konvergensi atau eksplorasi posterior yang bias.
3 Hasil
3.1 Kelimpahan Kutu
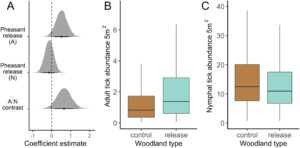
Selama pengerahan terstruktur, 693 nimfa dan 54 kutu dewasa dikumpulkan dari hutan kontrol ( n = 43) dibandingkan dengan 671 nimfa dan 110 kutu dewasa dari hutan pelepasan ( n = 46). Semua kutu diidentifikasi sebagai I. ricinus . Kelimpahan kutu dewasa cenderung lebih tinggi di hutan pelepasan burung pegar dibandingkan dengan hutan kontrol (efek rata-rata: 0,52, 95% HPDI: -0,07 hingga 1,11 [skala log]; Gambar 2A ), sedangkan tidak ada efek pada kelimpahan nimfa yang diamati (efek rata-rata: -0,13, 95% HPDI: -0,60 hingga 0,32 [skala log]; Gambar 2A ). Kontras antara efek-efek ini tidak secara kuat menunjukkan bahwa efek pelepasan burung pegar berbeda antara dua tahap kehidupan (efek rata-rata: 0,65, 95% HPDI: −0,13 hingga 1,37 [skala log]; Gambar 2A ). Hasil-hasil ini tidak bergantung pada penyertaan variabel ekologi (Hasil S2 ; Gambar S2 ) dan tidak berubah ketika interaksi pelepasan burung pegar × besarnya pelepasan ditambahkan ke model (Hasil S3 ). Tinjauan umum estimasi posterior untuk semua parameter ditunjukkan pada Gambar S4A , B .
3.2 Prevalensi Borrelia Spp.
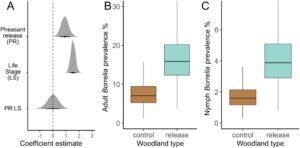
Sebanyak 2493 (343 dewasa dan 2150 nimfa) kutu I. ricinus disaring untuk Borrelia spp. Kami menemukan bukti kuat bahwa kutu nimfa dan dewasa yang dikumpulkan dari hutan pelepasan burung pegar lebih mungkin terinfeksi Borrelia spp. (efek rata-rata: 0,92, 95% HPDI: 0,33–1,5 [skala logit]; Gambar 3A ). Prevalensi Borrelia spp. pada kutu yang dikumpulkan dari hutan pelepasan burung pegar adalah 2,45 kali lebih tinggi daripada kutu yang dikumpulkan dari hutan kontrol (peningkatan persentase rata-rata: 144,58%, 95% HPDI: 19,18%–291,6%; Gambar 3B,C ). Kami juga menemukan bukti kuat bahwa Borrelia spp. Prevalensi lebih tinggi pada burung dewasa daripada pada nimfa (efek rata-rata: 1,55, 95% HPDI: 1,15–1,88 (skala logit); Gambar 3A ) tetapi tidak ada bukti bahwa pelepasan burung pegar memengaruhi prevalensi Borrelia spp. pada burung dewasa dan nimfa secara berbeda (efek rata-rata: -0,03, 95% HPDI: -0,87 hingga 0,79 (skala logit); Gambar 3A ). Hasil-hasil ini tidak bergantung pada penyertaan variabel ekologi dalam model (Hasil S2 ; Gambar S2 ) dan tidak berubah ketika interaksi pelepasan burung pegar × besarnya pelepasan ditambahkan (Hasil S3 ). Tinjauan umum estimasi posterior untuk semua parameter ditunjukkan pada Gambar S4C .
3.3 Prevalensi Borrelia Spesifik Genospesies
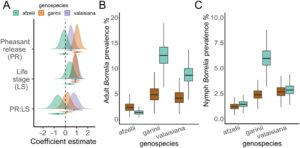
Genospesies Borrelia dari 167/192 sampel positif berhasil ditentukan. Tiga genospesies yang paling umum dalam sampel kami adalah B. garinii (51% infeksi), B. valaisiana (33% infeksi) dan B. afzelii (13% infeksi). B. garinii (efek rata-rata: 1,04, 95% HPDI: 0,57–1,51 [skala logit]; Gambar 4A–C ), dan, pada tingkat yang lebih rendah, B. valaisiana (efek rata-rata: 0,5, 95% HPDI: 0–1 [skala logit]; Gambar 4A–C ) diperkuat di lokasi pelepasan dibandingkan dengan lokasi kontrol. Tidak ada bukti bahwa prevalensi B. afzelii dipengaruhi oleh pelepasan burung pegar (efek rata-rata: -0,10, 95% HPDI: -0,68 hingga 0,49 [skala logit]; Gambar 4A–C ). Pada B. valaisiana , kami menemukan bukti kuat adanya interaksi antara pelepasan burung pegar dan tahap kehidupan kutu (efek rata-rata: 0,77, 95% HPDI: 0,06–1,48 [skala logit]; Gambar 4A ), yang mana B. valaisiana berkembang biak pada kutu dewasa tetapi tidak pada nimfa di hutan tempat pelepasan. Interaksi semacam itu tidak diamati untuk B. afzelii (efek rata-rata: -0,67, 95% HPDI: -1,5 hingga 0,12 [skala logit]; Gambar 4A ), atau B. garinii , yang diperkuat pada kedua tahap kehidupan (efek rata-rata: 0,14, 95% HPDI: -0,54 hingga 0,84 [skala logit]; Gambar 4A ). Ringkasan semua distribusi posterior dan kontras disajikan dalam Tabel S1 dan S2 .
4 Diskusi
Spillback sering diusulkan sebagai mekanisme penting yang melaluinya spesies non-asli dapat memengaruhi kemunculan penyakit zoonosis dan satwa liar. Namun, menunjukkan spillback dalam konteks yang relevan secara ekologis merupakan tantangan. Di sini kami menunjukkan bahwa prevalensi Borrelia spp. pada kutu, agen penyebab penyakit Lyme, meningkat di hutan tempat burung pegar dilepaskan dibandingkan dengan hutan tempat tidak ada burung pegar yang dilepaskan. Efek ini didorong terutama oleh amplifikasi B. garinii , genospesies spesialis burung yang menyebabkan neuroborreliosis pada manusia (Balmelli dan Piffaretti 1995 ; van Dam et al. 1993 ), dan pada tingkat yang lebih rendah oleh amplifikasi B. valaisiana . Kami juga menunjukkan bahwa ada tren peningkatan kelimpahan kutu dewasa (tetapi bukan nimfa) di hutan tempat burung pegar dilepaskan. Hasil-hasil ini menunjukkan bahwa pelepasan burung pegar non-asli dapat memperkuat risiko penyakit zoonosis melalui spillback.
Sejumlah penelitian sebelumnya telah memberikan bukti potensi spesies non-asli untuk memperbanyak patogen zoonosis (Craine et al. 1995 , 1997 ). Contohnya termasuk cacing pita Echinococcus multilocularis (Leuckart 1863), agen penyebab Alveolar Echinococcosis, yang ditemukan pada hewan pengerat non-asli (Umhang et al. 2013 ), cacing gelang patogen manusia Baylisascaris procyonis (Stefanski dan Zarnowski 1951 ) yang ditemukan pada rakun non-asli ( Procyon lotor Linnaeus 1758) (Peter et al. 2023 ) atau Borrelia spp. ditemukan pada tupai abu-abu non-asli ( Sciurus carolinensis Gmelin 1788) (Craine et al. 1995 ) dan tupai Siberia ( Eutamias sibiricus Laxmann 1769) (Marsot et al. 2013 ). Memang, analisis menunjukkan bahwa 36% dari semua spesies non-asli menjadi inang setidaknya satu patogen zoonosis (Zhang et al. 2022 ). Namun, untuk menunjukkan amplifikasi patogen oleh spesies non-asli, sangat penting untuk mengukur perubahan prevalensi patogen pada vektor atau inang asli.
Studi terbaru telah maju ke arah ini. Misalnya, prevalensi virus Everglades (EVEV) yang lebih tinggi telah diamati pada vektor nyamuk sejak ular piton Burma ( Python bivittatus Kuhl 1820) menyerang Florida Everglades. Efek ini kemungkinan besar disebabkan oleh predasi selektif oleh ular piton Burma, yang menyebabkan pergeseran komposisi komunitas inang asli yang mendukung inang hewan pengerat yang sangat kompeten (Hoyer et al. 2017 ; Burkett-Cadena et al. 2021 ). Namun, sepengetahuan kami, studi kami adalah yang pertama mengukur dampak spesies non-asli pada amplifikasi patogen zoonosis dalam pengaturan kuasi-eksperimental di beberapa lokasi pengenalan dan kontrol. Karena jangkauan penyebaran burung pegar yang terbatas (Turner 2008 ), tunas dapat dianggap sebagai peristiwa pengenalan yang direplikasi dan terlokalisasi. Replikasi spasial ini menambah kekokohan temuan kami dibandingkan dengan studi di mana beberapa sampel mungkin berasal dari satu peristiwa pengenalan. Sifat quasi-eksperimental dari pelepasan burung buruan dan desain pelepasan-kontrol berpasangan dari studi kami juga memungkinkan kami untuk memisahkan dampak non-asli itu sendiri dari proses ekologi lainnya yang mungkin berkorelasi dengan prevalensi patogen zoonosis dan memfasilitasi pengenalan dan pembentukan non-asli (Young et al. 2017 ; Zhang et al. 2022 ), misalnya, perubahan penggunaan lahan (Faust et al. 2018 ; Gottdenker et al. 2014 ), perubahan iklim (Carlson et al. 2022 ) dan hilangnya keanekaragaman hayati (Halliday et al. 2020 ).
Beberapa mekanisme yang tidak saling eksklusif dapat menyebabkan amplifikasi Borrelia sp. di hutan tempat burung pegar dilepaskan. Melalui interaksi biologis seperti memangsa invertebrata (Neumann et al. 2015 ), bertindak sebagai sumber makanan bagi meso-predator (Pringle et al. 2019 ), atau mengubah struktur vegetasi hutan (Sage et al. 2009 ), burung pegar mengubah ekosistem tempat mereka diperkenalkan (Madden et al. 2023 ; Pringle et al. 2019 ). Praktik pengelolaan yang terkait dengan pelepasan burung pegar juga dapat memengaruhi ekosistem: rata-rata tunas menyediakan 24 ton makanan tambahan pasca-pelepasan untuk burung pegar setiap tahunnya (Larkman dan Newton 2015 ), sumber daya yang sering digunakan oleh spesies non-target (Sánchez-García et al. 2015 ; Willmer dan Littlemore 2012 ). Setiap mekanisme ini dapat memengaruhi komposisi komunitas inang Borrelia spp. asli.
Meskipun membandingkan komposisi komunitas inang Borrelia spp. alami di hutan kontrol dan hutan pelepasan berada di luar cakupan studi ini, kami berpendapat bahwa amplifikasi patogen langsung oleh burung pegar (yaitu, spillback langsung) adalah penjelasan yang paling tepat untuk amplifikasi Borrelia sp. yang diamati di hutan pelepasan burung pegar. B. garinii adalah genospesies yang paling sering menginfeksi burung pegar (data EM yang tidak dipublikasikan) dan genospesies yang paling terpengaruh oleh pelepasan burung pegar. Amplifikasi Borrelia garinii berpotensi terjadi akibat peningkatan kelimpahan spesies burung lain di hutan pelepasan burung pegar. Namun, penelitian terdahulu menunjukkan bahwa sementara kelimpahan beberapa spesies burung meningkat di hutan tempat burung pegar dilepaskan (misalnya, burung dara hutan [ Columba palumbus Linnaeus 1758]), tampaknya tidak ada pengaruh pada kelimpahan inang khas B. garinii (Taragel’ová et al. 2008 ), seperti burung sariawan ( Turdus spp. Linnaeus 1758) (Draycott et al. 2008 ). Khususnya, bahkan pada rebung kecil, biomassa burung pegar yang dilepaskan berlipat ganda lebih besar daripada biomassa inang burung asli (Newson et al. 2005 ). Lebih jauh lagi, meskipun penelitian sebelumnya telah mengamati hubungan positif antara kelimpahan tikus bank ( Myodes glareolus Schreber 1780) dan tikus hutan ( Apodemus sylvaticus Linnaeus 1758) dan suplementasi makanan burung pegar sepanjang tahun (Davey 2008 ), B. afzelii , yang biasanya menginfeksi mamalia kecil (Hanincová et al. 2003 ), tidak diperkuat di hutan pelepasan dalam penelitian kami, yang menunjukkan bahwa peningkatan kelimpahan hewan pengerat tidak mungkin mendorong amplifikasi Borrelia spp. Meskipun demikian, mengonfirmasi mekanisme yang melaluinya pelepasan burung pegar memperkuat prevalensi Borrelia spp. akan menjadi langkah selanjutnya yang penting untuk mengidentifikasi strategi intervensi untuk mitigasi dampak non-asli pada risiko penyakit zoonosis.
Saat ini, jangkauan spasial efek pelepasan burung pegar terhadap amplifikasi risiko penyakit Lyme masih belum jelas. Kami menunjukkan bahwa prevalensi Borrelia spp. pada kutu hampir 2,5x lebih tinggi di hutan tempat burung pegar dilepaskan dibandingkan dengan hutan kontrol yang berjarak 1–2,5 km, kisaran berdasarkan jarak penyebaran burung pegar yang dilaporkan sebelumnya. Namun, dalam konteks yang mendukung jarak penyebaran yang lebih jauh—seperti ketersediaan makanan yang rendah (Kreuzinger-Janik et al. 2022 ) atau konektivitas yang tinggi (Baguette dan Van Dyck 2007 )—burung pegar berpotensi berpindah lebih jauh dari lokasi pelepasan. Dengan demikian, prevalensi Borrelia spp. mungkin terus menurun melampaui jarak 1–2,5 km dari kandang pelepasan. Apakah dampak pelepasan burung pegar hanya bersifat lokal atau meluas secara bertahap di seluruh lanskap akan menentukan apakah peningkatan risiko penyakit Lyme terutama merupakan bahaya kesehatan kerja bagi pengelola burung buruan yang terpapar kutu yang terinfeksi selama peternakan burung pegar, atau bahaya kesehatan yang lebih luas bagi masyarakat umum.
Sebagai kesimpulan, kami menunjukkan bahwa pelepasan burung pegar non-asli untuk berburu rekreasi dikaitkan dengan prevalensi Borrelia spp. yang hampir 2,5 kali lebih tinggi, agen penyebab penyakit Lyme, pada kutu yang mencari makan. Fakta bahwa efek ini terutama didorong oleh amplifikasi spesialis burung B. garinii , bersama dengan desain kuasi-eksperimental yang direplikasi dari penelitian kami, memberikan bukti terkuat hingga saat ini bahwa spesies non-asli dapat memengaruhi prevalensi patogen zoonosis melalui spillback dalam konteks yang relevan secara ekologis.
