Abstrak
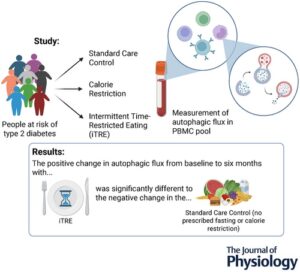
Autophagy memperlambat patologi terkait usia dan dirangsang oleh pembatasan nutrisi dalam penelitian hewan. Namun, hal ini belum pernah ditunjukkan pada manusia. Kami mengukur autophagy menggunakan ukuran fluks autophagic yang relevan secara fisiologis (fluks isoform II MAP1LC3B/LC3B-II dalam sel mononuklear darah tepi dalam konteks darah utuh) pada 121 manusia dengan obesitas yang diacak ke perawatan standar (SC, kondisi kontrol), pembatasan kalori (CR) atau puasa intermiten plus makan terbatas waktu (iTRE) selama 6 bulan. Sementara perbedaan perubahan dari garis dasar antara kelompok tidak signifikan pada 2 bulan, kami mengamati perbedaan yang signifikan dalam perubahan dari garis dasar antara iTRE dibandingkan dengan SC pada 6 bulan ( P = 0,04, analisis post hoc ). Efek ini mungkin didorong sebagian oleh kecenderungan autophagy untuk menurun pada kelompok SC. Perbedaan perubahan dari garis dasar antara CR dan SC tidak signifikan. Analisis korelasi yang tidak dikoreksi menunjukkan hubungan negatif antara perubahan autofagi dan perubahan trigliserida darah. Data tentang spesifisitas dan kinerja metode yang digunakan untuk mengukur autofagi manusia juga disajikan. Hal ini menunjukkan bahwa autofagi dapat ditingkatkan dengan pembatasan nutrisi intermiten pada manusia. Jika demikian, ini merupakan demonstrasi bahwa pembatasan nutrisi dapat digunakan untuk memperbaiki ciri utama penuaan biologis dan menyediakan mekanisme bagaimana puasa dapat menunda timbulnya penyakit terkait usia.
Poin-poin penting
- Autofagi memperlambat penuaan biologis, dan disfungsi autofagi telah dikaitkan dengan penyakit terkait usia – cara efektif untuk meningkatkan autofagi dalam sel dan model hewan adalah pembatasan nutrisi.
- Namun, dampak berbagai jenis pembatasan nutrisi terhadap aliran autofagik fisiologis pada manusia belum diteliti secara luas.
- Di sini kami mengukur efek pembatasan makan berkala dengan waktu terbatas (iTRE) dan pembatasan kalori terhadap fluks autofagik fisiologis dalam sel mononuklear darah tepi.
- Setelah 6 bulan, terdapat perbedaan perubahan yang signifikan dari garis dasar antara kelompok iTRE dan kelompok kontrol perawatan standar, dengan fluks yang lebih tinggi pada kelompok iTRE pada titik waktu ini.
- Namun, tidak ada peningkatan signifikan dari titik awal dalam kelompok iTRE, yang menunjukkan bahwa meskipun autofagi dapat dimodifikasi oleh pembatasan nutrisi pada manusia, penelitian lebih lanjut diperlukan.
Perkenalan
Pembatasan kalori sedang (CR) merupakan strategi manajemen berat badan yang mapan dan mengurangi risiko penyakit kronis seperti diabetes tipe 2 (Diabetes Prevention Program Research et al., 2009 ). Puasa intermiten (IF) merupakan alternatif untuk CR (Patikorn et al., 2021 ). Pemahaman yang lebih baru tentang aspek temporal dari pengaturan waktu nutrisi telah menghasilkan konsep makan terbatas waktu sebagai bentuk baru IF yang menekankan jendela makan harian yang lebih pendek (4–10 jam) yang selaras dengan ritme sirkadian (Regmi & Heilbronn, 2020 ; Teong et al., 2023 ). Puasa, CR, dan IF dapat meningkatkan autofagi pada model hewan (Cavallini et al., 2001 ; Chaudhary et al., 2022 ; Martinez-Lopez et al., 2017 ; Mizushima et al., 2004 ; Ulgherait et al., 2021 ) dan meningkatkan ekspresi gen terkait autofagi pada otot manusia dan darah tepi (Jamshed et al., 2019 ; Yang et al., 2016 ). Autofagi mengisolasi materi seluler yang rusak dan mengirimkannya ke lisosom untuk didegradasi. Dengan cara ini, autofagi memperlambat penuaan biologis (Cassidy et al., 2020 ) dan merupakan efektor hilir CR dan IF pada model hewan (Hansen et al., 2008 ; Jia & Levine, 2007 ; Ulgherait et al., 2021 ). Autophagy juga menjaga kesehatan metabolisme dan melindungi terhadap resistensi insulin pada tikus obesitas (Lim et al., 2014 ).
Pembatasan nutrisi mengubah aliran autofagik (aliran dan degradasi limbah dalam jalur autofagi–lisosom) pada model hewan (Martinez-Lopez et al., 2017 ) tetapi belum diuji pada manusia karena kurangnya metodologi yang mengukur aliran autofagik fisiologis (Sargeant & Bensalem, 2021 ). Kami mengembangkan tes darah untuk mengukur aliran autofagik dalam sel mononuklear darah tepi (PBMC) dalam konteks darah manusia utuh (Bensalem et al., 2021 ). Dalam uji coba terkontrol acak, kami memeriksa puasa intermiten plus makan terbatas waktu (iTRE), dengan mengizinkan 30% kebutuhan energi untuk dikonsumsi sebelum tengah hari diikuti dengan periode puasa 20 jam pada tiga hari per minggu yang tidak berurutan dan membandingkannya dengan CR (kebutuhan energi 70%) dan perawatan standar (SC) (buklet penurunan berat badan). Hasil utama untuk studi ini telah dilaporkan di tempat lain: iTRE lebih unggul daripada CR dalam hal pengurangan area di bawah kurva glukosa pasca makan (AUC), trigliserida puasa dan asam lemak non-esterifikasi puasa (Teong et al., 2023 ). Dalam studi saat ini, kami menunjukkan bahwa pada 6 bulan, autophagy meningkat pada kelompok intervensi iTRE dibandingkan dengan kelompok SC ( P = 0,04, analisis post hoc ). Efek ini dapat didorong sebagian oleh penurunan autophagy yang diamati pada kelompok SC. Ini bermakna karena autophagy sangat penting untuk penuaan yang sehat (Cassidy et al., 2020 ; Sebti et al., 2023 ).
Metode
Persetujuan etis
Sub-studi penemuan yang telah ditentukan sebelumnya ini dimulai setelah studi induk [terdaftar di ClinicalTrials; pengenal NCT03689608, tercantum dalam ‘ukuran hasil lainnya,’ ‘Perubahan fluks autofagik (DIRECT-Fast4flux)’] dan menganalisis 121 partisipan yang mendaftar antara Mei 2019 dan Maret 2020 (Tabel 1 ). Alur partisipan melalui sub-studi ditunjukkan pada Gambar 1. Persetujuan etika protokol studi diperoleh dari Komite Etika Penelitian Manusia Jaringan Kesehatan Lokal Adelaide Tengah (HREC/18/CALHN/171) dan partisipan memberikan persetujuan tertulis. Studi ini dilakukan di Institut Penelitian Kesehatan dan Medis Australia Selatan (SAHMRI) oleh peneliti dari Universitas Adelaide dan SAHMRI. Komite pemantauan data dan keamanan independen memberikan pengawasan. Semua peraturan etika yang relevan dipatuhi. Studi ini sesuai dengan standar yang ditetapkan oleh Deklarasi Helsinki . Persetujuan etis untuk bahan manusia yang digunakan dalam Gambar 2 diperoleh dari Komite Etika Penelitian Manusia Universitas Adelaide (H-2021-154).
| Total | Bahasa Inggris | Bahasa Inggris | saya | |
|---|---|---|---|---|
| Usia – tahun | 58,3 ± 10,6 | 60,5 ± 11,6 | 58,3 ± 10,3 | 57,2 ± 10,4 |
| Perempuan, n (%) | 66 (54.5) | 10 (41.7) | 27 (58.7) | 29 (56.9) |
| Berat badan – kg | 99,0 ± 14,9 | 94,7 ± 13,1 | 100,5 ± 15,7 | 99,6 ± 14,8 |
| Indeks massa tubuh – kg/m 2 | 34,5 ± 4,4 | 33,5 ± 3,9 | 35,1 ± 4,7 | 34,5 ± 4,2 |
| Skor AUSDRISK | 17,8 ± 3,8 | 17,7 ± 4,5 | 17,9 ± 3,5 | 17,8 ± 3,7 |
| Massa lemak – kg | 43,4 ± 9,7 | 40,2 ± 8,4 | 45,3 ± 10,9 | 43,2 ± 8,9 |
| Tekanan darah sistolik – mmHg | 124,8 ± 15,6 | 126,7 ± 19,9 | 126,7 ± 15,1 | 122,2 ± 13,7 |
| Tekanan darah diastolik – mmHg | 80,1 ± 7,7 | 81,1 ± 9,7 | 80,2 ± 6,7 | 79,5 ± 7,6 |
| Kadar hs-CRP – mg/L ( N = 120) | 3,9 ± 6,6 | 3,1 ± 5,8 | 3,4 ± 4,7 | 4,7 ± 8,3 |
| Kolesterol total – mg/dL | 198,3 ± 43,9 | 209,1 ± 38,0 | 190,4 ± 44,7 | 200,3 ± 45,2 |
| Kadar HDL – mg/dL | 48,9 ± 12,3 | 48,8 ± 13,8 | 50,3 ± 12,5 | 47,6 ± 11,4 |
| LDL – mg/dL | 137,4 ± 43,1 | 148,4 ± 38,5 | 128,6 ± 45,0 | 140,1 ± 42,7 |
| Trigliserida mg/dL | 60,0 ± 37,7 | 59,3 ± 35,3 | 57,2 ± 45,2 | 62,8 ± 31,3 |
| Fluks autofagik: ΔLC3B-II – ng/mg protein/jam* | 299,3 ± 95,4 | 339,6 ± 137,2 | 298,3 ± 82,9 | 280,4 ± 76,0 |
Data ditampilkan sebagai mean ± SD. AUSDRISK, Australian Diabetes Risk Tool; hs-CRP, protein C-reaktif sensitivitas tinggi; HDL, kolesterol lipoprotein densitas tinggi; LDL, kolesterol lipoprotein densitas rendah. *N (fluks autofagik) = 114, SC (23), CR (44), iTRE (47).

Desain studi dan partisipan
Peserta didaftarkan dalam studi DIRECT, uji coba terkontrol acak sekuensial kelompok paralel berlabel terbuka, tiga lengan, yang melibatkan fase intervensi 6 bulan yang dilakukan antara 26 September 2018 dan 30 November 2021. Studi eksploratif fluks autofagik (DIRECT-Fast4flux) ini dilakukan pada sub-kohort yang terdiri dari 121 peserta. Sampel darah puasa dikumpulkan pada awal, 2 bulan, dan 6 bulan. Kriteria inklusi dan eksklusi utama untuk studi DIRECT adalah: berusia 35–75 tahun, fluktuasi berat badan ≤5% selama lebih dari 6 bulan sebelum masuk studi, skor ≥12 untuk Australian Type 2 Diabetes Risk Assessment Tool (AUSDRISK), tanpa diagnosis diabetes, dan tidak mengonsumsi obat yang memengaruhi metabolisme glukosa/manajemen berat badan. Protokol studi terperinci, termasuk kriteria inklusi/eksklusi lengkap, telah dilaporkan sebelumnya (Teong et al., 2020 ; Teong et al., 2021 ). Peserta diacak ke iTRE atau CR atau SC (rasio 2:2:1). Pengacakan dikelompokkan berdasarkan jenis kelamin (laki-laki; perempuan) dan AUSDRISK (skor ≥12–19; skor ≥20), menurut daftar pengacakan yang dibuat komputer yang disiapkan oleh seorang ahli statistik tanpa keterlibatan klinis dalam uji coba. Pemrosesan sampel untuk fluks autofagik dilakukan oleh peneliti yang tidak mengetahui kelompok intervensi. Fluks autofagik diukur pada awal (Bensalem et al., 2023 ), dan 2 dan 6 bulan intervensi.
Intervensi diet
Kelompok SC (kelompok kontrol) diberi pedoman gizi terkini dalam buklet tanpa konseling atau pengganti makanan. Kelompok iTRE diinstruksikan untuk mengonsumsi 30% dari kebutuhan energi dasar yang dihitung dalam menu yang ditentukan pada hari puasa, diikuti dengan puasa 20 jam dari tengah hari pada tiga hari yang tidak berurutan per minggu. Menu yang ditentukan termasuk dua pengganti makanan saat sarapan (~08.00 h) dan makan siang (~12.00 h) untuk membantu kepatuhan dan untuk memastikan asupan nutrisi yang cukup. Pada hari-hari tidak puasa, peserta iTRE diinstruksikan untuk mengonsumsi makanan pra-studi reguler mereka. Kelompok CR diresepkan pembatasan 30% dari kebutuhan energi dasar yang dihitung setiap hari dan termasuk satu pengganti makanan per hari untuk membantu kepatuhan dan untuk memastikan asupan nutrisi yang cukup. Semua kelompok menjalani kunjungan klinik yang identik dua minggu sekali selama periode intervensi 6 bulan. Semua peserta diinstruksikan untuk mempertahankan tingkat aktivitas fisik mereka yang biasa selama uji coba. Hanya kelompok iTRE dan CR yang diberikan konseling diet satu lawan satu. Sampel kunjungan titik waktu dua bulan tidak diprioritaskan untuk analisis selama tahap awal pandemi COVID19.
Hasil
Pengukuran yang digunakan dalam analisis akhir diambil dari sampel yang berbeda. Hasil utama dari studi DIRECT adalah perubahan AUC glukosa postprandial pada 6 bulan dan telah dipublikasikan di tempat lain (Teong et al., 2023 ). Glukosa darah diuji dengan metode heksokinase (Cobas Integra 400 Plus; Roche Diagnostics, Rotkreuz, Swiss). Tekanan darah diukur setelah istirahat duduk selama 10 menit. Massa lemak diukur dengan absorptiometri sinar-X energi ganda (Lunar Prodigy; GE Healthcare, Madison, WI, AS). Hemoglobin A1c darah lengkap, protein C-reaktif sensitivitas tinggi serum, kolesterol total plasma, kolesterol lipoprotein densitas tinggi, kolesterol lipoprotein densitas rendah, trigliserida, dan β-hidroksibutirat diukur menggunakan kit enzimatik yang tersedia secara komersial pada penganalisa klinis otomatis (Indiko Plus; ThermoFisher Scientific, Vantaa, Finlandia). Aktivitas plasma β-heksosaminidase diukur seperti yang dijelaskan sebelumnya (Leaback & Walker, 1961 ; Whyte et al., 2022 ). Total protein diukur menggunakan kit uji protein BCA mikro (ThermoFisher Scientific, Waltham, MA, AS; 23235). Dalam sub-studi ini – DIRECT-Fast4flux – kami menyajikan hasil eksploratif: perubahan fluks autofagik pada 2 dan 6 bulan, diukur menggunakan metode yang dijelaskan di bawah ini.
Pengukuran fluks autofagik dengan uji immunosorbent terkait enzim (ELISA)
Peserta tiba pukul 07.30 setelah berpuasa selama 12 jam dan sampel darah diambil. Persiapan sampel untuk pengukuran fluks autofagik telah dijelaskan sebelumnya (Bensalem et al., 2021 ). Darah yang dipuasakan dikumpulkan ke dalam tabung heparin litium (Greiner Bio-One, Kremsmünster, Austria; tabung Vacuette 9 mL heparin litium; 455084) dan dua alikuot 3 mL ditempatkan ke dalam tabung sentrifus kerucut 10 mL. Satu tabung diberi perlakuan dengan 150 µM klorokuin (CQ, klorokuin difosfat; Sigma Aldrich, St Louis, MO, AS; C6628) (3 µL larutan CQ 50 mM yang diencerkan dalam air steril per mililiter darah); tabung lainnya tetap tidak diberi perlakuan untuk bertindak sebagai kontrol. Kedua tabung diinkubasi pada suhu 37°C selama 60 menit dengan putaran pada pemutar tabung (ThermoFisher Scientific Tube Revolver; 88881001) pada 10 rpm. Setelah inkubasi, sampel darah segera dimasukkan ke dalam es dan disimpan di dalam es atau pada suhu 4°C selama sentrifugasi. Penyangga dingin digunakan untuk mencegah pergerakan vesikel selama pemrosesan lebih lanjut. Sampel kemudian diencerkan 1:1 dengan larutan penyangga fosfat Dulbecco dingin (DPBS, GIBCO, ThermoFisher Scientific; 14190250). PBMC diisolasi menggunakan Lymphoprep (4 mL, Stemcell Technologies, Vancouver, Kanada; 07811) yang diletakkan di bawah darah lengkap menggunakan kanula steril. Tabung disentrifugasi pada 4 °C selama 30 menit pada 800 g , dengan deselerasi ditetapkan ke 1. PBMC dikumpulkan dan dibuat hingga volume akhir 5 mL dalam DPBS dan disentrifugasi pada 600 g selama 10 menit pada 4 °C. Pelet sel disuspensikan kembali dalam 1 mL buffer lisis sel darah merah dingin (1×, BD Biosciences, Franklin Lakes, NJ, AS; 555899), diinkubasi di atas es selama 2 menit, kemudian dipeletkan dengan sentrifugasi pada 600 g selama 5 menit pada 4 °C. Pelet PBMC dicuci dengan resuspensi dalam 5 mL DPBS dingin dan dipeletkan lagi dengan sentrifugasi. Sel-sel yang dipeletkan disuspensikan kembali dalam 1 mL DPBS dingin dan dipindahkan ke tabung mikrocentrifuge 1,5 mL. Tabung ini disentrifugasi pada 2000 g selama 10 menit pada suhu 4°C. Supernatan dibuang dan pelet yang mengandung PBMC dibekukan dengan cepat pada es kering dan disimpan pada suhu -80°C hingga dilakukan analisis. Karena PBMC telah diinkubasi tanpa dan dengan CQ dalam konteks darah utuh, PBMC tidak perlu lagi hidup untuk pemrosesan selanjutnya dan karenanya tidak memerlukan media pembekuan.
PBMC dicairkan di atas es dan disuspensikan kembali dalam 0,05% saponin (Sigma Aldrich; SAE0073) dalam DPBS yang mengandung inhibitor protease dan fosfatase [2,5 mM natrium pirofosfat; 1 mM natrium ortovanadat; 1 mM β-gliserofosfat; Koktail Inhibitor Protease Bebas EDTA (Sigma-Aldrich; 4693132001)] dan diinkubasi pada suhu ruangan selama 5 menit dengan pengadukan lembut. Sampel kemudian disentrifugasi (4°C, 13.000 g , 5 menit). Cucian saponin secara lembut mempermeabilkan sel untuk menghilangkan protein terkait mikrotubulus 1 rantai ringan 3B-I (LC3B-I) tanpa mempengaruhi LC3B-II terkait membran (Gottlieb et al., 2015 ). Pelet dicuci dalam DPBS dingin, disentrifugasi seperti di atas, dan disuspensikan kembali dalam CST FastScan 1× Cell Extraction Buffer (Cell Signaling Technology, Danvers, MA, AS; 35172) dengan EDTA-free Protease Inhibitor Cocktail (Sigma-Aldrich; 4693132001). Suspensi sel kemudian disonikasi (20 detik x2 di atas es). Lisat sel disentrifugasi pada 16.000 g selama 5 menit pada suhu 4°C dan supernatan dikumpulkan. Total protein diukur menggunakan kit uji protein mikro-BCA (ThermoFisher Scientific; 23235).
Untuk menentukan konsentrasi sampel LC3B-II, 5 µg per sumur (diencerkan dalam CST FastScan 1× Cell Extraction Buffer) sampel dimasukkan dalam rangkap tiga pada FastScan Total LC3B ELISA Kit (Cell Signaling Technology, 35172). Kurva standar dibuat menggunakan LC3B manusia rekombinan (Abcam, Cambridge, MA, AS; ab103506) yang disiapkan dalam kisaran konsentrasi 0–4 ng/mL dalam 1× Cell Extraction Buffer. Kontrol positif kit ELISA juga disertakan untuk membantu perbandingan pelat ke pelat. Pelat ELISA diproses sesuai dengan petunjuk pabrik. Absorbansi setiap sumur diukur pada 450 nm menggunakan pembaca pelat Glomax (Promega, Madsion, WI, AS). Hasil kurva standar dibuat menggunakan kecocokan sigmoidal dan konsentrasi protein yang tidak diketahui dari setiap sampel diinterpolasi dan dilaporkan sebagai ng LC3B-II/mg protein total/jam. Setiap sampel dengan nilai rangkap tiga yang memberikan koefisien variasi (CV) > 10% diperiksa untuk outlier; outlier rangkap tiga yang jelas dihilangkan, dan setiap sampel akhir dengan CV > 15% dikecualikan. Jika peserta mengundurkan diri antara minggu ke-8 dan ke-24, hanya nilai dasar yang dianalisis melalui ELISA.
Fluks autofagik dihitung dengan cara berikut:
![]()
di mana ΔLC3B-II, fluks autofagik, adalah jumlah protein autofag LC3B-II yang didegradasi oleh lisosom dalam 1 jam, [LC3B-II + CQ] adalah jumlah LC3B-II yang ada di kumpulan PBMC setelah inkubasi darah utuh dengan penghambat lisosom CQ selama 1 jam dan [LC3BII − CQ] adalah jumlah dasar LC3B-II yang ada setelah inkubasi darah utuh saat CQ tidak ada.
Kultur sel dan penyuntingan gen berbasis CRISPR Cas9 untuk penghapusan MAP1LC3B
Vektor lentivirus CRISPR mamalia yang mengekspresikan Cas9 dan baik gRNA acak 5′-GTGTAGTTCGACCATTCGTG atau gRNA terhadap LC3B manusia 5′-CATCCAACCAAAATCCCGGT (pLV[CRISPR]-hCas9:T2A:Bsd-U6>hMAP1LC3B[gRNA#954]) dibeli dari Vectorbuilder (Neu-Isenburg, Jerman) dan ditransfeksi ke dalam sel HEK293T bersama dengan plasmid lentivirus psPAX2 (Addgene; 12260) dan pCMV-VSV-G (Addgene; 8454) menggunakan Lipofectamine 3000 (ThermoFisher Scientific; L3000015), sesuai dengan protokol pabrik. Supernatan virus dikumpulkan 48 jam setelah transfeksi, melewati filter 0,45 µm, dan ditambah dengan 8 µg/mL polibrena. Sel target stok SAHMRI HEK293T ditransduksi dengan supernatan virus selama 24 jam dan dibiarkan pulih selama 48 jam sebelum menjalani seleksi antibiotik menggunakan 6 µg/mL blastisidin selama 7 hari. Untuk menghasilkan lini sel monoklonal knockout (KO), sel-sel disortir ke dalam pelat 96-sumur pada satu sel per sumur pada BD FACSAria Fusion. Klon dibiarkan tumbuh selama 2–3 minggu sebelum dipindahkan secara berurutan ke pelat 24-, 12- dan 6-sumur. LC3B KO diverifikasi dengan western blotting sebelum digunakan dalam uji hilir. psPAX2 merupakan hadiah dari Didier Trono (plasmid Addgene 12260; http://n2t.net/addgene:12260 ; RRID:Addgene_12260 ). pCMV-VSV-G merupakan hadiah dari Bob Weinberg (plasmid Addgene 8454; http://n2t.net/addgene:8454 ; RRID:Addgene_8454 ).
Pendarahan Western
Konsentrasi protein dalam sampel ditentukan menggunakan uji BCA (ThermoFisher Scientific; 23235). Jumlah protein yang sama dielektroforesis melalui gel BOLT 4–12% (ThermoFisher Scientific; NW04122) pada 125 V selama 1–1,5 jam. Pemindahan protein dari gel ke membran PVDF yang diaktifkan metanol dilakukan pada 35 V selama 60–70 menit. Membran diinkubasi selama 1 jam pada suhu ruangan dalam buffer pemblokiran yang terdiri dari 5% susu skim dalam larutan penyangga Tris yang mengandung 0,1% Tween (TBST), dan diinkubasi semalam pada suhu 4°C dalam antibodi primer yang diencerkan dalam buffer pemblokiran (kelinci anti-LC3B, Cell Signaling Technology, Cat# 3868, RRID:AB_2137707 ; 1:1000; Novus, Cat# NB100-2220, RRID:AB_10003146 ; 1:1000). Jika diindikasikan, pewarnaan protein total dilakukan sebelum langkah pemblokiran menggunakan reagen pelabelan protein No-Stain (Invitrogen, Carlsbad, CA, AS; A44449) sesuai petunjuk pabrik pembuatnya. Keesokan harinya, membran dicuci tiga kali dalam TBST dan diinkubasi dengan antibodi sekunder terkonjugasi HRP (IgG antikelinci kambing, Merck, Darmstadt, Jerman, Cat# AP307P, RRID:AB_92641 ; 1:10.000). Membran dicuci, dikembangkan dengan substrat chemiluminescent (ThermoFisher; 34096 atau 34577) dan dicitrakan pada Fujifilm LAS4000.
Statistik dan reproduktifitas
Hasil dinilai menggunakan regresi linier efek campuran, disesuaikan dengan faktor dasar dan stratifikasi, dengan intersepsi acak per individu dan, jika sesuai, disesuaikan untuk penilaian (Bulan 2 vs. Bulan 6) dan interaksi berpasangan dengan kelompok perlakuan sebagai efek tetap; 121 orang dimasukkan dalam analisis, dan replikasi didefinisikan sebagai satu orang. Analisis post hoc dilakukan pada efek kelompok P < 0,2. Distribusi efek residual dan acak dinilai untuk memastikan bahwa asumsi distribusi model tidak dilanggar. Untuk kelengkapan, kami melaporkan penilaian post hoc perbedaan kelompok untuk fluks autofagik. R digunakan untuk pemrograman statistik (R v.4.0.5).
Untuk analisis eksploratori korelasi antara perubahan fluks autofagik (data dasar hingga 6 bulan) dan (1) data dasar, atau (2) perubahan berbagai parameter (data dasar hingga 6 bulan), digunakan uji Spearman. Kami menggunakan analisis kasus lengkap dan tidak ada data yang diperhitungkan. Analisis statistik dan visualisasi dilakukan menggunakan GraphPad PRISM (GraphPad Software, La Jolla, CA, AS). Peta panas korelasi dibuat menggunakan Microsoft Excel untuk Microsoft 365 (Microsoft Corp., Redmond, WA, AS). Gambar dibuat menggunakan Biorender.com dan Microsoft PowerPoint untuk Microsoft 365.
Hasil
Dalam kohort yang digunakan dalam studi ini, penurunan berat badan signifikan dalam iTRE dan CR versus SC pada 6 bulan (keduanya P < 0,001) (Tabel 2 ). Kami memvalidasi pengukuran fluks autofagik menggunakan pengobatan CQ (penghambat lisosomal) dari darah utuh dalam studi sebelumnya (Bensalem et al., 2021 ). Dalam studi saat ini kami mengukur fluks autofagik dengan mengobati pasangan sampel darah utuh hidup dengan atau tanpa CQ, menginkubasi selama 1 jam pada 37°C, mengisolasi PBMC, mencuci PBMC dengan saponin untuk menghilangkan LC3B-I sitosol yang larut dan mengukur kandungan LC3B-II dengan ELISA seperti yang dilakukan dalam studi sebelumnya (Bensalem et al., 2023 ).
| Perubahan dari garis dasar pada 6 bulan | Perbedaan antar kelompok vs. SC a | ||
|---|---|---|---|
| Rata-rata [95% CI] | Rata-rata [95% CI] | P | |
| Bahasa Inggris | -2,1 [-3,5, -0,6] | ||
| Bahasa Inggris | -6,7 [-7,8, -5,7] | -4,7 [-6,5, -2,8] | <0,001 |
| saya | -7,1 [-8,1, -6,2] | -5,1 [-6,8, -3,3] | <0,001 |
Perubahan berat badan: kg. Nilai p kelompok keseluruhan <0,001. Regresi linier berganda untuk perubahan berat badan antara awal dan 6 bulan: disesuaikan dengan jenis kelamin, skor AUSDRISK, dan nilai awal. CI = interval kepercayaan.
Mengukur fluks autofagi sangat penting untuk memahami proses dinamis autofagi. Inhibitor lisosom seperti CQ adalah alat utama untuk menilai fluks autofagi, karena menghambat degradasi lisosom pada autofagosom. Penghambatan ini memungkinkan peneliti untuk mengukur fluks autofagi melalui pendeteksian penumpukan protein autofagi seperti LC3B-II. Pengukuran akumulasi LC3B-II dengan adanya inhibitor lisosom, dan perhitungan fluks autofagi (menggunakan persamaan yang dijelaskan dalam Metode), merupakan gambaran sebenarnya dari autofagi; kadar protein dalam kondisi stabil seperti LC3B-II tidak berkorelasi dengan autofagi (Sargeant & Bensalem, 2021 ; Tanida et al., 2005 ). Meskipun inhibitor lisosomal telah digunakan untuk mengukur fluks autofagik selama beberapa dekade dalam sistem kultur sel (Klionsky et al., 2021 ), inhibitor ini baru-baru ini dioptimalkan untuk digunakan dalam darah manusia (Bensalem et al., 2021 ).
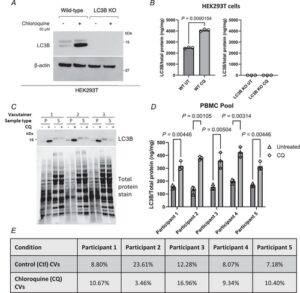
Kami memvalidasi spesifisitas ELISA LC3B menggunakan sel HEK293T di mana kami menyingkirkan LC3B menggunakan penyuntingan genom CRISPR-Cas9 (Gbr. 2A dan B ). ELISA untuk LC3B ini sangat spesifik. Kami juga menilai kinerja ekstraksi saponin dari pelet PBMC, menunjukkan bahwa LC3B-I yang larut hanya ada dalam fraksi yang larut dalam saponin, dan LC3B-II hanya ada dalam fraksi yang tidak larut dalam saponin (pelet sel) (Gbr. 2C ). Kami selanjutnya menganalisis variasi sistem pengukuran dengan memproses tiga wadah vakum berisi darah lengkap dari satu individu ( n = 5 individu) secara paralel dan menganalisis LC3B dengan ELISA (Gbr. 2D dan E ).
Peningkatan fluks autofagik terdeteksi pada kelompok iTRE dibandingkan dengan kelompok SC setelah 6 bulan saja (Gbr. 3 ; P = 0,04, Tabel 3 ). CR tampaknya meningkatkan fluks autofagik dibandingkan dengan SC pada 6 bulan, tetapi ini tidak signifikan secara statistik ( P = 0,38, Tabel 3 ). Tidak ada perbedaan antara CR dan iTRE pada 6 bulan. Tidak ada perbedaan yang diamati antara kelompok pada 2 bulan (Tabel 4 ).
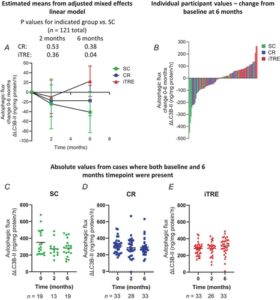
| Perubahan dari garis dasar pada 6 bulan | Perbedaan antar kelompok vs. SC a | ||
|---|---|---|---|
| Rata-rata [95% CI] | Rata-rata [95% CI] | P | |
| Bahasa Inggris | -41,06 [-83,42, 1,30] | ||
| Bahasa Inggris | -17,32 [-48,56, 13,92] | 24,58 [−30,08, 79,25] | 0.38 |
| saya | 22,65 [−8,60, 53,89] | 59.83 [4.59, 115.06] | 0,04* |
Fluks autofagik: ΔLC3B-II (ng LC3B-II/mg protein/jam). CI; interval kepercayaan. Nilai p kelompok keseluruhan = 0,15. Regresi linier berganda untuk perubahan fluks autofagik antara awal dan 6 bulan: disesuaikan dengan jenis kelamin, skor AUSDRISK, dan nilai awal.
| Perubahan dari baseline pada 2 bulan | Perbedaan antar kelompok vs. SC a | ||
|---|---|---|---|
| Rata-rata [95% CI] | Rata-rata [95% CI] | P | |
| Bahasa Inggris | -23,95 [-75,20, 27,30] | ||
| Bahasa Inggris | -17,52 [-50,10, 15,07] | 19,34 [−41,24, 79,92] | 0.53 |
| saya | -9,60 [-43,98, 24,78] | 28,75 [−32,67, 90,17] | 0.36 |
Fluks autofagik: ΔLC3B-II (ng LC3B-II/mg protein/jam). Regresi linier berganda untuk perubahan fluks autofagik antara awal dan 2 bulan: disesuaikan dengan jenis kelamin, skor AUSDRISK, dan nilai awal. CI = interval kepercayaan.
Untuk memahami faktor-faktor yang terkait dengan perubahan fluks autofagik, analisis korelasi eksploratori dijalankan antara perubahan fluks autofagik (dasar hingga 6 bulan) dan karakteristik dasar dalam analisis kasus lengkap ( n = 85 untuk perubahan fluks autofagik selama 6 bulan; n = 84–85 untuk karakteristik dasar) (Gbr. 4A, C–E ). Usia berkorelasi negatif dengan perubahan fluks autofagik di seluruh kelompok ( P = 0,0278). Analisis subkelompok menunjukkan bahwa hanya kelompok CR yang berkorelasi negatif antara usia dan perubahan fluks autofagik ( P = 0,0090). Korelasi positif ditemukan antara perubahan fluks autofagik dan trigliserida dasar di seluruh kelompok ( P = 0,0261).
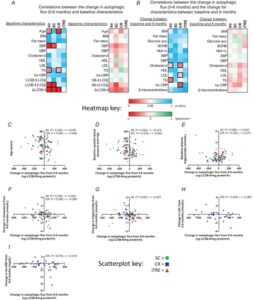
Kami juga menjalankan analisis korelasi eksploratori antara perubahan fluks autofagik dan perubahan titik akhir klinis (dasar hingga 6 bulan) ( n = 85 untuk perubahan fluks autofagik selama 6 bulan; n = 41–85 untuk perubahan karakteristik dari dasar hingga 6 bulan) (Gbr. 4B, F–I ). Hanya perubahan kolesterol dan trigliserida yang berkorelasi negatif dengan perubahan fluks autofagik di seluruh kohort ( masing-masing P = 0,0393 dan P = 0,0226). Perubahan AUC glukosa dan perubahan indeks massa tubuh tidak berkorelasi dengan perubahan fluks autofagik.
Studi penemuan yang telah ditentukan sebelumnya ini membandingkan efek iTRE dan CR pada fluks autofagi dalam PBMC dalam darah manusia utuh. iTRE selama 6 bulan meningkatkan fluks autofagi dibandingkan dengan SC. Namun, CR selama 6 bulan tidak menunjukkan perubahan yang signifikan secara statistik dalam autofagi dibandingkan dengan SC. Nilai r dan P (tidak disesuaikan) untuk hubungan yang signifikan dalam Gambar 4A dan B ditampilkan dalam diagram sebar pada Gambar 4C–I .
Diskusi
Banyak penelitian telah menganalisis pembatasan nutrisi dan dampaknya pada autofagi, tetapi mayoritas hanya menentukan kelimpahan protein dan transkrip terkait autofagi dan tidak secara langsung menilai aktivitas autofagi (Bagherniya et al., 2018 ). Temuan penelitian kami konsisten dengan sedikit yang telah secara langsung mengukur atau memodulasi autofagi pada model hewan. iTRE (puasa 20 jam setiap dua hari) memperpanjang umur pada Drosophila , dan ini bergantung pada autofagi (Ulgherait et al., 2021 ). Pada tikus, CR mencegah penurunan respons autofagi terkait usia (diukur dengan mengukur pelepasan valin) terhadap glukagon (Donati et al., 2008 ). Bahkan dalam penelitian tikus itu, IF mengungguli CR (dalam hal mencegah perubahan terkait usia) dengan mempertahankan respons autofagi terhadap efek positif glukagon dan efek represif insulin seiring bertambahnya usia. Perlu dicatat, tidak jelas bagaimana tikus diberi makan selama CR dalam penelitian tersebut. Jika makanan diberikan pada satu waktu dan dikonsumsi dengan cepat, pola makan ‘CR’ mungkin melibatkan puasa 20 jam setiap hari dan menyerupai sesuatu yang lebih mirip dengan IF.
Kami menemukan pengurangan fluks autofagik pada kelompok SC antara awal dan 6 bulan, yang mungkin sebagian bertanggung jawab atas efek yang diamati antara iTRE dan SC pada fluks autofagik. Penting untuk dicatat bahwa berat badan menurun pada ketiga kelompok selama intervensi 6 bulan. Kelompok SC tidak dicegah untuk menurunkan berat badan dan diberi saran statis dalam bentuk buklet penurunan berat badan tetapi tidak ada bantuan lebih lanjut. Kelompok SC kehilangan berat badan rata-rata 2,1 kg selama 6 bulan. Namun, korelasi eksploratori menunjukkan perubahan berat badan tidak berkorelasi dengan perubahan fluks autofagik dan tidak mengungkapkan penjelasan lebih lanjut mengapa fluks autofagik pada kelompok SC tampak menurun seiring waktu. Selain itu, sementara AUC glukosa ditingkatkan pada 6 bulan dalam hasil utama studi asli, efek ini hilang pada 18 bulan (Teong et al., 2023 ). Ada kemungkinan bahwa efek yang kami amati antara iTRE dan SC untuk autofagi pada 6 bulan juga akan berkurang pada 18 bulan. Kami tidak mengumpulkan sampel untuk menilai hal ini.
Kami mengeksplorasi korelasi antara perubahan fluks autofagik dan beberapa titik akhir klinis yang diukur dalam penelitian ini. Menariknya, baik perubahan berat badan maupun toleransi glukosa tidak berkorelasi dengan perubahan fluks autofagik. Namun, trigliserida tampaknya memiliki hubungan dengan autofagi: perubahan fluks autofagik dari awal hingga 6 bulan berkorelasi positif dengan trigliserida awal, dan negatif dengan perubahan trigliserida dari awal hingga 6 bulan. Konsisten dengan penelitian kami, trigliserida plasma yang tinggi menekan autofagi retina dengan menurunkan regulasi faktor transkripsi EB (Heckel et al., 2022 ), yang menghubungkan metabolisme lipid dan autofagi (Settembre et al., 2013 ). Meskipun korelasi diamati, korelasi tersebut bersifat eksploratif dan tidak dikoreksi untuk beberapa pengujian dan memerlukan penyelidikan lebih lanjut.
Keterbatasan dari penelitian ini adalah bahwa partisipan kelebihan berat badan hingga obesitas dan berisiko lebih tinggi terkena diabetes tipe 2, yang memengaruhi generalisasi temuan ke populasi lain. Lebih lanjut, kami hanya mengukur fluks autofagik dalam PBMC. Telah dibuktikan bahwa komposisi populasi PBMC dapat bervariasi antara partisipan dan sebagai respons terhadap intervensi nutrisi (Janssen et al., 2023 ), dan kami tidak menyelidiki parameter ini. Meskipun hal ini masih menjadi kemungkinan, penelitian serupa (puasa hari alternatif selama 6 bulan pada manusia) tidak menemukan perubahan signifikan dalam persentase kontribusi jenis sel berikut terhadap kumpulan leukosit: monosit, limfosit, sel B, sel T CD4 + dan sel T CD8 + (Stekovic et al., 2019 ). Keterbatasan lain yang terkait dengan metodologi penelitian adalah bahwa sampel dikumpulkan untuk analisis setelah puasa semalaman. Meskipun hal ini dapat mengaburkan hasil antara kelompok, kami tidak percaya hal ini mungkin terjadi. Kami baru-baru ini menyelesaikan penelitian yang mengukur autofagi dengan cara yang sama sebelum dan sesudah sarapan setelah puasa semalaman. Kami tidak melihat adanya perbedaan antara pengukuran autofagi yang dilakukan sebelum dan sesudah sarapan (Singh et al., 2024 ). Terakhir, meskipun kami melihat perbedaan signifikan antara SC dan iTRE berkenaan dengan perubahan autofagi dari awal hingga 6 bulan, kami tidak melihat perbedaan signifikan antara awal dan 6 bulan dalam kelompok iTRE; hal ini akan memberikan bukti yang lebih kuat tentang adanya efek.
Aspek-aspek bagaimana kita mengukur autofagi pada manusia juga memiliki keterbatasan. Penelitian terkini telah menunjukkan bahwa gangguan fungsi lisosomal menggunakan agen yang digunakan untuk mengukur fluks autofagi dapat menyebabkan Konjugasi ATG8 (LC3B adalah bagian dari keluarga protein ATG8) ke Membran Tunggal ( atau ‘CASM’) (Hooper et al., 2022 ) . Hal ini diperkirakan terjadi karena kemampuan CQ untuk mengganggu gradien proton (yang kita manfaatkan untuk mengganggu fungsi lisosomal) dapat memicu perekrutan mesin konjugasi LC3 dan menyebabkan lipidasi LC3B ke autofagosom. Tidak diketahui seberapa besar peningkatan LC3B-II yang kita lihat dalam darah utuh yang diobati dengan CQ disebabkan oleh CASM. Meskipun fluks autofagik yang ditentukan menggunakan pengobatan darah lengkap menggunakan bafilomisin A (yang tidak menghasilkan CASM, tetapi menghambat fungsi lisosomal) tampak mirip dengan fluks autofagik yang ditentukan oleh CQ (Bensalem et al., 2021 ), kami tidak mengetahui sejauh mana CASM menjelaskan perubahan fluks LC3B-II, dan dengan demikian apa yang kami anggap sebagai autofagi dalam penelitian saat ini. Jadi, jika CQ dapat menyebabkan CASM, mengapa kami menggunakannya untuk mengukur fluks autofagik? Alasan kami menggunakan CQ adalah karena ia larut dalam air, sedangkan bafilomisin A tidak, dan kendaraan yang digunakan untuk melarutkan bafilomisin sendiri mampu melisiskan sel darah merah dan menyebabkan autofagi. Selain keterbatasan yang telah kami bahas di atas, pekerjaan masa depan yang mengembangkan metodologi untuk pengukuran autofagi yang relevan secara fisiologis di jaringan lain diperlukan untuk menggeneralisasi temuan kami di luar PBMC.
Sebagai kesimpulan, studi intervensi ini mengukur fluks autofagi dalam sampel manusia yang secara fisiologis utuh. Ini adalah studi terbesar hingga saat ini yang telah mengukur autofagi manusia sebagai respons terhadap intervensi nutrisi. Studi penemuan yang telah ditetapkan sebelumnya ini menunjukkan perbedaan yang signifikan secara statistik untuk perubahan fluks autofagi dari awal hingga 6 bulan antara kelompok perawatan standar dan kelompok iTRE. Namun, perubahan tersebut tidak signifikan secara statistik antara awal dan 6 bulan dalam kelompok iTRE. Diperlukan lebih banyak penelitian untuk mengeksplorasi hubungan potensial antara autofagi dan iTRE.
