ABSTRAK
Perubahan global dan urbanisasi mengubah habitat satwa liar secara mendalam, mendorong hewan asli ke habitat baru sambil meningkatkan ko-kemunculan antara spesies asli dan invasif. Asosiasi inang-mikrobioma dibentuk oleh sifat inang dan fitur lingkungan, tetapi sedikit yang diketahui tentang plastisitasnya pada spesies asli dan invasif yang muncul bersamaan di seluruh gradien perkotaan-pedesaan. Di sini, kami mengeksplorasi mikrobioma usus dari empat spesies mamalia kecil simpatrik di sepanjang ekoton perkotaan-pedesaan di Kalimantan, salah satu wilayah hutan hujan tertua di planet ini yang mengalami perluasan perkotaan baru-baru ini. Identitas spesies inang adalah penentu terkuat dari komposisi mikrobioma, sementara penggunaan lahan dan kedekatan spasial membentuk kesamaan mikrobioma di dalam dan di antara ketiga spesies tikus. Tikus penghuni perkotaan Rattus rattus memiliki komposisi mikrobioma yang lebih mirip dengan tikus asli yang beradaptasi dengan perkotaan Sundamys muelleri ( tumpang tindih relung lingkungan terkuat R. rattus ), daripada dengan penghuni perkotaan R. norvegicus yang terkait erat . Tikus tanah yang tinggal di kota Suncus murinus menunjukkan mikrobioma yang paling berbeda. Mikrobioma R. norvegicus adalah yang paling sensitif terhadap intensitas penggunaan lahan, menunjukkan perubahan signifikan dalam komposisi dan kelimpahan bakteri di seluruh ekoton. Temuan kami menunjukkan bahwa tumpang tindih relung lingkungan antara spesies asli dan invasif mendorong mikrobioma usus yang serupa. Bahkan untuk penghuni kota omnivora dengan distribusi di seluruh dunia seperti R. norvegicus , mikrobioma usus dapat berubah melintasi gradien lingkungan skala halus. Penelitian di masa depan perlu memastikan apakah intensitas penggunaan lahan dapat menjadi kekuatan selektif yang kuat pada mikrobioma usus mamalia, yang memengaruhi cara spesies asli dan invasif mampu mengeksploitasi lingkungan baru.
1 Pendahuluan
Perubahan habitat dan perambahan yang disebabkan oleh manusia menghadirkan ancaman yang terus meningkat bagi hewan liar, yang memengaruhi lingkungan fisik dan biotik dan mengorbankan kesesuaian dan ketersediaan habitat (Alberti 2015 ; McKinney 2002 ; Otto 2018 ). Untuk menghindari kepunahan, spesies asli sering kali dipaksa untuk membatasi distribusinya ke habitat yang tersisa atau beradaptasi dengan lingkungan baru yang telah diantropisasi (di sini, didefinisikan sebagai adaptor perkotaan) (McKinney 2002 ; Otto 2018 ). Perluasan perkotaan juga memfasilitasi pengenalan dan pembentukan spesies penghuni perkotaan (Bradley dan Altizer 2007 ; Hassell et al. 2017 ). Ini termasuk spesies komensal, non-asli, dan invasif yang mampu tumbuh subur di lanskap yang sangat dimodifikasi dan sangat mudah beradaptasi dengan perubahan kondisi lingkungan (Borden dan Flory 2021 ; Hulme-Beaman et al. 2016 ). Akibatnya, perambahan habitat dan perluasan wilayah perkotaan kemungkinan besar mengakibatkan kemunculan bersamaan spesies asli yang beradaptasi dengan kota dan spesies non-asli yang tinggal di kota, yang mendorong perubahan komposisi komunitas dan menciptakan peluang kontak baru dalam dan antar spesies. Ekoton perkotaan-pedesaan menawarkan ‘laboratorium alam’ yang menarik untuk mendapatkan wawasan tentang kemunculan bersamaan spesies dengan riwayat hidup dan tingkat adaptasi yang berbeda terhadap lingkungan yang diantropisasi, termasuk asosiasinya dengan spesies simbiosis seperti parasit dan komunitas mikroba, yang secara signifikan memengaruhi kesehatan dan kelangsungan hidup mereka. Baik kondisi lingkungan maupun interaksi di antara spesies yang hidup berdampingan dapat memberikan tekanan selektif atau menawarkan peluang baru untuk pembentukan asosiasi spesies inang dengan parasit dan mikroba (Clark et al. 2018 ; Raulo et al. 2024 ; Teng et al. 2022 ). Oleh karena itu, mengeksplorasi plastisitas dalam asosiasi mikrobioma spesies asli dan invasif yang hidup berdampingan di seluruh ekoton habitat, menawarkan perspektif multi-inang tentang bagaimana kekuatan selektif (yaitu, kendala lingkungan dan sifat inang) dan peluang ekologis yang timbul dari peluang kontak baru di antara spesies inang dapat membentuk asosiasi inang-mikrobioma.
Mikrobioma usus hewan memainkan peran penting dalam menjaga kesehatan dan homeostasis inangnya (Mcfall-Ngai et al. 2013 ). Sementara gangguan signifikan dalam struktur dan keanekaragaman mikrobioma, yang dikenal sebagai disbiosis, dapat memiliki efek negatif pada kesehatan dan kebugaran hewan, plastisitas komposisi dan fungsional mikrobioma juga dapat berkontribusi pada kemampuan beradaptasi inang terhadap perubahan lingkungan (Alberdi et al. 2016 ). Memahami faktor-faktor yang dapat mengubah mikrobioma terkait inang, dan bagaimana mereka melakukannya, oleh karena itu dapat memberikan wawasan berharga tentang dampak dari kondisi lingkungan yang berbeda pada hewan dan kapasitas mereka untuk adaptasi. Secara umum, sejarah evolusi dan pola makan inang dianggap sebagai pendorong utama komposisi dan keanekaragaman mikrobioma usus, meskipun perdebatan seputar peran dan tingkat pengaruhnya masing-masing masih terbuka (Mallott dan Amato 2021 ; Youngblut et al. 2019 ). Filogeni inang telah banyak dilaporkan sebagai modulator utama komposisi mikrobioma usus pada mamalia (Brooks et al. 2016 ; de Jonge et al. 2022 ; Mazel et al. 2023 ). Selain itu, pergeseran pola makan utama selama evolusi dan radiasi mamalia kemungkinan telah membentuk mikrobioma usus, dan telah disarankan bahwa filogeni inang berhubungan dengan perolehan garis keturunan mikroba yang baru-baru ini bercabang, sementara pola makan inang berhubungan dengan hubungan dengan kelompok besar garis keturunan mikroba yang lebih kuno (Groussin et al. 2017 ). Spesialisasi pola makan yang kuat dapat meningkatkan koadaptasi inang-mikrobioma (Ley et al. 2008 ), sementara makan oportunistik pada jenis pola makan tertentu dapat meningkatkan atau mengurangi keanekaragaman mikrobioma dan mendukung taksa bakteri tertentu (Davidson et al. 2020 ; Li et al. 2023 ; Youngblut et al. 2019 ). Secara lebih luas, spesies inang yang menyadari relung ekologi, termasuk habitat pilihan, pola makan, serta interaksi intra dan interspesies di antara individu inang, dapat diharapkan membentuk variasi dalam asosiasi mikroba yang ditemukan pada spesies inang yang berbeda di lingkungan tertentu. Misalnya, perilaku sosial meningkatkan penyebaran mikroba antar individu, sementara berbagi lingkungan yang sama secara tidak langsung dapat memfasilitasi perpindahan mikroorganisme usus di antara spesies yang sama dan heterospesies (Raulo et al. 2024 ; Sarkar et al. 2020 ; Stothart et al. 2021 ; Teng et al. 2022 ).
Tekanan antropogenik yang secara drastis mengubah habitat lokal dan perakitan komunitas spesies inang dapat diperkirakan memiliki efek mendasar pada keanekaragaman dan komposisi mikrobioma usus. Studi yang berfokus pada spesies inang tunggal, misalnya, telah menunjukkan bahwa perubahan penggunaan lahan yang disebabkan oleh manusia, seperti hilangnya habitat, fragmentasi, dan urbanisasi, mengubah mikrobioma usus pada berbagai spesies vertebrata (Berlow et al. 2021 ; Fackelmann et al. 2021 ; Maraci et al. 2022 ; Stothart et al. 2019 ; Teyssier et al. 2018 ). Penelitian terbaru yang mengeksplorasi variasi mikrobioma dari beberapa spesies inang mamalia kecil selanjutnya menunjukkan bahwa kondisi lingkungan dapat memaksakan kekuatan selektif yang berbeda pada mikrobioma usus sesuai dengan persyaratan habitat inang dan luas relung lingkungan (Anders et al. 2022 ; Bouilloud et al. 2024 ; Heni et al. 2023 ). Namun, keragaman dan komposisi mikrobioma usus spesies inang asli dan invasif simpatrik yang dapat berkumpul menjadi komunitas baru di lingkungan antropogenik masih kurang dipahami.
Di sini, kami membahas variasi dalam keragaman dan komposisi mikrobioma usus dalam dan di antara spesies inang asli dan invasif simpatrik yang hidup berdampingan di seluruh ekoton perkotaan-pedesaan yang berkesinambungan. Untuk ini, kami menargetkan empat spesies mamalia kecil simpatrik di Kalimantan. Spesies ini adalah: satu tikus endemik di lingkungan hutan Sundaland (tikus Sunda raksasa Mueller Sundamys muelleri ) dan tiga spesies invasif/komensal utama yang berasal dari tempat lain (kemungkinan besar Semenanjung India, Aplin et al. 2011 ; Hutterer dan Tranier 1990 ) dan berhasil menyebar di lingkungan antropogenik Asia Tenggara, yaitu tikus hitam Rattus rattus (kompleks spesies), tikus Norwegia Rattus norvegicus , dan tikus rumah Asia Suncus murinus . Permulaan penebangan skala besar yang relatif baru di Borneo pada tahun 1970-an (Gaveau et al. 2014 ) telah menyebabkan perambahan lingkungan yang menawarkan kesempatan unik untuk mempelajari kemungkinan pergeseran dalam kemunculan spesies di seluruh ekoton dan konsekuensi potensial untuk asosiasi spesies dan interaksi biotik (Bordes et al. 2017 ; Wells et al. 2014 ; Wilcove et al. 2013 ). Sund. muelleri baru-baru ini dideskripsikan sebagai adaptor perkotaan, lebih menyukai lanskap alam yang murni tetapi juga sering ditemukan di ruang hijau pinggiran kota. Ketiga spesies invasif, pada gilirannya, dianggap sebagai penghuni perkotaan yang berbeda dalam kapasitas mereka untuk mengeksploitasi lingkungan yang dibentuk secara alami dan non-antropogenik (Blasdell et al. 2022 ; Wells et al. 2014 ). Oleh karena itu, kami bertujuan untuk mengeksplorasi sejauh mana keterkaitan filogenetik inang, intensitas penggunaan lahan (LUI), dan kedekatan spasial individu inang di seluruh ekoton dari hutan hingga daerah yang sangat urban memengaruhi komposisi dan keanekaragaman mikrobioma usus pada keempat spesies simpatrik. Kami berhipotesis bahwa identitas spesies inang akan memainkan peran utama dalam membentuk mikrobioma usus inang, dengan spesies yang lebih dekat hubungannya memiliki komposisi mikrobioma yang lebih mirip. Di antara ketiga spesies tikus, kami memperkirakan Sund. muelleri menunjukkan mikrobioma yang berbeda dibandingkan dengan dua spesies invasif Rattus yang sama . Namun, dengan mempertimbangkan potensi pengaruh ekoton perkotaan-pedesaan yang mendasarinya, yang mewakili gradien unik dari kesesuaian habitat dan berbagai tingkat tumpang tindih dalam pemanfaatan habitat yang terwujud di antara spesies inang (Wells et al. 2014), kami juga mengantisipasi bahwa tumpang tindih dalam penggunaan habitat tersebut dapat memengaruhi asosiasi mikrobioma multi-inang. Selain itu, kami memperkirakan bahwa ekoton perkotaan-pedesaan akan memengaruhi pergeseran dalam kumpulan mikrobioma di antara individu-individu dari spesies inang yang sama.
2 Bahan dan Metode
2.1 Sistem Studi dan Pengumpulan Sampel
Kami menganalisis 245 sampel feses individu dari empat mamalia kecil simpatrik yang ditangkap pada gradien perkotaan-pedesaan yang berkesinambungan di Kota Kinabalu (lat. 6.0° long. 116.1°), Kalimantan utara (Sabah, Malaysia), antara Maret 2012 dan Mei 2013 (Wells et al. 2014 ). Kota tersebut, yang telah meluas ke arah hutan hujan tropis di dekatnya dalam 50 tahun terakhir, dikelilingi oleh daerah pinggiran kota dan desa yang diselingi dengan hutan produksi dan hutan tua di dekatnya dari cagar biosfer Crocker Range. Hewan yang ditangkap tersebut merupakan empat spesies dari dua famili: tikus Sunda raksasa Muller asli Sundamys muelleri , tikus hitam Asia komensal Rattus rattus (kompleks spesies), dan tikus Norwegia komensal Rattus norvegicus , ketiganya termasuk dalam suku Rattini dalam famili Muridae (Pagès et al. 2016 ) dan tikus rumah Asia komensal Suncus murinus , dari famili Soricidae.
Untuk setiap lokasi penangkapan, koordinat geografis dan elevasi dicatat dengan perangkat GPS genggam (Garmin GPSmap62st, Olathe, AS). Kami mencatat cakupan proporsional dengan berbagai jenis tutupan lahan dalam radius 20 m di sekitar lokasi penangkapan, mengkategorikan dan memberi skor jenis tutupan lahan menurut peningkatan dampak manusia dan urbanisasi sebagai ‘hutan’ = 1, ‘pohon bera’ = 2, ‘rumput bera/pertanian/kebun’ = 3, ‘tanah perumahan’ = 4 dan ‘kompleks perumahan’ = 5 (Wells et al. 2014 ). Jenis tutupan lahan ‘tanah’, ‘tertutup’, dan ‘air’ diberi skor 3 karena sulitnya mengkategorikan intensitas penggunaan lahannya. Kami kemudian menghitung intensitas penggunaan lahan (LUI) dengan meringkas produk dari cakupan proporsional dan skor tutupan lahan untuk setiap lokasi penangkapan dan menskalakan vektor yang dihasilkan antara 0 dan 1.
Hewan yang ditangkap kemudian dipindahkan ke laboratorium lapangan bergerak terdekat untuk anestesi berikutnya melalui inhalasi dietil eter (tingkat anestesi) dan kemudian dikorbankan dengan dislokasi serviks (menurut pedoman oleh American Veterinary Medical Association, https://www.avma.org ). Spesies diidentifikasi berdasarkan karakter morfologi (Aplin et al. 2003 ; Carleton dan Musser 2005 ; Musser dan Carleton 2005 ). Sampel feses dikumpulkan dari usus besar yang dibedah, disimpan dalam etanol, dan dibekukan pada suhu -20°C.
Izin akses dan ekspor sumber daya hayati dikeluarkan oleh Pusat Keanekaragaman Hayati Sabah (JKM-MBS.1000–2/2[35], JKM-MBS.1000–2/2[63]); akses ke lokasi lapangan hutan disetujui oleh Taman Sabah dan pemilik lahan individu.
2.2 Ekstraksi DNA, Persiapan Perpustakaan, dan Pengurutan Berkapasitas Tinggi
DNA diekstraksi dari sampel feses (~50 mg) menggunakan kit Bakteri prepGEM (MicroGEM, Charlottesville, VA, AS), sesuai dengan petunjuk pabrik, dengan langkah pencucian awal tambahan menggunakan buffer pencucian prepGEM untuk meminimalkan potensi kontaminasi permukaan. Sampel dihomogenisasi menggunakan pemukulan manik-manik (manik keramik 1,4 mm, 3 × 30 detik menggunakan homogeniser Precellys 24).
Kami melakukan reaksi berantai polimerase (PCR) dua langkah yang menargetkan wilayah V4 dari gen 16S rRNA menggunakan urutan primer 515F dan 806R yang diperbarui (Apprill et al. 2015 ; Parada et al. 2016 ). Reaksi PCR pertama sebanyak 20 μL terdiri dari 2 μL DNA, 10 μL Platinum II Hot-Start PCR Master Mix (2X) (Thermo Fisher Scientific, Waltham, MA, AS), 0,4 μL primer maju dan 0,4 μL primer mundur, dan 7,2 μL air ultra-murni. Kondisi reaksi terdiri dari denaturasi awal pada suhu 95°C selama 3 menit, diikuti oleh 28 siklus 30 detik pada suhu 95°C, 30 detik pada suhu 55°C, dan 30 detik pada suhu 72°C, dan akhirnya 72°C selama 5 menit.
Selama PCR kedua, pengindeksan sampel dilakukan menggunakan Nextera XT Index Kit (Illumina Inc., San Diego, CA, AS), dalam reaksi 25 μL yang terdiri dari 2,5 μL DNA yang diperkuat dari PCR sebelumnya, 12,5 μL Platinum II Hot-Start PCR Master Mix (Thermo Fisher Scientific, Waltham, MA, AS), 1,25 μL setiap indeks, dan 10 μL air murni. Kondisi reaksi sama seperti di atas, tetapi dengan 8 siklus, bukan 28. Produk PCR dikumpulkan berdasarkan intensitas relatif pita gel agarosa, dibersihkan menggunakan AMPure XP beads kit (NEBNext sample purity beads, AS) sesuai dengan petunjuk pabrik, dan dikuantifikasi melalui qPCR menggunakan NEBNext Library Quant Kit untuk Illumina (Ipswich, MA, AS). Pustaka akhir dinormalisasi ke 4 nM dan diurutkan pada platform Illumina MiSeq (bacaan 300 bp berpasangan).
2.3 Bioinformatika
Pembacaan sekuens mentah ditetapkan ke dalam varian sekuens amplikon (ASV) menggunakan DADA2 (Callahan et al. 2016 ) dalam QIIME2 (versi 2023.2, Bolyen et al. 2019 ). Setelah pemeriksaan kualitas, sekuens mentah dipotong pada 240 bp (maju) dan 220 bp (mundur) dan dipangkas (terdepan 19 bp) untuk menghindari potensi kontaminasi adaptor, dihilangkan derau dan disaring untuk menghilangkan chimera. ASV diklasifikasikan secara taksonomi menggunakan pengklasifikasi Bayes naif yang dilatih pada basis data Silva (v138, Pruesse et al. 2007 ) dan pohon filogenetik dibangun menggunakan plugin filogeni QIIME2. Tabel taksonomi ASV dan tabel kelimpahan ASV yang dihasilkan oleh QIIME2 kemudian diimpor ke R versi 4.2.3 (Tim Inti R 2023 ) untuk analisis lebih lanjut. ASV yang tidak ditetapkan sebagai sekuens bakteri dihilangkan, demikian pula sekuens DNA mitokondria dan kloroplas. Setelah pemeriksaan tabel kelimpahan ASV, dua sampel yang memiliki sekuens 0 dan 1 dihilangkan. Kami kemudian menyaring ASV untuk mengecualikan artefak potensial dan ASV langka, hanya mempertahankan yang ada dalam ≥ 5% sampel dari spesies mana pun yang diamati sebagai inang untuk masing-masing ASV. Ini sesuai dengan ≥ 3 sampel dari Sund. muelleri , R. norvegicus , atau Sunc. murinus , atau ≥ 4 sampel untuk R. rattus . Akhirnya, kami mengecualikan sampel individual dengan kurang dari n = 4069 bacaan (ukuran perpustakaan minimum ditentukan berdasarkan tingkat saturasi yang dapat diterima dalam kurva rarefaksi keanekaragaman alfa). Hal ini menghasilkan kumpulan data sebanyak 236 sampel (58 Sund. muelleri , 74 R. rattus , 49 R. norvegicus , 55 Sunc. murinus ).
Pembacaan sekuens mentah telah disimpan di Arsip Nukleotida Eropa (Nomor akses PRJEB81284).
2.4 Analisis Statistik
Untuk memperhitungkan upaya pengurutan heterogen (Schloss 2024 ), kami menormalkan data ASV dengan penghalusan, dengan secara berulang mengambil sampel 100 subset acak dari n = 4069 pembacaan (sesuai dengan ukuran pustaka minimum) untuk setiap sampel individu host, untuk semua analisis statistik berdasarkan metrik keragaman alfa dan beta.
Untuk mengkarakterisasi keragaman mikrobioma alfa untuk setiap individu inang, kami menghitung kekayaan Chao1 sebagai estimasi kekayaan spesies bakteri relatif (Chao 1984 ) dan entropi Shannon sebagai estimasi keragaman spesies bakteri relatif (Shannon 1948 ). Kami menggunakan Model Linear Umum Gaussian (GLM) untuk mengeksplorasi variasi keragaman alfa individu dalam kaitannya dengan LUI untuk setiap spesies inang (dengan model terpisah untuk setiap spesies) dan untuk memperkirakan kekayaan dan keragaman spesies individu rata-rata yang diharapkan (menggunakan model tunggal dengan semua spesies). Secara praktis, kami secara iteratif menghitung metrik keragaman alfa (Chao1, entropi Shannon) dari subset ternormalisasi yang disebutkan di atas, menjalankan GLM, dan mengekstraksi mean dan SE dari estimasi intersep dan koefisien. Kami kemudian mengambil total 10.000 nilai ‘posterior’ dari estimasi ini dan SE yang sesuai (dari distribusi normal yang mendasarinya) dan melaporkan modus dan interval kredibel 95% (CI) sebagai hasil yang memperhitungkan ketidakpastian yang timbul dari prosedur rarefaction dan kemungkinan GLM. Kami menganggap CI yang tidak tumpang tindih dengan nol untuk mewakili ‘dampak signifikan’.
Kami mengkarakterisasi kesamaan berpasangan dalam kumpulan mikroba di antara individu inang dengan menghitung metrik keragaman beta Bray–Curtis (Bray dan Curtis 1957 ) dan UniFrac tertimbang (Lozupone dan Knight 2005 ). Kami kemudian menggunakan Generalised Dissimilarity Model (GDM) sebagai pendekatan regresi berbasis matriks (Ferrier et al. 2007 ; Mokany et al. 2022 ) untuk mengeksplorasi perubahan dalam metrik keragaman beta ini. Sebagai variabel penjelas, kami menyertakan keterkaitan filogenetik inang, yang dihitung sebagai jarak filogenetik berpasangan antara individu inang berdasarkan pohon filogenetik konsensus yang dihasilkan dari proyek vertlife.org , diakses pada Juni 2023 (Upham et al. 2019 ); LUI, yang diubah menjadi metrik ketidakmiripan selama pemasangan model; dan kedekatan spasial, dihitung sebagai jarak geodesik antara lokasi penjebakan. GDM menggunakan spline non-linier untuk menggambarkan bagaimana perubahan dalam variabel prediktor (yaitu, keterkaitan filogenetik inang, LUI, kedekatan spasial) memengaruhi kesamaan (yaitu, Bray–Curtis dan UniFrac tertimbang) antara sampel. Karena GDM yang digunakan dengan fungsi tautan eksponensial negatif yang mendasarinya mengasumsikan peningkatan monotonik dalam ketidakmiripan sehubungan dengan variabel prediktor, tinggi spline menunjukkan kepentingan relatif dari variabel prediktor (yaitu, jumlah total variasi komposisi yang terkait dengan variabel prediktor yang sedang dievaluasi), sementara bentuknya menunjukkan laju perubahan dalam ukuran keragaman beta di seluruh nilai prediktor, dengan kemiringan yang lebih curam menunjukkan variasi komposisi yang lebih tinggi pada titik data tertentu (Mokany et al. 2022 ). GDM dilakukan menggunakan paket R ‘gdm’ (Fitzpatrick et al. 2022 ), di mana kami menjalankan model yang mempertimbangkan ( gdm1 ) semua individu inang bersama-sama, ( gdm2 ) hanya tiga spesies tikus ( Sund. muelleri , R. rattus , R. norvegicus ), dan ( gdm3 ) setiap spesies tikus secara terpisah. Secara praktis, kami menghitung metrik keanekaragaman Bray–Curtis dan UniFrac tertimbang secara iteratif untuk 100 subset, menjalankan GDM, mengekstraksi estimasi partisi deviasi, dan menghitung mode ‘posterior’ dan 95% CI dari distribusi estimasi yang dihasilkan. Dari setiap GDM, kami juga mengekstraksi spline yang diestimasi untuk setiap variabel prediktor.
Kami melakukan analisis kesamaan (ANOSIM) di seluruh spesies inang dan kombinasi berpasangan tertentu untuk menyelidiki kesamaan dalam komposisi mikrobioma di antara spesies yang dipelajari, menggunakan fungsi ‘anosim’ dari paket ‘vegan’ (Martinez 2020 ). Kami menyelidiki dispersi keragaman beta dari kumpulan mikroba dalam spesies inang yang berbeda (homogenitas/varians dispersi jarak-ke-sentroide untuk setiap spesies inang) menggunakan fungsi ‘betadisper’ dari paket ‘vegan’ (Dixon 2003 ), dan perbedaan signifikan jujur Tukey (HSD) untuk menguji perbedaan berpasangan dalam dispersi beta di antara spesies inang. Selain itu, kami menguji hubungan antara dispersi keragaman beta (skor jarak-ke-sentroide) dan LUI secara terpisah untuk setiap spesies inang menggunakan Gaussian GLM.
Untuk memvisualisasikan variasi komposisi mikrobioma dalam dan di antara spesies inang, kami menggunakan penskalaan multidimensi non-metrik (NMDS) berdasarkan rata-rata Bray–Curtis dan ukuran UniFrac tertimbang.
Akhirnya, kami melakukan analisis kelimpahan diferensial ASV menggunakan Analysis of Composition of Microbiomes with Bias Corrections 2 (ANCOM- bc 2) (Lin dan Peddada 2020 , 2024 ) untuk menyelidiki bagaimana pergeseran komposisi mikroba memungkinkan kami melacak perubahan dalam kelimpahan relatif ASV dalam kaitannya dengan LUI dalam setiap spesies inang. Metode ini mencakup penyesuaian nilai- p untuk mengendalikan beberapa pengujian dan mengurangi tingkat penemuan palsu, serta analisis sensitivitas untuk meminimalkan positif palsu karena jumlah semu yang ditambahkan untuk menangani nilai nol. Kami melakukan ANCOM- bc 2 secara terpisah untuk setiap spesies inang untuk semua ASV dengan prevalensi > 10% pada spesies masing-masing. ASV didefinisikan sebagai berlimpah secara signifikan secara diferensial jika nilai- p yang disesuaikan < 0,05.
2.5 Keberadaan Spesies Inang di Ekosistem Perkotaan dan Pedesaan
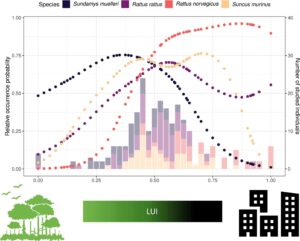
Bahasa Indonesia: Untuk menghasilkan indeks kesesuaian habitat berdasarkan apakah suatu spesies lebih mungkin muncul di lokasi dengan intensitas penggunaan lahan tertentu daripada yang lain di seluruh ekoton perkotaan-pedesaan, kami mengukur probabilitas kemunculan relatif setiap spesies fokus di sepanjang gradien perkotaan-pedesaan berdasarkan keberhasilan penangkapan; untuk ini kami melakukan regresi untuk setiap spesies catatan ada-tidaknya untuk 3538 lokasi perangkap (dari Wells et al. 2014 ) terhadap metrik LUI dan dengan istilah penghalusan spasial dari koordinat geografis berpasangan (untuk memperhitungkan autokorelasi spasial) dalam model aditif umum binomial (GAM) menggunakan paket ‘mgcv’ (Wood 2017 ). Hasil analisis ini menunjukkan bahwa ketiga spesies tikus muncul dalam pola yang berbeda di seluruh gradien LUI, dengan Sund. muelleri sebagian besar hadir di lingkungan yang lebih alami yang dicirikan oleh LUI rendah hingga sedang, R. rattus terjadi di sepanjang gradien tetapi paling sering di daerah LUI sedang, dan R. norvegicus sebagian besar ditemukan di daerah semi-perkotaan hingga sangat perkotaan, dicirikan oleh LUI rata-rata hingga tinggi. Tikus Sunc. murinus paling sering terjadi di daerah dengan LUI sedang hingga tinggi, sementara itu tidak mungkin terjadi di daerah alami atau sangat perkotaan. Singkatnya—seperti yang diuraikan dalam pekerjaan kami sebelumnya (Wells et al. 2014 ) – keempat spesies simpatrik menunjukkan preferensi habitat yang jelas berbeda, sementara juga menunjukkan beberapa tumpang tindih dalam penggunaan habitat dan terjadi dalam jarak yang dekat satu sama lain (Gambar 1 ). Karena metrik kesesuaian habitat individu dan nilai LUI terkait berkorelasi untuk R. norvegicus dan Sund. muelleri , kami hanya mempertimbangkan LUI dalam analisis.
3 Hasil
3.1 Komposisi Mikrobioma Feses
Sebanyak 1864 ASV bakteri unik diidentifikasi setelah pemeriksaan kualitas ( Sundamys muelleri = 1294 ASV, Rattus rattus = 1261 ASV, Rattus norvegicus = 850 ASV, Suncus murinus = 246 ASV; Gambar S1 ), yang mana 64 ditemukan di keempat spesies inang dan tidak ditemukan di semua 236 individu. Pada tingkat spesies, Sund. muelleri memiliki 990 ASV yang sama dengan R. rattus (> 76% dari jumlah ASV yang ditemukan di salah satu dari dua spesies ini) dan 491 ASV yang sama dengan R. norvegicus , sementara 577 ASV ditemukan di kedua spesies Rattus fokus (46% ASV ditemukan di R. rattus dan 68% ASV ditemukan di R. norvegicus ). Tikus Sunc. murinus memiliki 111 ASV yang sama dengan Sund. muelleri , 120 ASV dengan R. rattus , dan 118 ASV dengan R. norvegicus .
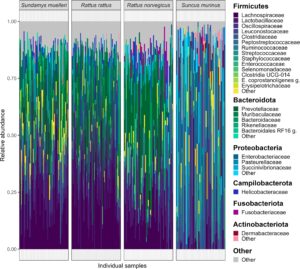
Tiga famili bakteri yang paling melimpah di ketiga spesies tikus adalah Lachnospiraceae , Prevotellaceae , dan Lactobacillaceae , dengan famili pertama paling melimpah di R. rattus dan Sund. muelleri , dan yang kedua paling melimpah di R. norvegicus , berturut-turut (Gambar 2 ; Gambar S2 ). Famili Muribaculaceae sebagian besar terdeteksi di R. rattus dan Sund. muelleri , sementara famili Peptostreptococcaceae dan Enterobacteriaceae sebagian besar ditemukan di R. norvegicus dan Sund. muelleri . Dari famili bakteri yang lebih jarang, Selenomonadaceae , Fusobacteriaceae , dan Succinivibrionaceae sebagian besar terdeteksi di R. norvegicus , sementara Rikenellaceae dan taksa Clostridia UCG-014 sebagian besar ditemukan di Sund. muelleri . Komposisi mikrobioma feses tikus tanah Sunc. murinus jelas berbeda dari ketiga spesies tikus, dengan famili Clostridiaceae dan Leuconostocaceae yang paling melimpah dari mikrobioma tikus tanah jarang ditemukan pada spesies tikus. Famili Dermabacteraceae, Erysipelotrichaceae, Staphyloccoccaceae , dan Pasteurellaceae yang lebih jarang ditemukan terutama dideteksi pada Sunc. murinus , sementara mereka hampir tidak ada (dengan kelimpahan relatif < 1% atau tidak terdeteksi) pada spesies tikus. Perbedaan yang jelas dalam komposisi mikrobioma spesies tikus dan Sunc. murinus pada tingkat famili juga diterjemahkan menjadi mikrobioma yang berbeda pada tingkat filum, dengan Bacteroidota sebagian besar ditemukan pada spesies tikus dan Proteobacteria paling melimpah di Sunc. murinus (Gambar 2 ; Gambar S2 ). Sunc. murinus juga menunjukkan varians spesifik spesies yang lebih tinggi dalam komposisi mikrobioma dibandingkan dengan tiga spesies tikus, dengan konsistensi yang lebih rendah dalam komposisi mikrobioma individu (Gambar 2 ).
3.2 Keanekaragaman Mikrobiota Feses Alfa dan Beta
Perkiraan kekayaan rata-rata tingkat individu dari kumpulan mikroba paling tinggi pada Sund. muelleri (Chao1: 129, 95% CI dari 119–137) dan R. rattus (Chao1: 142, 95% CI dari 133–150), sedikit lebih rendah pada R. norvegicus (Chao1: 103, 95% CI dari 93–114) dan terendah pada tikus tanah Sunc. murinus (Chao1: 33, 95% CI dari 24–43) (Gambar S3 ; Tabel S1 ). Demikian pula, kami menemukan keragaman Shannon rata-rata tertinggi pada Sund. muelleri dan R. rattus dan terendah pada Sunc. murinus (Gambar S3 ; Tabel S1 ). Kami tidak menemukan bukti bahwa variasi dalam keanekaragaman alfa di antara individu dari spesies inang mana pun berkorelasi dengan intensitas penggunaan lahan (LUI) (menurut CI tanpa tumpang tindih dari GLM; Gambar S3 ; Tabel S1 ).
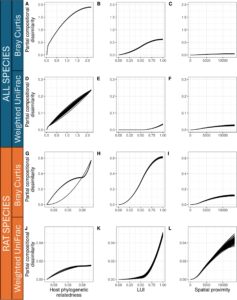
Bahasa Indonesia: Menjelajahi variasi dalam komposisi himpunan mikroba dalam dan di antara semua spesies inang, kesamaan himpunan sebagian besar dijelaskan oleh keterkaitan filogenetik inang (> 30% deviasi dijelaskan untuk metrik Bray–Curtis dan UniFrac tertimbang dalam GDM semua spesies ( gdm1 )) (Gambar 3 ; Tabel 1 ). Dalam gdm1 , LUI hanya menjelaskan sebagian kecil deviasi dalam kesamaan himpunan untuk metrik Bray–Curtis (1,44%) dan UniFrac tertimbang (0,29%) sebagai variabel respons. Dalam model ini, variasi Bray–Curtis sebagian besar terdistribusi secara merata di sepanjang gradien LUI dengan beberapa variasi minor dan nilai LUI yang lebih kecil dan dataran tinggi menuju nilai LUI yang besar di lingkungan yang sangat perkotaan, sedangkan variasi dalam UniFrac tertimbang dalam himpunan mikroba sebagian besar dikaitkan dengan nilai LUI yang relatif tinggi menurut spline fungsional yang dipasang (Gambar 3 ; Tabel 1 ). Hal ini menunjukkan bahwa variasi komunitas mikroba yang berkaitan dengan LUI yang lebih tinggi di lingkungan yang lebih perkotaan menunjukkan variasi komposisi filogenetik yang paling menonjol seperti yang ditangkap oleh metrik UniFrac tertimbang.
| Variabel prediktor | Semua spesies | Spesies tikus | ||
|---|---|---|---|---|
| Bray Curtis, seorang | Unifrac Tertimbang | Bray Curtis, seorang | Unifrac Tertimbang | |
| Keterkaitan filogenetik inang | 34.65 [34.45–34.80] | 31.28 [31.03–31.45] | 9.33 [9.22–9.47] | 0,38 [0,36–0,39] |
| LUI | 1.44 [1.40–1.47] | 0,29 [0,26–0,32] | 2.70 [2.62–2.77] | 1.13 [0,99–1,19] |
| Kedekatan spasial | angka 0 | angka 0 | 0,18 [0,16–0,20] | 0,64 [0,58–0,69] |
| Keterkaitan filogenetik inang ꓵ LUI | angka 0 | angka 0 | 1.35 [1.33–1.37] | angka 0 |
| Keterkaitan filogenetik inang ꓵ Kedekatan spasial | angka 0 | angka 0 | 0,06 [0,06–0,06] | angka 0 |
| LUI ꓵ Kedekatan spasial | angka 0 | angka 0 | 0,06 [0,06–0,06] | 0,21 [0,20–0,22] |
| Keterkaitan filogenetik inang ꓵ LUI ꓵ Kedekatan spasial | angka 0 | angka 0 | 0,06 [0,06–0,06] | angka 0 |
| Tidak dapat dijelaskan | 64.58 [64.44–64.79] | 68.71 [68.55–69.00] | 86.28 [86.10–86.37] | 97,74 [97,63–97,85] |
Dalam GDM untuk tiga spesies tikus saja ( gdm2 ), deviasi keseluruhan yang dijelaskan oleh kovariat lebih rendah dibandingkan dengan gdm1 (14% untuk Bray–Curtis dan 2% untuk UniFrac tertimbang). Namun, dalam model-model ini, jumlah total variasi komposisi dalam himpunan mikrobioma yang terkait dengan LUI untuk Bray–Curtis dan UniFrac tertimbang (Gambar 3H,K ) dan kedekatan spasial untuk UniFrac tertimbang (Gambar 3L ) memiliki kepentingan relatif yang serupa atau bahkan lebih tinggi daripada variasi komposisi yang dijelaskan oleh keterkaitan filogenetik inang (Gambar 3 , Tabel 1 ). Faktanya, LUI menjelaskan lebih banyak deviasi dalam model gdm2 dibandingkan dengan gdm1 (2,70% vs. 1,44% untuk Bray–Curtis dan 1,13% vs. 0,29% untuk UniFrac tertimbang). Hubungan fungsional antara LUI dan variasi komposisi dalam model GDM untuk spesies tikus saja ( gdm2 ) serupa dengan yang ada dalam model untuk semua spesies ( gdm1 ) di mana variasi Bray–Curtis sebagian besar konstan sepanjang gradien LUI dengan dataran tinggi menuju nilai LUI yang besar dan variasi dalam UniFrac tertimbang sebagian besar terkait dengan nilai LUI yang relatif tinggi (Gambar 3 ).
GDM spesifik spesies ( gdm3 ) mengungkapkan dampak nyata dari kontras penggunaan lahan terhadap kesamaan himpunan pada individu R. norvegicus saja (7% dan 3,5% deviasi dijelaskan untuk Bray–Curtis dan UniFrac tertimbang sebagai variabel respons; Tabel S2 ).
Sementara analisis kesamaan (ANOSIM) dan visualisasi penskalaan multidimensi (NMDS) (Gambar 4A,B ) mengonfirmasi bahwa komposisi himpunan mikroba paling mirip untuk individu inang dari spesies yang sama untuk ukuran Bray–Curtis dan UniFrac tertimbang (Bray–Curtis: ANOSIM: nilai R = 0,70, p < 0,001; UniFrac tertimbang: ANOSIM: nilai R = 0,49, p < 0,001), ada tumpang tindih yang jelas dalam komposisi himpunan pada individu Sund. muelleri dan R. rattus dan, pada tingkat yang lebih rendah, juga dalam himpunan dari pasangan spesies inang lainnya. Kesamaan dalam hal komposisi mikrobioma antara kedua spesies ini dikuatkan oleh ANOSIM berpasangan, yang menunjukkan nilai R terkecil antara Sund. muelleri dan R. rattus dibandingkan dengan pasangan spesies inang lainnya (Tabel S3 ). Untuk kedua ukuran keragaman beta, Sunc. Kumpulan mikrobioma murinus jelas berbeda dari ketiga spesies tikus, dengan R. norvegicus sebagai spesies tikus terdekat dalam kedua kasus menurut hasil ANOSIM (Gambar 4A,B ; Tabel S3 ).
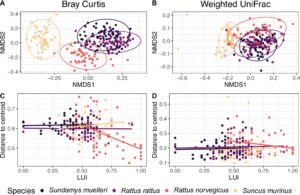
Dispersi keragaman beta dari kumpulan mikroba untuk Bray–Curtis menunjukkan jarak rata-rata yang jauh lebih rendah dari centroid di R. norvegicus dibandingkan dengan tiga spesies inang lainnya (PERMDISP: df: 3, nilai F : 10,14, p : 0,001; Gambar S4 ; Tabel S4 ). Namun, dispersi keragaman beta R. norvegicus juga dicirikan oleh sejumlah individu yang menyebar paling kuat dari centroid dibandingkan dengan dispersi kumpulan yang terdistribusi lebih homogen di antara individu spesies inang lainnya (Gambar S4 ). Dispersi ini (kumpulan Bray–Curtis dari R. norvegicus ) menurun dengan meningkatnya LUI (GLM pada jarak PERMDISP ke centroid dan LUI, β = −0,24, SE = 0,07, p < 0,01), yang menunjukkan bahwa individu inang R. norvegicus di lingkungan yang kurang urban memiliki kumpulan mikroba yang paling berbeda (Gambar 4C ; Tabel S5 ). Pola ini tidak diamati untuk UniFrac tertimbang, karena kami tidak menemukan hubungan antara dispersi dari centroid dan LUI dan dispersi UniFrac tertimbang dari komposisi kumpulan di R. norvegicus tidak berbeda secara signifikan dari yang diukur untuk kumpulan di tiga spesies inang lainnya untuk metrik ini (Gambar 4D ; Tabel S5 ).
3.3 Pergeseran Kelimpahan Relatif ASV di Ekosistem Perkotaan dan Pedesaan
LUI secara signifikan memengaruhi kelimpahan relatif 83 ASV (dari 946 ASV dengan prevalensi spesifik spesies > 10%) pada empat spesies mamalia kecil, dengan ASV yang ditetapkan pada 30 famili bakteri yang berbeda (ANCOM- bc 2, adj p < 0,05; Tabel S6 ). Jumlah terbesar ASV yang berlimpah secara berbeda terkait dengan LUI ditemukan pada R. norvegicus dengan 73 ASV, dibandingkan dengan 8 ASV pada Sunc. murinus dan 3 pada Sund. muelleri . Kami tidak menemukan bukti adanya variasi ASV tersebut pada R. rattus .
Dalam R. norvegicus , jumlah tertinggi ASV yang berlimpah secara diferensial dilaporkan untuk famili bakteri Lachnospiraceae (11 ASV), Bacteroidaceae (9 ASV), dan Prevotellaceae (8 ASV). Dari 73 ASV yang berlimpah secara diferensial ini, 43 (59%) menunjukkan penurunan dalam kelimpahan relatif mereka dengan LUI yang lebih tinggi (ANCOM- bc 2, adj p < 0,05; Tabel S6 ). Sebagian besar ASV ini berasal dari famili Lachnospiraceae (9/11), Oscillospiraceae (4/5), Prevotellaceae (6/8), Muribaculaceae (5/5), dan Bacteroidaceae (6/9) (Gambar 5 ). Dalam Sund. muelleri , Clostridium perfringens dilaporkan lebih tinggi kelimpahannya di lingkungan yang lebih urban, sementara dua ASV lain yang berbeda kelimpahannya yang ditemukan pada spesies ini secara signifikan kurang berlimpah dengan LUI yang lebih tinggi (ANCOM- bc 2, adj p < 0,05; Gambar 5 ; Tabel S6 ). Dalam Sunc. murinus , Clostridium baratii dan tiga ASV lain lebih berlimpah di lingkungan yang lebih urban, sementara 4 ASV menurun dalam kelimpahan relatifnya dengan LUI yang lebih tinggi (ANCOM- bc 2, adj p < 0,05; Gambar 5 ; Tabel S6 ). Romboutsia spp. adalah satu-satunya ASV yang ditemukan secara berbeda berlimpah dalam dua spesies inang yang berbeda, R. norvegicus dan Sunc. murinus , yang mencerminkan dalam kedua kasus efek positif LUI.
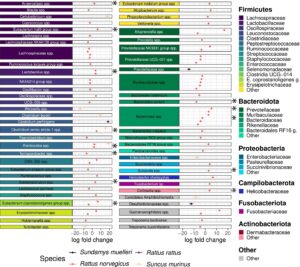
Dari 83 ASV yang berkelimpahan secara diferensial ini, 13 lolos uji sensitivitas untuk penambahan jumlah semu, yang semuanya termasuk dalam R. norvegicus : Anaerostipes spp., Eubacterium halii group spp., Lactobacillus spp., Clostridium sensu stricto 1 spp., Romboutsia spp., Subdoligranulum spp., Bacteroides spp., Sutterella spp., dan Collinsella spp. berasosiasi positif dengan LUI (kelimpahan lebih tinggi dengan LUI lebih tinggi), sedangkan Terrisporobacter spp., Eubacterium coprostanoligenes group spp., Bacteroides sartorii , dan Bacteroides spp. berasosiasi negatif dengan LUI (kelimpahan lebih rendah dengan LUI lebih tinggi) (ANCOM- bc 2, adj p < 0,05, ss = TRUE; Tabel S6 ).
4 Diskusi
Memahami pola dan proses yang membentuk komunitas mikroba yang berkaitan dengan spesies hewan yang mengeksploitasi lanskap yang dimodifikasi dan diurbanisasi dapat mengisi beberapa kesenjangan pengetahuan penting tentang bagaimana spesies asli tangguh terhadap perubahan habitat dan spesies komensal yang merambah habitat yang dimodifikasi.
Di sini, kami mengeksplorasi komposisi mikrobioma usus dari empat spesies mamalia kecil simpatrik di seluruh ekoton perkotaan-pedesaan di Kalimantan dan menunjukkan bahwa meskipun terdapat mikrobioma yang berbeda di antara semua spesies inang, tikus hutan asli Sundamys muelleri , yang menempati habitat alami dan pinggiran kota sebagai adaptor perkotaan, dan tikus komensal Rattus rattus , yang merupakan penghuni perkotaan tetapi mampu mengeksploitasi lingkungan pinggiran kota dan semi-alami, menunjukkan kesamaan tertinggi dalam mikrobiota. Kami selanjutnya menunjukkan bahwa kelimpahan relatif taksa bakteri tertentu berkorelasi dengan intensitas penggunaan lahan (LUI), dengan demikian perubahan terkuat dalam mikrobiota dalam kaitannya dengan LUI ditemukan pada tikus komensal penghuni perkotaan Rattus norvegicus , yang memiliki kapasitas terbatas untuk menjelajahi daerah pinggiran kota dan pedesaan dengan intensitas penggunaan lahan sedang hingga rendah di area studi kami. Temuan kami mengungkapkan sinyal filogenetik yang kuat ketika membandingkan individu dari spesies inang yang berbeda, sementara kondisi habitat yang mendasarinya memainkan peran penting di antara spesies yang berkerabat dekat. Hasil-hasil ini memberikan beberapa bukti pertama bahwa peluang ekologis, yang mungkin muncul dari kemunculan bersamaan dan tumpang tindih relung lingkungan antara spesies asli dan invasif, dapat memfasilitasi kesamaan dalam mikrobioma usus, di tengah pemaksaan lingkungan sebagaimana tercermin dalam dampak intensitas penggunaan lahan pada kelimpahan ASV tertentu.
4.1 Fitur Biologis Inang dan Tumpang Tindih Relung Berkorelasi dengan Hubungan Inang-Mikrobioma
Identitas spesies inang merupakan faktor terkuat yang membentuk mikrobioma dari empat spesies mamalia kecil yang diteliti. Secara khusus, kami menemukan bahwa komunitas bakteri tikus tanah Suncus murinus jelas berbeda dari ketiga spesies tikus ( Sund. muelleri , R. rattus , dan R. norvegicus ), tetapi di antara spesies terakhir ini, kami menemukan kesamaan terkuat dalam komunitas mikroba antara Sund. muelleri dan R. rattus daripada dua spesies Rattus yang sama . Oleh karena itu, hasil kami kontras dengan pola yang umum ditemukan dari spesies mamalia yang berkerabat dekat yang memiliki mikrobioma usus yang paling mirip (Amato et al. 2019 ; Heni et al. 2023 ; Kartzinel et al. 2019 ), sementara itu konsisten dengan penelitian lain pada mamalia kecil yang melaporkan efek filogeni inang yang paling kuat pada komposisi mikrobioma ketika membandingkan spesies inang yang berkerabat jauh dan efek yang jauh lebih lemah di dekat ujung filogeni (Brown et al. 2023 ; Knowles et al. 2019 ). Filogeni memengaruhi mikrobioma inang dengan membentuk fisiologi inang, termasuk fungsi sistem imun dan morfofisiologi usus. Faktor-faktor ini memengaruhi seleksi dan diversifikasi mikroba, yang selanjutnya dimodulasi oleh pola makan, serta transmisi mikroba vertikal dan horizontal (Mallott dan Amato 2021 ; Maritan et al. 2024 ). Mikrobiota feses yang jelas berbeda antara tikus tanah dan tikus yang diteliti serta kekayaan spesies yang lebih rendah pada tikus tanah sesuai dengan harapan kami berkenaan dengan taksonomi, tetapi juga pola makan dan morfologi usus inang. Tikus tanah Sunc. murinus adalah spesies pemakan serangga, biasanya memiliki saluran pencernaan yang lebih pendek dan lebih sederhana dibandingkan dengan spesies omnivora (Boonzaier et al. 2013 ; Shinohara et al. 2019 ). Perbedaan antara mikrobioma usus mamalia pemakan serangga versus omnivora jarang diselidiki dalam studi perbandingan hingga saat ini. Keragaman mikrobioma yang lebih rendah pada pemakan serangga dibandingkan dengan omnivora simpatrik juga telah diamati pada primata dari famili Strepsirrhines (Bornbusch et al. 2019 , 2022 ) dan pada tikus pemakan serangga Crocidura russula dibandingkan dengan tikus omnivora Apodemus sylvaticus (Koziol et al. 2023 ), sedangkan perbedaan tersebut tidak ditemukan di antara hewan pengerat gurun simpatrik (Kohl et al. 2022 ).). Secara lebih umum, jika kita menganggap insektivora terspesialisasi ke arah rentang diet yang lebih sempit daripada hewan pengerat omnivora, hasil kami selaras dengan penelitian yang menunjukkan bahwa karnivora memiliki mikrobioma yang kurang beragam dibandingkan dengan omnivora dan herbivora (Ley et al. 2008 ; Zoelzer et al. 2021 ). Famili bakteri Lachnospiraceae , Prevotellaceae , dan Bacteroidaceae , yang dominan pada tikus dalam penelitian ini, tidak hanya dilaporkan mendominasi pada hewan pengerat lain (Gu et al. 2013 ) tetapi juga terdiri dari anggota mikroba inti dari fermentasi usus belakang yang besar (O’ Donnell et al. 2017 ). Di sisi lain, famili bakteri simbiosis dominan tikus tanah, yaitu Clostridiaceae , Enterobacteriaceae , dan Peptostreptococcaceae, dilaporkan lebih umum ditemukan pada karnivora dibandingkan pada omnivora dan herbivora (de Jonge et al., 2022 ; Zoelzer et al., 2021 ).
Mengingat pengaruh filogeni yang terbatas pada mikrobioma spesies tikus dan dampak kuat dari diet pada komposisi mikrobioma yang diamati dalam banyak studi perbandingan (Kartzinel et al. 2019 ; Ley et al. 2008 ), akan menarik untuk menganalisis bagaimana diet spesies tikus fokus kita bervariasi di antara spesies dan juga ekoton perkotaan-pedesaan. Sayangnya, saat ini kami tidak memiliki rincian tentang diet dan variasi diet dari ketiga spesies tikus ini. Sebagai spesies omnivora, seseorang dapat mengharapkan beberapa makan oportunistik pada berbagai jenis makanan untuk ketiga spesies tikus, sementara di seluruh gradien perkotaan-pinggiran kota, sumber makanan yang tersedia kemungkinan bergeser dari produk yang lebih alami ke makanan olahan yang berasal dari manusia dan barang-barang limbah organik, termasuk yang berasal dari restoran dan pasar lokal. Alternatifnya, pertukaran mikroba dengan lingkungan adalah jalur lain yang melaluinya mikroorganisme usus dapat menjajah inang, dan tumpang tindih penggunaan habitat di antara spesies inang telah dikaitkan dengan mikrobioma usus yang lebih mirip pada manusia dan mamalia lain (Knowles et al. 2019 ; Raulo et al. 2024 ; Rothschild et al. 2018 ; Teng et al. 2022 ). Selain itu, interaksi sosial, baik di dalam maupun di antara spesies inang, dapat lebih meningkatkan penyebaran mikroba di antara individu, memengaruhi komposisi mikrobioma yang terkait dengan inang dan meningkatkan atau menurunkan kesamaan mikrobioma di antara individu inang yang lebih atau kurang terhubung (Raulo et al. 2024 ; Sarkar et al. 2020 ; Stothart et al. 2021 ). Di seluruh ekoton perkotaan-pedesaan yang diteliti, Sund. muelleri dan R. rattus keduanya ditemukan mengeksploitasi habitat dengan intensitas penggunaan lahan menengah, yang sesuai dengan petak vegetasi pinggiran kota dengan beberapa tutupan pohon atau semak dan perumahan di dekatnya. Di Borneo dan tempat lain dalam jangkauan geografisnya, Sund. muelleri sering tercatat di lingkungan hutan yang masih asli dan telah ditebang (Wells et al. 2007 ), sementara itu baru-baru ini ditemukan juga tumbuh subur di vegetasi pinggiran kota sebagai adaptasi perkotaan (Blasdell et al. 2022 ; Wells et al. 2014 ). R. rattus , sebagai spesies komensal, pada gilirannya, sangat beradaptasi dengan kondisi perkotaan di mana ia berpotensi juga tumpang tindih dalam penggunaan habitat dengan R. norvegicus ; namun, ia juga mampu mengeksploitasi vegetasi alami dan bahkan hutan di dekat infrastruktur manusia (Loveridge et al. 2016 ; Wells et al. 2006 ). R. norvegicus, di sisi lain, sebagian besar dilaporkan di daerah perkotaan atau daerah pinggiran kota yang ditumbuhi tanaman dekat aliran sungai atau saluran pembuangan limbah dan infrastruktur perkotaan di daerah studi kami (Wells et al. 2014 ). Di tempat lain, R. norvegicus juga dilaporkan mendapat manfaat dari sistem pembuangan limbah atau habitat dan kondisi tanah yang memungkinkan penggalian sistem penggalian yang cukup besar untuk koloni mereka (Feng dan Himsworth 2014 ), yang menunjukkan bahwa fitur habitat yang terkait dengan koloni yang berlindung mungkin merupakan faktor penghambat dalam mengeksploitasi lingkungan baru seperti halnya makanan.
Tampaknya, dengan mikrobioma yang lebih mirip ditemukan pada spesies tikus yang berkerabat lebih jauh Sund . muelleri dan R. rattus , ko-evolusi dan ko-spesiesiasi yang kuat di antara inang dan mikrobiota terkait tidak dapat menjadi satu-satunya kekuatan pendorong yang bekerja (Groussin et al. 2020 ; Mazel et al. 2023 ). Temuan kami menunjukkan bahwa fitur biologis inang dan beberapa aspek tumpang tindih relung (mungkin berbagi pola makan atau paparan lingkungan) dapat secara sinergis mendorong pola berbagi mikrobioma yang diamati.
4.2 Intensitas Penggunaan Lahan Paling Kuat Mempengaruhi Mikrobioma pada Rattus norvegicus
Dengan meneliti perubahan mikrobioma melintasi gradien penggunaan lahan berkelanjutan dari habitat perkotaan ke hutan, kami menemukan beberapa bukti bahwa intensitas penggunaan lahan (LUI) dikaitkan dengan perubahan komposisi mikrobioma dan kelimpahan relatif ASV pada spesies mamalia kecil yang dianalisis.
Anehnya, meskipun R. norvegicus merupakan penghuni kota dengan distribusi hampir di seluruh dunia, komposisi mikrobiomanya menunjukkan hubungan terkuat dengan intensitas penggunaan lahan, dengan komposisi mikrobioma yang relatif homogen pada individu yang memanfaatkan lingkungan kota dan mikrobioma yang lebih berbeda (tersebar dari ‘rata-rata’ menurut variasi komposisi Bray–Curtis) pada individu yang memanfaatkan lingkungan yang kurang urban. Lanskap makanan mendasar yang mungkin relevan bagi R. norvegicus di area studi kami rumit dan saat ini belum sepenuhnya dipahami. Lingkungan kota tempat spesies ini terperangkap meliputi pasar makanan regional serta restoran di dekatnya dan kanalisasi dan drainase kota. Karena spesies tikus ini tidak mungkin muncul di habitat alami di Kalimantan, kami memperkirakan bahwa individu di lingkungan yang kurang urban akan tetap memanfaatkan makanan serupa, meskipun dalam jumlah yang lebih sedikit karena lebih sedikit penjual makanan dan kompleks perumahan. Selain itu, mereka mungkin perlu meningkatkan asupan makanan yang bersumber dari alam sehingga menghasilkan pola makan yang lebih heterogen. Skenario semacam itu dapat menjelaskan perbedaan yang lebih kuat dalam komposisi mikrobioma pada individu yang ditangkap di daerah yang kurang urban dan mikrobioma yang lebih homogen pada individu yang ditangkap di daerah yang paling urban. Mikrobioma yang lebih homogen di daerah yang lebih urban juga ditemukan di sarang burung (Maraci et al. 2022 ), mikrobioma kulit amfibi (Zhou et al. 2023 ) dan bahkan komunitas mikroba tanah perkotaan (Delgado-Baquerizo et al. 2021 ) yang menunjukkan bahwa homogenisasi komunitas mikroba perkotaan merupakan fenomena umum.
R. norvegicus juga menampilkan jumlah ASV yang berlimpah secara diferensial tertinggi dalam kaitannya dengan LUI. Secara khusus, kelimpahan relatif berbagai ASV dari filum Bacteroidota , khususnya famili Prevotellaceae , dan famili Lachnospiraceae menurun secara signifikan pada individu yang ditangkap di lingkungan yang lebih perkotaan. Taksa pendegradasi serat ini sebelumnya telah dilaporkan secara signifikan kurang berlimpah pada manusia dan tikus yang mengonsumsi makanan rendah serat dan tinggi lemak (Bailén et al. 2020 ; De Filippo et al. 2010 ; Pasolli et al. 2019 ; Velázquez et al. 2019 ) dan pada primata non-manusia yang terpapar aktivitas antropogenik dan limbah makanan manusia (Moy et al. 2023 ; Wasimuddin et al. 2022 ). Selain itu, kami menemukan kelimpahan relatif Treponema berlinense dan Treponema succinifaciens dari famili Spirochetaceae berkurang secara signifikan pada individu yang terjebak di daerah perkotaan. Sementara taksa dari famili ini secara umum diasumsikan berkurang kelimpahannya pada populasi manusia yang telah terindustrialisasi (De Filippo et al. 2010 ; Pasolli et al. 2019 ), dua spesies Treponema yang kami temukan di R. norvegicus komensal telah dilaporkan sebelumnya pada populasi manusia pedesaan (Badui) non-industrialisasi di Arabia (Angelakis et al. 2016 ) dan beberapa primata non-manusia yang tidak terpapar lingkungan perkotaan (Manara et al. 2019 ). Meskipun hasil ini mungkin merupakan ‘observasi cepat’ dan menjamin penelitian di masa mendatang untuk mengeksplorasi lebih dalam hubungan mikrobioma sebagai respons terhadap perubahan pola makan di seluruh gradien perkotaan-pedesaan, hasil ini mengarah pada hipotesis bahwa di daerah yang kurang perkotaan, R. norvegicus mungkin perlu bergantung pada sumber makanan yang berbeda, mungkin lebih alami dibandingkan dengan yang ada di lingkungan perkotaan dan perubahan pola makan tersebut dikaitkan dengan perubahan mikrobioma usus. Apakah perubahan mikrobioma usus R. norvegicus di lingkungan yang kurang perkotaan akan membahayakan kesehatan inang atau terkait dengan fitur demografi masih belum diketahui. Jalan penelitian yang menarik dapat berupa perbandingan yang lebih rinci tentang perubahan mikrobioma pada R. norvegicus dan R. rattus pada skala biogeografis yang lebih besar, mengingat kemunculannya bersama dan di seluruh dunia di lingkungan perkotaan tetapi kapasitas yang berbeda untuk mengeksploitasi habitat alami. Khususnya, kelimpahan mikroba di R. rattus tidak berkorelasi dengan LUI dalam penelitian ini, menjadi satu-satunya spesies mamalia kecil tanpa ASV yang berlimpah yang diamati.
Bertentangan dengan harapan kami, kami menemukan sedikit bukti bahwa komposisi dan keanekaragaman mikrobioma spesies asli Sund. muelleri sangat dipengaruhi oleh perubahan penggunaan lahan di seluruh ekoton yang diteliti. Sebagai spesies adaptasi perkotaan yang tampaknya telah memperluas jangkauan habitatnya dari hutan ke vegetasi berkayu dan area kebun di pinggiran kota dengan dimulainya penebangan hutan hujan di Kalimantan (Blasdell et al. 2022 ; Wells et al. 2014 ), kami menduga spesies ini akan menghadapi kondisi lingkungan baru di seluruh ekoton yang diteliti yang sebagian besar tidak ada di habitat alami asli spesies ini.
Meskipun kami tidak menemukan efek LUI yang kuat pada mikrobioma Sund. muelleri , perlu dicatat bahwa Clostridium perfringens , patogen potensial yang terkenal bagi manusia dan hewan lainnya (Kiu dan Hall 2018 ), secara signifikan lebih melimpah pada individu yang ditemukan di lingkungan yang lebih perkotaan. Bakteri ini umumnya ditemukan di lingkungan perkotaan serta dalam mikrobiota manusia dan vertebrata lainnya (Kiu dan Hall 2018 ); oleh karena itu, kelimpahannya yang lebih tinggi pada tikus yang ditangkap di daerah yang lebih perkotaan belum tentu menjadi ancaman langsung bagi manusia dan hewan lainnya. Namun, dalam konteks temuan kami tentang kesamaan mikroba yang cukup besar antara Sund. muelleri dan R. rattus , yang merupakan vektor patogen zoonosis yang terkenal (Blasdell et al. 2022 ; Kosoy et al. 2015 ; Panti-May et al. 2017 ), deteksi spesies bakteri zoonosis di Sund. muelleri menimbulkan pertanyaan (yang sebagian besar belum terjawab) seputar apakah interaksi spesies mamalia kecil invasif asli dapat memfasilitasi perpindahan inang dan penularan parasit dari satwa liar ke manusia dan sebaliknya, dan apakah spesies yang beradaptasi di perkotaan seperti Sund. muelleri dapat memperkuat risiko wabah penyakit zoonosis (Roberts et al. 2021 ).
5 Kesimpulan
Studi kami mengungkap hubungan mikrobioma multi-inang di seluruh ekoton perkotaan-pedesaan yang berkesinambungan, yang seharusnya memotivasi penelitian masa depan tentang bagaimana pola tersebut dan kemungkinan mekanisme yang mendasarinya berperan dalam kendala bagaimana spesies asli dan invasif mengeksploitasi habitat di masa perubahan global.
Kami menyoroti bagaimana filogeni inang membentuk perbedaan mikrobioma antara spesies inang yang berkerabat jauh, sementara faktor lingkungan seperti ko-kemunculan dan tumpang tindih relung di seluruh gradien penggunaan lahan cenderung menyatukan mikrobioma di antara spesies yang berkerabat dekat dan simpatrik. Kami menyarankan bahwa tumpang tindih relung ekologi antara adaptor perkotaan asli Sundamys muelleri dan R. rattus invasif menawarkan peluang ekologis yang membentuk asosiasi mikroba, sementara bahkan untuk spesies inang generalis seperti R. norvegicus kosmopolitan , perubahan kondisi lingkungan yang ditemui di seluruh gradien penggunaan lahan skala halus dapat mendorong variasi dalam komposisi mikrobioma dan kelimpahan bakteri. Kami menemukan bukti pertama bahwa pergeseran dalam asosiasi mikroba di ekoton perkotaan-pedesaan dapat relevan dengan kelimpahan patogen gastrointestinal zoonosis yang terkait dengan hewan pengerat, tetapi penelitian di masa depan diperlukan untuk memahami bagaimana pergeseran dalam asosiasi mikroba di seluruh gradien penggunaan lahan terkait dengan perubahan dalam kesesuaian habitat, pola makan, dan kesehatan inang yang berubah dan apakah plastisitas dan kekuatan selektif pada mikrobioma usus dapat membatasi cara spesies asli dan invasif mampu mengeksploitasi lingkungan baru.
