ABSTRAK
Tujuan
Disfungsi mitokondria merupakan ciri khas penyakit neurodegeneratif seperti Alzheimer (AD) dan Parkinson (PD). Tujuan kami adalah mengembangkan metode praktis dan noninvasif untuk menilai status mitokondria melalui deteksi vesikel yang berasal dari mitokondria (MDV).
Metode
Kami meneliti MDV yang ditularkan melalui darah, kelas vesikel ekstraseluler yang baru-baru ini diidentifikasi, sebagai biomarker potensial untuk status mitokondria SSP.
Hasil
Studi ini mengidentifikasi MDV dari neuron, astrosit, dan oligodendrosit khususnya dalam plasma manusia. Nanoflow cytometry baru dikembangkan untuk mengevaluasi tingkat MDV yang berasal dari neuron, astrosit, dan oligodendrosit dalam plasma pada pasien AD dan PD. Yang terpenting, analisis kohort penemuan dan validasi mengungkapkan MDV spesifik sel otak yang jauh lebih rendah pada pasien AD dan PD dibandingkan dengan kontrol yang sehat.
Interpretasi
Studi ini menunjukkan bahwa MDV darah dapat berfungsi sebagai biomarker noninvasif untuk disfungsi mitokondria pada AD, PD, dan lainnya, yang berpotensi membantu dalam memantau terapi yang berfokus pada mitokondria untuk gangguan neurologis.
Singkatan
IKLAN
Penyakit Alzheimer
AUC
area di bawah kurva
Sebuah
amiloid-beta
Sistem Saraf Pusat (SSP)
sistem saraf pusat
cairan serebrospinal (CSF)
cairan serebrospinal
Bahasa Inggris CypD
siklofilin D
EV
vesikel ekstraseluler
Asam lemak tak jenuh (GABA)
asam gamma-aminobutyric
MDD
gangguan depresi mayor
Bahasa Indonesia: MDV
vesikel yang berasal dari mitokondria
MVB
badan multivesikular
Bahasa Indonesia: NTA
analisis pelacakan nanopartikel
OKSFO
fosforilasi oksidatif
PD
penyakit parkinson
Bahasa Inggris ROC
karakteristik operasi penerima
ROS
spesies oksigen reaktif
TEMPAT
mikroskopi penipisan emisi terstimulasi
BADAI
mikroskopi rekonstruksi optik stokastik
TCA
asam trikarboksilat
TEMPUR
mikroskop elektron transmisi
Universitas California
ultrasentrifugasi
1 Pendahuluan
Disfungsi mitokondria merupakan ciri khas banyak penyakit manusia, termasuk gangguan neurodegeneratif seperti Penyakit Alzheimer (AD) dan penyakit Parkinson (PD) [ 1 ]. Pendekatan farmakologis yang menargetkan komponen mitokondria menunjukkan hasil yang menjanjikan dalam meningkatkan kesehatan mitokondria dengan memodulasi dinamika, meningkatkan biogenesis, dan mengurangi stres oksidatif, dengan kandidat yang menjanjikan termasuk antioksidan dan sensitizer insulin [ 2 ]. Selain itu, perubahan pola makan dan teknik genetika tingkat lanjut seperti CRISPR/Cas9 menawarkan strategi untuk mengurangi disfungsi mitokondria, yang terkait dengan penuaan, kanker, gangguan metabolisme, dan neurodegenerasi [ 3 ].
Terapi mitokondria potensial yang baru diusulkan melibatkan transfer mitokondria, di mana komponen-komponen mitokondria dipertukarkan antar sel untuk meningkatkan fungsi dan mengurangi stres oksidatif [ 4 ]. Studi telah menunjukkan bahwa transfer mitokondria dapat mencegah kematian neuron pada tikus model PD yang diberi lesi 6-hidroksidopamin [ 5 ]. Salah satu metode transfer mitokondria memanfaatkan vesikel yang berasal dari mitokondria (MDV). MDV dilepaskan oleh mitokondria dan bertindak sebagai mekanisme pertahanan dengan membuang protein yang rusak dan mencegah kegagalan mitokondria [ 6 ]. Selain investigasi mekanistik, MDV, yang ukurannya mirip dengan eksosom, adalah jenis vesikel ekstraseluler (EV) yang juga ditemukan dalam darah manusia dan dapat berfungsi sebagai biomarker untuk penyakit neurologis. Misalnya, kadar protein mitokondria yang berubah dalam EV neuronal telah diamati pada gangguan depresi mayor (MDD), yang berpotensi membantu dalam diagnosis dan pemantauan [ 7 ]. Namun, meskipun kami dan peneliti lain telah mengidentifikasi EV astrosit dan oligodendroglial, selain EV neuronal, dalam plasma manusia [ 8 , 9 ], perubahan MDV turunan SSP pada AD dan PD dan apakah MDV dapat dideteksi dalam darah manusia masih belum jelas.
Dalam penelitian ini, dengan protokol yang mapan, kami mengidentifikasi MDV yang berasal dari neuron, astrosit, dan oligodendroglia dalam plasma manusia. Selain itu, kami mengembangkan teknologi berbasis flow cytometry yang sensitif dan cepat untuk mengevaluasi kadar MDV spesifik sel SSP dalam plasma perifer. Investigasi ini menunjukkan bahwa ketiga jenis EV mengandung protein mitokondria, dengan perubahan substansial yang diamati pada pasien PD dan AD.
2 Metode
2.1 Peserta
Persetujuan etis untuk pengambilan darah manusia diperoleh dari Institutional Review Board di First Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou, Zhejiang, Tiongkok (2022-043). Kohort penemuan mencakup 41 pasien PD, 46 pasien AD , bersama dengan 62 kontrol sehat (HC) yang sesuai usia dan jenis kelamin, yang terdaftar dari First Affiliated Hospital of Zhejiang University School of Medicine (Tabel 1 ). Kohort validasi terdiri dari 51 pasien PD, 66 pasien AD , dan 65 HC yang sesuai usia dan jenis kelamin, yang terdaftar dari First Affiliated Hospital of Zhejiang University School of Medicine dan Peking Union Medical College Hospital (Tabel 1 ). Persetujuan tertulis yang diinformasikan diperoleh dari semua peserta sebelum pengambilan darah. Ringkasan komprehensif dari karakteristik klinis peserta disediakan dalam Tabel 1 .
| Kohort penemuan ( n = 149) | Kohort validasi ( n = 182) | |||||
|---|---|---|---|---|---|---|
| HC | PD | IKLAN | HC | PD | IKLAN | |
| Nomor | 62 | 41 | 46 | 65 | 51 | 66 |
| Usia | ||||||
| Rata-rata ± SD | 72,16 ± 6,66 | 74,29 ± 9,86 | 69,68 ± 9,293 | 71,16 ± 7,87 | 69,83 ± 9,83 | 65,52 ± 8,19 |
| Jangkauan | 60–88 | 54–91 | 53–87 | 50–90 | 49–93 | 51–86 |
| Jenis Kelamin (P:P) | pukul 29.33 | pukul 22.19 | pukul 20.26 | pukul 29.36 | pukul 28.23 | pukul 32.34 |
| Tes MMSE | ||||||
| Rata-rata ± SD | 28,68 ± 1,44 jam | — | 20,54 ± 7,021 miliar | 28,72 ± 1,75 detik | — | 18,80 ± 7,175 hari |
| Jangkauan | 25–30 | — | 6–29 | 24–30 | — | 2–27 |
Singkatan: AD, penyakit Alzheimer; HC, kontrol sehat; PD, penyakit Parkinson. bilangan n = 44. bilangan bulat positif bn = 26. bilangan real negatif = 44. bilangan prima d n = 30.
2.2 Kriteria Inklusi dan Eksklusi untuk Pasien AD
Semua pasien AD yang terdaftar memenuhi kriteria diagnostik NINCDS-ADRDA1. Diagnosis dikonfirmasi oleh dua atau lebih ahli saraf berpengalaman secara independen. Kriteria inklusi: (1) usia antara 45 dan 90 tahun; (2) secara klinis didiagnosis dengan demensia; (3) defisit dalam dua atau lebih domain kognitif; (4) penurunan bertahap dalam memori dan fungsi kognitif lainnya; (5) tidak ada gangguan kesadaran. Kriteria eksklusi: (1) defek lapang pandang atau ataksia; (2) temuan neurologis fokal di awal perjalanan penyakit; (3) kejang atau gangguan gaya berjalan pada awal atau tahap awal penyakit; (4) pemindaian PET tidak sesuai dengan AD.
2.3 Kriteria Inklusi dan Eksklusi untuk Pasien PD
Semua pasien PD yang terdaftar memenuhi kriteria diagnostik klinis MDS untuk penyakit Parkinson (MDS-PD). Diagnosis juga dikonfirmasi oleh dua atau lebih ahli saraf berpengalaman secara independen. Kriteria inklusi: (1) usia antara 45 dan 90 tahun; (2) respons positif yang jelas dan signifikan terhadap terapi dopaminergik; (3) tremor saat istirahat pada anggota badan; (4) adanya gangguan motorik yang signifikan. Kriteria eksklusi: (1) kelainan serebelum yang jelas pada pemeriksaan; (2) kehilangan sensorik kortikal yang jelas; (3) neuroimaging fungsional normal dari sistem dopaminergik presinaptik.
2.4 Kriteria Inklusi untuk Kelompok Kontrol Sehat (HC)
Tidak diketahui diagnosis penyakit neurologis atau psikiatris atau riwayat penyakit.
2.5 Pengambilan Sampel Darah
Mengikuti protokol standar, sampel darah dikumpulkan dalam tabung berlapis EDTA (BD Vacutainer, nomor kat. 367863). Sampel menjalani sentrifugasi awal pada 1500 g selama 15 menit pada suhu 4°C untuk mengisolasi plasma, diikuti oleh langkah sentrifugasi sekunder pada 3200 g pada suhu 4°C selama 15 menit untuk menghilangkan sisa sel. Sampel plasma yang telah diproses diawetkan pada suhu -80°C untuk analisis lebih lanjut.
2.6 Isolasi EV Dari Plasma
Untuk mengisolasi EV, 100 μL plasma dikenakan sentrifugasi berurutan. Pertama, sampel disentrifugasi pada 12.000 g selama 30 menit pada suhu 4°C untuk membuang serpihan sel dan partikel yang lebih besar. Supernatan kemudian dikumpulkan, diencerkan dengan 1 mL larutan penyangga fosfat (PBS) yang disaring steril, dan disentrifugasi ultra pada 100.000 g selama 70 menit untuk membentuk pelet EV. Pelet yang dihasilkan dicuci dengan cara mensuspensikan kembali dalam 1 mL PBS dan mengulangi langkah sentrifugasi ultra (100.000 g , 70 menit). Akhirnya, EV yang dimurnikan disuspensikan kembali dalam 100 μL PBS yang disaring untuk aplikasi hilir.
2.7 Penyakit Western Blot
Analisis Western blot (WB) dilakukan untuk mengonfirmasi keberadaan protein terkait mitokondria dan penanda spesifik EV. Mengikuti protokol isolasi yang dijelaskan sebelumnya, 1 mL plasma diproses untuk memperoleh fraksi EV. EV yang dimurnikan dilisiskan di atas es selama 15 menit menggunakan buffer lisis RIPA yang mengandung 1x PMSF. Selanjutnya, lisat EV dicampur dengan buffer pemuatan protein dan didenaturasi pada suhu 100°C selama 10 menit untuk mempersiapkan pemisahan elektroforesis. Protein dipisahkan menggunakan Gel Bis-Tris 8%–16% (M00660, Genescript) dan selanjutnya dipindahkan ke membran PVDF (IPVH00010, Merck). Membran PVDF pertama-tama diolah dengan susu skim 5% selama 1 jam pada suhu ruangan untuk memblokir tempat pengikatan nonspesifik. Kemudian, membran diekspos ke antibodi primer dan dipertahankan pada suhu 4°C semalaman untuk imunoblotting. Setelah dicuci dengan TBST, membran PVDF diinkubasi dengan antibodi sekunder IRDye 800CW Goat anti-mouse atau Goat anti-rabbit (926-32210, LI-COR) selama 1 jam pada suhu ruangan. Antibodi primer yang digunakan dalam penelitian ini adalah anti-VDAC1 (ab14734, Abcam, 1:1000), anti-NMDAR2A (MA5-27693, Invitrogen, 1:1000), anti-SLC1A2 (MAB20001, Abnova, 1:1000), anti-CNPase (5664, CST, 1:1000), anti-β-actin (20536-1-AP, Proteintech, 1:1000), dan anti-Alix (2171, Cell Signaling Technology, 1:1000).
2.8 Analisis Pelacakan Nanopartikel
Kuantifikasi jumlah partikel dan distribusi ukuran EV dilakukan menggunakan analisis pelacakan nanopartikel (NTA; NS300, Nanosight). Tiga video berdurasi 60 detik direkam untuk setiap fraksi EV, dan semua fraksi dianalisis menggunakan pengaturan ambang batas yang sama. Analisis video yang direkam dilakukan menggunakan perangkat lunak NTA 3.1 (Nanosight).
2.9 Mikroskop Elektron Transmisi (TEM)
5 μL sampel EVs dengan konsentrasi sekitar 10 12 /mL diinkubasi pada lapisan pendukung karbon (XP-CF300, kisi tembaga, Shenzhen Guanpin) selama 2 menit. Cairan berlebih pada lapisan karbon dihilangkan menggunakan kertas saring, diikuti dengan pencucian dengan 5 μL PBS. Selanjutnya, 5 μL uranil asetat 2% diaplikasikan untuk mewarnai sampel selama 2 menit. Setelah menghilangkan cairan berlebih dengan kertas saring, sampel dikeringkan dengan udara pada suhu ruangan. Pencitraan dilakukan menggunakan instrumen EM Talos L120C (Thermo Fisher Scientific, FEI) yang beroperasi pada 120 kV, dilengkapi dengan kamera CETA.
2.10 Mikroskopi Elektron Kriogenik (Cryo-EM)
(1) Persiapan sampel: Menggunakan Vitrobot (Thermo Fisher) di bawah kelembapan 100% pada suhu 4°C, 3 μL sampel EVs dengan konsentrasi sekitar 10 12 /mL diinkubasi pada kisi karbon berlubang Quantifoil yang mengeluarkan pijar (R2/1, 300 mesh, tembaga, Q85959). Sampel dikocok dengan kekuatan dan durasi yang sesuai dan dibekukan dengan cepat dalam etana cair yang didinginkan nitrogen cair untuk membentuk lapisan es amorf yang tervitrifikasi, yang mempertahankan struktur asli sampel. Kisi-kisi disimpan dalam kondisi nitrogen cair untuk mencegah pembentukan kristal es dan kerusakan akibat radiasi. (2) Akuisisi gambar: EVs pada kisi karbon divisualisasikan menggunakan mikroskop elektron Titan Krios 300 keV (Thermo Fisher) yang dilengkapi dengan kamera K2 Summit (Gatan). Gambar Cryo-EM diperoleh dalam mode penghitungan menggunakan SerialEM pada perbesaran nominal 33.000. Rangkaian kemiringan untuk tomografi krio-elektron dikumpulkan dari −51° hingga 51° pada interval 3°, menghasilkan 35 gambar per rangkaian. Ukuran piksel adalah 3,6 Å, dan rentang defokus ditetapkan antara −0,9 dan −1,5 μm.
2.11 Analisis Sitometri Nanoflow
Antibodi anti-VDAC1/Porin (ab14734, Abcam) diberi label dengan kit pelabelan Zenon Alexa Fluor 647 mouse IgG Mouse2b (Z25208, Invitrogen), antibodi anti-CNPase (5664S, Cell Signaling Technology) diberi label dengan kit pelabelan Zenon Alexa Fluor 488 rabbit (Z25302, Invitrogen), antibodi anti-SLC1A2 (MAB20001, Abnova) diberi label dengan kit pelabelan Zenon Alexa Fluor 488 rabbit (Z25302, Invitrogen), dan antibodi anti-NMDAR2A diberi label dengan kit pelabelan Zenon Alexa Fluor 488 mouse IgG Mouse2b (Z25202, Invitrogen), sesuai dengan protokol pabrik. Singkatnya, 5 μL sampel EV diblokir dengan 2% BSA dengan volume yang sama pada suhu kamar selama 1 jam, diikuti dengan penambahan 5 μL PBS (0,22 μm disaring). Antibodi terkonjugasi fluorofor (0,03 μg setiap antibodi per sampel) kemudian ditambahkan ke sampel dan diinkubasi semalam pada suhu 4 °C. Kontrol isotipe IgG dari setiap antibodi diberi label dengan prosedur yang sama. Sampel difiksasi dengan 10 μL 4% PFA (0,22 μm disaring) pada suhu kamar selama 20 menit sebelum analisis nanoflow cytometry dengan CytoFLEX LX (Beckman). Stabilitas pengujian dievaluasi dengan menguji sampel pada hari ke-1, ke-3, dan ke-5. Sampel diencerkan secara linear (1:1, 1:2, 1:4) untuk mengevaluasi keakuratan pengujian.
2.12 Mikroskopi Rekonstruksi Optik Stokastik
Sampel EV diberi label dengan antibodi terkonjugasi seperti dijelaskan di atas. Setelah fiksasi menggunakan 4% PFA, sampel direndam dalam 300 μL buffer pencitraan Stochastic Optical Reconstruction Microscopy (STORM) khusus (50 mM Tris–HCL, pH 8,0, 10 mM NaCl, dan 10% Glukosa). Semua gambar diambil menggunakan sistem resolusi super Nikon N-STORM (Nikon Instruments Inc.) yang dilengkapi dengan mikroskop terbalik Nikon Eclipse Ti. Fluorofor Alexa 488 dan Alexa 647 masing-masing dipicu oleh laser semikonduktor 488 dan 647 nm.
2.13 Mikroskopi Deplesi Emisi Terstimulasi (STED)
10 μL sampel EV yang diperkaya dengan ultracentrifugasi diinkubasi dengan VDAC1 (ab14734, Abcam) atau sitokrom c (ab13575, Abcam) pada suhu ruangan selama 1 jam. Sampel selanjutnya diolah dengan antibodi sekunder Abberior STAR RED (Abberior) pada suhu ruangan selama 1 jam sebelum akuisisi STED resolusi super. Prosedur pencitraan dilakukan menggunakan sistem resolusi super Abberior STEDYCON yang dikontrol oleh perangkat lunak akuisisi Inspector (Abberior, Göttingen, Jerman). Platform nanoskopi ini dirakit pada rangka mikroskop terbalik Olympus IX83, yang menggabungkan lensa objektif imersi minyak UPlanSApo 100× (bukaan numerik 1,40; Olympus) dan detektor Andor iXon Ultra 897 EMCCD untuk penangkapan sinyal.
2.14 Analisis Statistik
Semua analisis statistik dilakukan dengan SPSS 23.0 (IBM, Chicago, IL) dan Prism 9.0 (GraphPad Software, La Jolla, CA). Perbandingan data dilakukan dengan menggunakan uji- t Student dua sisi yang tidak berpasangan untuk perbandingan antara dua kelompok dan ANOVA satu arah yang dilengkapi dengan analisis post hoc Tukey untuk perbandingan di antara beberapa kelompok. Analisis integratif dilakukan dengan menggunakan metode regresi logistik binomial, dengan tingkat MDV yang berasal dari neuron, astrosit, dan oligodendrosit, serta rasio MDV spesifik sel terhadap jumlah total EV dari setiap jenis sel. Kurva ROC digunakan untuk mengevaluasi kinerja diagnostik, sensitivitas, dan spesifisitas dalam membedakan PD atau AD dari HC. Ambang optimal untuk setiap kurva ROC ditentukan sebagai titik yang menghasilkan sensitivitas dan spesifisitas gabungan tertinggi.
3 Hasil
3.1 Identifikasi MDV Plasma Spesifik Sel SSP
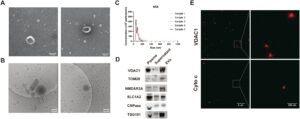
Untuk memastikan keberadaan MDV spesifik sel SSP dalam plasma manusia, EV diisolasi mengikuti prosedur yang ditetapkan dengan baik dari sampel HC [ 8 ]. Analisis TEM dan cryo-EM mengungkapkan bahwa EV menunjukkan diameter karakteristik sekitar 100 nm, yang menampilkan struktur membran eksosom yang khas (Gambar 1A, B ). Analisis NTA selanjutnya mengonfirmasi bahwa ukuran EV sebagian besar berkisar antara 30 hingga 150 nm, sejalan dengan kisaran ukuran yang ditetapkan untuk eksosom (Gambar 1C ). Analisis Western blot menunjukkan bahwa EV yang diisolasi dari plasma mengandung protein terkait mitokondria, termasuk TOM20 dan VDAC1 (Gambar 1D ). EV yang diisolasi dari ultracentrifugasi juga diperkaya untuk NMDAR2A, SLC1A2, dan CNPase, penanda neuron, astrosit, dan oligodendrosit (Gambar 1D ), masing-masing. Lebih jauh lagi, STED mendeteksi protein mitokondria VDAC1 dalam EV yang diisolasi, menunjukkan bahwa bagian dari EV mengandung protein mitokondria atau fragmen mitokondria, yaitu MDV (Gambar 1E ).
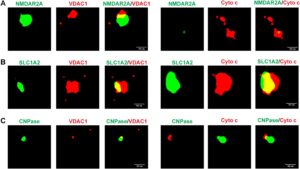
STORM digunakan untuk menyelidiki lebih lanjut keberadaan MDV turunan SSP dalam plasma manusia dari HC. Analisis ini mengungkapkan bahwa NMDAR2A, SLC1A2, dan CNPase—penanda yang diekspresikan oleh neuron SSP, astrosit, dan oligodendrosit, secara berurutan—mudah dilokalisasi bersama dengan protein mitokondria VDAC1 dan sitokrom c, yang selanjutnya menunjukkan keberadaan MDV turunan neuron, astrosit, dan oligodendrosit dalam plasma (Gambar 2A–C ). Lebih jauh lagi, untuk mengonfirmasi ko-lokalisasi penanda mitokondria dengan penanda spesifik neuron, astrosit, dan oligodendrosit, video tiga dimensi dibuat dan disediakan dalam Video S1–S6 .
3.2 Pengembangan Pengujian untuk MDV yang Berasal dari Sistem Saraf Pusat (SSP)
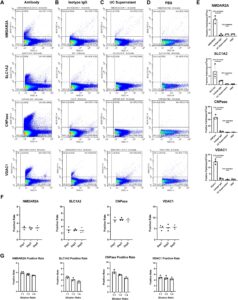
Bahasa Indonesia: Untuk mengeksplorasi apakah MDV turunan SSP dapat berfungsi sebagai biomarker untuk memantau disfungsi mitokondria, kami mengoptimalkan uji berbasis nanoflow cytometry yang sebelumnya dikembangkan untuk CSF [ 10 ] dan plasma [ 8 ]. Uji ini kemudian digunakan untuk menilai pasien dengan AD dan PD, dua penyakit yang terkenal dengan disfungsi mitokondria sebagai proses patofisiologis utama. Untuk memfasilitasi deteksi dan analisis MDV, model VSSC dari CytoFLEX LX digunakan untuk deteksi. Seperti yang ditunjukkan pada Gambar 3A , MDV VDC1 + terdeteksi dalam plasma, sementara sinyal positif yang dapat diabaikan terdeteksi dalam kelompok kontrol imunoglobulin G (IgG) isotipe, supernatan UC, dan buffer pengenceran (Gambar 3A–E ). Antibodi yang menargetkan NMDAR2A, SLC1A2, dan CNPase memungkinkan pelabelan EV yang berasal dari neuron, astrosit, dan oligodendrosit, masing-masing, dalam plasma [ 8 , 9 , 11 ]. Seperti yang diharapkan, sinyal positif minimal terdeteksi dalam kelompok kontrol IgG isotipe, supernatan UC, dan buffer pengenceran. Kombinasi NMDAR2A, SLC1A2, dan CNPase dengan VDAC1 kemudian digunakan untuk mendeteksi dan menganalisis MDV yang berasal dari neuron, astrosit, dan oligodendrosit. Hasil ini memverifikasi spesifisitas uji untuk mendeteksi MDV yang berasal dari SSP. Selain itu, stabilitas uji diselidiki dengan memberi label EV dengan antibodi yang menargetkan VDAC1, CNPase, SLC1A2, dan NMDAR2A diikuti dengan penyimpanan selama 1, 3, dan 5 hari sebelum deteksi. Hasilnya menunjukkan persentase pelabelan EV yang konsisten di berbagai titik waktu (Gambar 3F ). Linearitas pengenceran dengan jelas membuktikan keakuratan pengujian (Gambar 3G ).
3.3 MDV yang Berasal dari Neuron pada Pasien PD dan AD
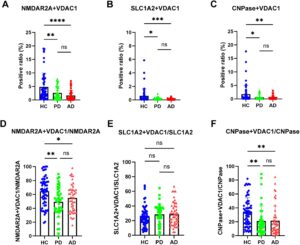
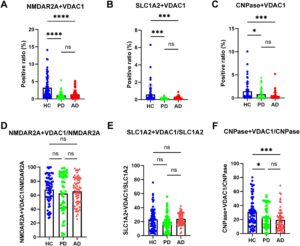
Untuk mengeksplorasi kemungkinan MDV turunan neuron dalam memantau disfungsi mitokondria pada PD dan AD, sampel penemuan dan validasi yang dikumpulkan dari beberapa pusat medis dianalisis dengan uji berbasis nanoflow cytometry yang dioptimalkan. Seperti yang ditunjukkan pada Gambar 4A dan Gambar S1B , kadar EV NMDAR2A + dan VDAC1 + secara signifikan lebih rendah pada pasien PD dan AD dibandingkan dengan HC pada kohort penemuan. Hasil yang diamati pada kohort penemuan sebagian besar direplikasi pada kohort validasi (Gambar 5A , Gambar S1F ). Rasio MDV neuronal terhadap total EV neuronal juga berkurang pada pasien PD dan AD dibandingkan dengan HC pada kohort penemuan (Gambar 4D , Gambar S2A ). Hasil ini menunjukkan bahwa penurunan MDV neuronal tidak terutama disebabkan oleh perubahan pada keseluruhan kadar EV turunan neuron. Namun, meskipun tren serupa diamati dalam kelompok validasi, signifikansi statistik yang terlihat dalam kelompok penemuan tidak direplikasi (Gambar 5D , Gambar S2D ). Perbedaan ini kemungkinan menunjukkan bahwa pengurangan EV neuronal total mungkin, setidaknya sebagian, berkontribusi pada perubahan yang diamati dalam parameter terukur tertentu.
Untuk mengevaluasi perubahan MDV yang berasal dari neuron pada pasien PD dan AD menggunakan pendekatan ortogonal, kami melakukan analisis statistik pada gambar STORM bidang lebar. Sesuai dengan hasil kami dari nano-flowcytometry, analisis menunjukkan bahwa tingkat MDV yang berasal dari neuron berkurang pada pasien PD dan AD dibandingkan dengan pasien HC (Gambar S3A,B ).
3.4 MDV yang Berasal dari Astrosit pada Pasien PD dan AD
Seperti MDV yang berasal dari neuron, ketika MDV yang berasal dari astrosit dievaluasi dalam kelompok penemuan, kadar EV SLC1A2 + dan VDAC1 + menurun secara signifikan pada pasien PD dan AD (Gambar 4B , Gambar S1C ). Namun, rasio MDV yang berasal dari astrosit terhadap total EV astrosit tidak berubah pada pasien PD dan AD dibandingkan dengan HC (Gambar 4E , Gambar S2B ). Secara konsisten, hasilnya juga direplikasi dalam kelompok validasi (Gambar 5B,E , Gambar S1G dan Gambar S2E ).
Mirip dengan MDV neuronal, analisis statistik gambar STORM dengan bidang besar juga mengungkapkan bahwa tingkat MDV yang berasal dari astrosit berkurang pada pasien PD dan AD dibandingkan dengan HC (Gambar S3C,D ).
3.5 MDV yang Berasal dari Oligodendrosit pada Pasien PD dan AD
Sampai saat ini, sangat sedikit yang diketahui tentang disfungsi mitokondria pada oligodendrosit, baik pada PD atau AD. Namun, seperti yang ditunjukkan pada Gambar 4C dan Gambar S1D , kadar MDV yang berasal dari oligodendrosit secara signifikan lebih rendah pada pasien AD dan PD dibandingkan dengan HC. Rasio MDV yang berasal dari oligodendrosit terhadap EV oligodendroglia juga berkurang secara signifikan pada pasien PD dan AD dibandingkan dengan HC (Gambar 4G , Gambar S2C ). Hasil ini menunjukkan lagi bahwa penurunan MDV yang berasal dari oligodendrosit tidak terutama disebabkan oleh perubahan kadar EV secara keseluruhan. Hasil ini juga divalidasi dalam kohort validasi (Gambar 5C,F , Gambar S1H , Gambar S2F ).
Mirip dengan MDV yang berasal dari neuronal dan astrosit, pengujian independen—analisis statistik gambar STORM bidang besar—sekali lagi menunjukkan berkurangnya tingkat MDV yang berasal dari oligodendrosit pada pasien PD dan AD dibandingkan dengan HC (Gambar S3E,F ).
3.6 MDV yang Berasal dari Sistem Saraf Pusat (SSP) sebagai Penanda Diagnostik untuk PD dan AD
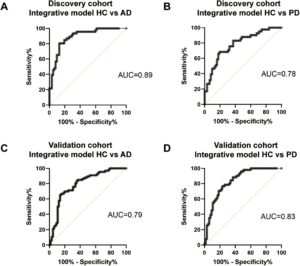
Sementara tipe MDV individual menunjukkan nilai area under the curve (AUC) yang terbatas untuk diagnosis PD dan AD (Tabel 2 dan Tabel 3 ), menggabungkan keduanya dalam model regresi logistik binomial meningkatkan kinerja secara signifikan. Peningkatan ini didasarkan pada tingkat MDV turunan neuron, astrosit, dan oligodendrosit, serta rasio MDV spesifik sel terhadap jumlah total EV dari setiap tipe sel. Dalam kohort penemuan, model integratif membedakan AD dari HC dengan AUC sebesar 0,89 (IK 95% = 0,83 hingga 0,95, sensitivitas = 0,85, spesifisitas = 0,81) (Gambar 6A ). Mengenai PD dan HC, model integratif mencapai AUC sebesar 0,78 (IK 95% = 0,69–0,87), dengan sensitivitas 0,76 dan spesifisitas 0,68 (Gambar 6B ). Dalam kohort validasi, model integratif MDV turunan CNS menunjukkan AUC sebesar 0,79 (IK 95% = 0,72–0,87) untuk diskriminasi AD dan HC, dengan sensitivitas 0,71 dan spesifisitas 0,75 (Gambar 6C ). AUC model integratif untuk membedakan PD dan HC adalah 0,83 (IK 95% = 0,76–0,91, sensitivitas = 0,78, spesifisitas = 0,74) dalam kohort validasi (Gambar 6D ).
| Kelompok penemuan | Kohort validasi | |||
|---|---|---|---|---|
| HC melawan AD | HC versus PD | HC melawan AD | HC versus PD | |
| Bahasa Inggris ROC | ||||
| NMDAR2A + VDAC1 + | 0,75 (0,66–0,85) | 0,63 (0,52–0,74) | 0,71 (0,63–0,80) | 0,75 (0,66–0,84) |
| SLC1A2 + VDAC1 + | 0,84 (0,77–0,91) | 0,62 (0,51–0,73) | 0,63 (0,54–0,73) | 0,74 (0,66–0,83) |
| CNPase + VDAC1 + | 0,82 (0,73–0,90) | 0,71 (0,60–0,82) | 0,72 (0,64–0,81) | 0,65 (0,55–0,75) |
| Kelompok penemuan | Kohort validasi | |||||||
|---|---|---|---|---|---|---|---|---|
| HC melawan AD | HC versus PD | HC melawan AD | HC versus PD | |||||
| Kepekaan | Kekhususan | Kepekaan | Kekhususan | Kepekaan | Kekhususan | Kepekaan | Kekhususan | |
| NMDAR2A + VDAC1 + | 0.72 | 0.57 | 0.66 | 0,55 | 0.71 | 0,60 | 0.76 | 0,60 |
| SLC1A2 + VDAC1 + | 0,89 | 0,60 | 0.63 | 0.52 | 0.73 | 0.51 | 0.82 | 0.51 |
| CNPase + VDAC1 + | 0.83 | 0.56 | 0.73 | 0.44 | 0.76 | 0.51 | 0.63 | 0.42 |
Perlu dicatat bahwa tidak ada korelasi signifikan antara usia atau jenis kelamin dan kadar MDV yang berasal dari CNS dalam kelompok penemuan atau kelompok validasi (Gambar S4A–L ). Namun, seperti yang ditunjukkan dalam Gambar S4M–R , kadar MDV yang berasal dari oligodendrosit, astrosit, dan neuron berkorelasi dengan skor MMSE pada pasien AD dan HC dalam kelompok validasi tetapi tidak dalam kelompok penemuan.
4 Diskusi
Dalam penelitian ini, kami mengidentifikasi MDV yang berasal dari neuron, astrosit, dan oligodendrosit dalam darah dan berhasil mengembangkan uji untuk mengevaluasi MDV spesifik SSP ini. Selain itu, kami menunjukkan bahwa kadar MDV yang berasal dari SSP dalam plasma menurun secara substansial pada pasien PD dan AD.
MDV yang berasal dari neuron telah terbukti berubah dalam darah pasien dengan MDD [ 7 ]. Namun, penelitian saat ini adalah yang pertama menunjukkan keberadaan MDV astrosit dan oligodendroglia dalam plasma manusia. MDV yang diidentifikasi memiliki ukuran yang mirip dengan eksosom, memperkuat bahwa eksosom, yang berasal dari badan multivesikular (MVB) [ 12 ], tidak dapat didefinisikan hanya berdasarkan ukuran. Investigasi terbaru menyarankan untuk mendefinisikan berbagai vesikel berdasarkan pengayaan protein spesifik yang terkait dengan EV selain ukuran [ 13 ].
MDV biasanya membawa TOM20 dan VDAC1, dua protein saluran impor penting dari membran luar mitokondria, di permukaan [ 14 ]. Selain itu, kompleks fosforilasi oksidatif spesifik (OXPHOS) di membran dalam mitokondria, enzim dalam matriks mitokondria seperti PDH, dan enzim siklus asam trikarboksilat (TCA) juga biasanya disertakan, menjadikan MDV sebagai jenis EV yang berbeda [ 14 ]. Terlepas dari kenyataan bahwa MDV baru-baru ini dikenali [ 15 ], fungsinya tampaknya beragam. MDV memainkan peran penting dalam berbagai proses fisiologis, termasuk kontrol kualitas mitokondria, pengangkutan kargo antar organel, dan pensinyalan imun [ 6 ]. Tampaknya juga bahwa generasi MDV bertindak sebagai respons awal terhadap stres mitokondria, mendahului mitofagi untuk mengeluarkan protein yang rusak dan menghilangkan stres oksidatif [ 16 ]. Mutasi VPS35, gen dominan autosomal yang terkait dengan PD, meningkatkan interaksinya dengan DLP1, yang meningkatkan pergerakan MDV ke lisosom untuk degenerasi [ 17 ]. Disregulasi proses ini mungkin terlibat dalam patogenesis PD. MDV yang dilepaskan oleh adiposit yang stres, yang mengandung partikel yang rusak secara oksidatif, dapat memasuki sirkulasi dan diambil oleh kardiomiosit, di mana mereka memicu produksi ROS yang substansial [ 18 ].
Sebuah observasi utama dari investigasi ini adalah bahwa MDV yang berasal dari neuron, astrosit, dan oligodendrosit semuanya berkurang pada pasien AD dan PD dibandingkan dengan HC (Gambar 4 ). Temuan ini sejalan dengan beberapa penelitian yang menunjukkan kerusakan mitokondria terkait dengan patogenesis PD dan AD. Misalnya, pada AD, akumulasi amiloid-beta (Aβ) dapat menyebabkan pengurangan massa mitokondria, gangguan biogenesis mitokondria, dan ketidakseimbangan fisi dan fusi pada neuron [ 19 ]. Interaksi antara siklofilin D (CypD) dan Aβ mitokondria meningkatkan permeabilitas membran mitokondria dan memicu stres mitokondria bersamaan dengan kematian neuron [ 20 ]. Demikian pula, gen risiko PD, termasuk SNCA, LRRK2, PINK1, dan Parkin, terkait erat dengan kualitas mitokondria [ 21 ]. Defek pada aktivitas kompleks I mitokondria dan abnormalitas pada mtDNA secara konsisten terdeteksi pada pasien PD [ 22 ]. Penurunan ekspresi subunit I sitokrom c yang dikodekan mtDNA dan penurunan aktivitas sitokrom c semakin mendukung peran disfungsi mitokondria pada PD [ 23 ].
Karena sebagian besar penelitian tentang disfungsi mitokondria dalam konteks AD dan PD dilakukan pada neuron, dua isu penting perlu didiskusikan lebih lanjut. Pertama, hasil kami menunjukkan bahwa kadar MDV yang berasal dari astrosit dan oligodendroglia berubah pada pasien AD dan PD, yang menunjukkan adanya fungsi mitokondria abnormal secara bersamaan pada astrosit dan oligodendrosit selain neuron. Astrosit memainkan peran penting dalam menjaga homeostasis metabolik, pasokan energi, dan daur ulang neurotransmitter [ 24 ]. Sebuah studi awal mendeteksi aktivitas siklus TCA yang berkurang pada astrosit dalam model tikus AD, yang menyebabkan defisiensi sintesis asam gamma-aminobutirat (GABA) pada neuron dan gangguan daur ulang transmitter [ 25 ]. Disfungsi ini juga meningkatkan pembentukan amiloid, yang selanjutnya menginduksi stres oksidatif dan gangguan mitokondria pada astrosit [ 26 , 27 ]. Namun, demonstrasi disfungsi mitokondria astrosit secara langsung pada jaringan otak manusia diperlukan dalam penelitian selanjutnya. Pada PD, Chen et al. melaporkan penurunan regulasi ekspresi protein OXPHOS mitokondria pada astrosit dari pasien PD [ 28 ]. Studi ini menunjukkan bahwa, seperti neuron, astrosit pada PD juga menunjukkan gangguan mitokondria. Selain itu, α-synuclein, ketika diinternalisasi oleh astrosit, dapat terlokalisasi pada mitokondria dan menyebabkan disfungsi OXPHOS, morfologi abnormal, dan gangguan fisi dan fusi [ 29 ].
Seperti halnya dengan astrosit, oligodendrosit sangat penting dalam patogenesis PD dan AD. Studi terbaru telah mengungkapkan bahwa demielinasi adalah kejadian awal AD, mendahului patologi amiloid dan tau [ 30 ]. Selain itu, penelitian menggunakan MRI telah menunjukkan kelainan pada materi putih pada PD. Namun, ada penelitian terbatas yang berfokus pada fungsi mitokondria oligodendrosit pada PD dan AD. Di sisi lain, mitokondria memainkan peran penting dalam diferensiasi, pembentukan mielin, dan hemostasis oligodendrosit [ 31 ]. Meskipun penelitian lebih lanjut diperlukan untuk mengkonfirmasi disfungsi mitokondria oligodendroglia pada PD dan AD, secara kolektif, hasil kami menekankan peran penting fungsi mitokondria astrosit dan oligodendroglia dalam penyakit neurodegeneratif. Mengingat peran penting astrosit dan oligodendrosit, menargetkan mitokondria mereka dapat memberikan strategi terapi baru untuk PD dan AD dalam penyelidikan masa depan.
Hal utama kedua yang perlu dibahas adalah bahwa penelitian kami mengukur jumlah MDV, tidak harus kadar protein mitokondria atau fungsi mitokondria. Oleh karena itu, meskipun penurunan yang diamati pada MDV yang berasal dari neuron, astrosit, dan oligodendrosit dapat menunjukkan disfungsi mitokondria pada pasien PD dan AD, penelitian yang lebih intensif diperlukan untuk memeriksa fungsi mitokondria pada MDV dan jaringan otak manusia, khususnya pada astrosit dan oligodendrosit. Selain itu, mekanisme yang mendasari penurunan MDV dalam darah memerlukan penelitian lebih lanjut. Apakah perubahan ini disebabkan oleh sintesis, perdagangan, sekresi MDV, atau perubahan pada sawar darah-otak yang mengatur perjalanan MDV? Terlepas dari mekanisme yang terlibat, penelitian kami membuka jalan potensial untuk mengevaluasi disfungsi mitokondria spesifik sel pada PD, AD, dan seterusnya. Lebih khusus lagi, biomarker mitokondria berbasis darah tetapi spesifik sel SSP ini dapat menjadi alat yang kuat untuk mengembangkan strategi terapi yang menargetkan penyakit SSP.
Studi kami memiliki beberapa keterbatasan, khususnya ukuran sampel yang relatif kecil. Meskipun perubahan MDV tidak dipengaruhi oleh usia atau jenis kelamin, temuan kami menunjukkan bahwa kadar MDV yang berasal dari neuron, astrosit, dan oligodendrosit berkorelasi dengan MMSE dalam kelompok validasi tetapi tidak dalam kelompok penemuan. Studi lebih lanjut dengan kelompok yang lebih besar, khususnya yang memiliki tindak lanjut longitudinal, diperlukan untuk memeriksa hubungan antara MMSE dan MDV yang berasal dari SSP dengan lebih baik.
Sebagai kesimpulan, penelitian kami tidak hanya mengidentifikasi MDV yang berasal dari neuron, astrosit, dan oligodendrosit dalam darah manusia, tetapi juga menunjukkan bahwa MDV spesifik sel ini menurun secara substansial pada pasien PD dan AD. Meskipun penelitian lebih lanjut diperlukan untuk memahami sepenuhnya mekanisme yang terlibat, MDV spesifik sel ini dapat berfungsi sebagai biomarker untuk fungsi mitokondria SSP, terutama saat menargetkan terapi mitokondria dengan suplemen, obat-obatan, atau manipulasi genetik.