Abstrak
Mycobacterium abscessus , mikobakterium non-tuberkulosis yang tumbuh cepat dan resistan terhadap sebagian besar obat antimikroba, menyebabkan berbagai macam infeksi serius pada manusia, sehingga menimbulkan tantangan kesehatan masyarakat yang signifikan. Pengembangan alat manipulasi genetik yang efektif untuk M. abscessus masih berlangsung, sehingga membatasi penelitian dan kemajuan terapi. Namun, sistem clustered regular interspaced short palindromic repeats (CRISPR)-associated protein (Cas) telah muncul sebagai alat yang menjanjikan untuk menghasilkan double-strand breaks (DSB) yang sangat spesifik dalam genomnya. Salah satu mekanisme yang memperbaiki DSB ini adalah jalur nonhomologous end-joining (NHEJ) yang rawan kesalahan, yang memfasilitasi penyuntingan gen yang ditargetkan. Dalam penelitian ini, kami memperkenalkan aplikasi baru dari pendekatan CRISPR-NHEJ pada M. abscessus . Kami menunjukkan bahwa NrgA dari M. marinum memainkan peran penting dalam memperbaiki DSB yang diinduksi oleh sistem CRISPR-Cas pada M. abscessus . Bertentangan dengan temuan sebelumnya, penelitian kami juga mengungkapkan bahwa menghambat atau mengekspresikan komponen rekombinasi homolog/annealing untai tunggal secara signifikan mengurangi efisiensi perbaikan NHEJ pada M. abscessus . Penemuan ini menantang perspektif saat ini dan menunjukkan bahwa perbaikan NHEJ pada M. abscessus mungkin melibatkan komponen dari jalur rekombinasi homolog dan annealing untai tunggal, yang menyoroti interaksi kompleks di antara ketiga mekanisme perbaikan DSB pada M. abscessus .
Pernyataan dampak
Resistensi antibiotik telah mengubah Mycobacterium abscessus menjadi ancaman kesehatan masyarakat yang terus meningkat, sehingga sangat mendesak untuk menemukan strategi pengobatan baru. Di sini, kami menyajikan aplikasi inovatif dari teknik penyuntingan gen nonhomologous end-joining berbasis CRISPR, yang menyediakan alat baru yang ampuh untuk mempelajari genetika M. abscessus . Kami juga mengidentifikasi peran penting NrgA dari M. marinum dalam perbaikan DNA dan mengungkap interaksi kompleks di antara berbagai jalur perbaikan DNA. Temuan ini tidak hanya memperdalam pemahaman kita tentang genetika mikobakteri tetapi juga memberikan kemungkinan baru untuk mengembangkan terapi yang ditargetkan untuk memerangi patogen yang sangat resistan terhadap obat ini.
PERKENALAN
Prevalensi infeksi paru-paru yang disebabkan oleh mikobakteri non-tuberkulosis (NTM) telah meningkat setiap tahunnya, menimbulkan ancaman yang meningkat terhadap kesehatan masyarakat. Di antara NTM ini, Mycobacterium abscessus adalah salah satu agen penyebab utama di Amerika Serikat dan wilayah lembap di pesisir selatan Cina 1 – 3 . Selain infeksi paru, M. abscessus dapat menginfeksi kulit, jaringan lunak, tulang, dan berbagai bagian tubuh manusia lainnya 4 . Resistensi intrinsik M. abscessus terhadap spektrum antibiotik yang luas tidak hanya mempersulit pengobatan tetapi juga memerlukan penggunaan rejimen multiobat dan terapi yang lama 5 . Ancaman yang ditimbulkan oleh M. abscessus menggarisbawahi kebutuhan mendesak untuk pengembangan alat genetik yang ditujukan untuk identifikasi target obat, menjelaskan mekanisme resistensi, dan memajukan penelitian vaksin.
Sistem Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)-associated protein (Cas) telah banyak diaplikasikan sebagai alat penyuntingan gen yang efisien dalam berbagai organisme 6 . Di antara sistem ini, CRISPR-associated protein 9 (Cas9) dan Cas12a (sebelumnya dikenal sebagai Cpf1) adalah nuklease yang paling umum digunakan dan penting 7 , 8 . Dipandu oleh CRISPR-RNA yang sesuai, Cas9 dan Cpf1 dapat secara tepat mengenali dan mengikat urutan DNA target. Proses ini bergantung pada pasangan basa komplementer antara CRISPR-RNA dan urutan DNA target. Setelah cocok, nuklease efektor CRISPR menginduksi double-strand breaks (DSB) di lokus yang ditunjuk dalam DNA target. Namun, DSB dapat sangat merugikan organisme karena dapat sangat membahayakan integritas dan stabilitas genom 9 , 10 .
Untuk mengatasi kerusakan ini, organisme telah mengembangkan berbagai jalur untuk memperbaiki DSB 11 . Berbeda dengan prokariota lain, sistem perbaikan DSB pada mikobakteri sangat kompleks dan beragam, menyerupai sistem pada Saccharomyces cerevisiae , dan mencakup komponen perbaikan yang berlebihan 12 . Oleh karena itu, mikobakteri dapat memperbaiki DSB melalui beberapa jalur yang berbeda. Di antara jalur-jalur ini, rekombinasi homolog (HR) adalah proses perbaikan DSB yang paling akurat tetapi membutuhkan templat homolog utuh tambahan. Single-strand annealing (SSA), mekanisme perbaikan DSB lainnya, terutama terjadi dengan adanya urutan pengulangan langsung yang mengapit DSB 13 . Mikobakteri juga memiliki mekanisme perbaikan nonhomologous end-joining (NHEJ). Tidak seperti sistem NHEJ kompleks dalam sel eukariotik, NHEJ mikobakteri hanya terdiri dari dua komponen utama: Ku, protein pengikat DNA yang bertanggung jawab untuk pengikatan ujung dan penjembatan ujung, dan LigD, enzim multifungsi 14 , 15 . Pertama, protein Ku mengikat ujung DNA, dan kemudian LigD memfasilitasi pemrosesan ujung minimal dan secara langsung mengikat ujung yang diproses tanpa memerlukan templat homolog, yang membuat jenis perbaikan ini rawan kesalahan. Melalui jalur perbaikan HR, SSA, atau NHEJ, mikobakteri secara efektif memperbaiki DSB 10 . Aplikasi jalur perbaikan ini, bersama dengan integrasi sistem CRISPR-Cas untuk penyuntingan gen, menjadi semakin populer pada mikobakteri 16 – 20 .
Metode untuk manipulasi genetik mikobakteri terus ditingkatkan 21 . Awalnya, manipulasi genetik seperti ekspresi gp60 dan gp61 dari mikobakteriofage Che9c telah dicapai untuk meningkatkan rekombinasi dalam M. smegmatis, M. tuberculosis 16 , dan M. abscessus 20 . Rekombinasi berbantuan CRISPR selanjutnya memungkinkan konstruksi rekombinan bebas penanda yang efisien dalam mikobakteri 17 . Setelah implikasinya yang sukses dalam M. smegmatis , teknik ini baru-baru ini berhasil diterapkan untuk pertama kalinya dalam M. abscessus oleh kelompok kami 19 . Selain itu, mekanisme perbaikan DSB NHEJ yang tidak bergantung pada templat dan rawan kesalahan menghadirkan potensi untuk manipulasi genetik ketika dikombinasikan dengan CRISPR. Sampai saat ini, pendekatan manipulasi gen CRISPR-NHEJ telah terbukti efektif dalam M. smegmatis dan M. tuberculosis ; Namun, belum ada penelitian yang melaporkan penerapan strategi ini pada M. abscessus sejauh ini 18 .
Bahasa Indonesia: Pada M. marinum , MMAR_4574 , gen yang mengkode gula kinase dari famili fosfofruktokinase tipe B (PfkB), terletak di antara gen ku dan ligD pada kromosom dan disebut sebagai nrgA (gen A terkait NHEJ) 18 . Struktur NrgA baru-baru ini telah dijelaskan 22 , namun, protein ini tidak memiliki homolog pada M. abscessus . Sebuah studi baru-baru ini menunjukkan bahwa pada M. marinum dan M. tuberculosis , mutasi pada nrgA secara signifikan mengurangi efisiensi penyuntingan gen berbasis CRISPR-NHEJ 18 . Hal ini menunjukkan bahwa nrgA mungkin memainkan peran penting dalam jalur perbaikan NHEJ pada M. marinum . Namun, mekanisme spesifiknya masih belum jelas.
Untuk mencapai penghapusan gen yang efisien menggunakan strategi CRISPR-NHEJ pada M. smegmatis dan M. tuberculosis , perlu untuk mengatur sistem HR bawaan mereka 18. Ini dapat dicapai dengan mengekspresikan pengatur negatif recA , recX , atau dengan secara langsung menghapus gen jalur HR utama, recA , untuk menekan atau menghilangkan HR 23 , 24. Dalam kondisi ini, peningkatan signifikan dalam efisiensi penyuntingan gen diamati. Sebaliknya, ketika perbaikan HR tidak diatur, efisiensi penyuntingan gen menggunakan strategi CRISPR-NHEJ sangat rendah. Berdasarkan temuan ini, para peneliti telah menyarankan bahwa HR dan NHEJ adalah jalur kompetitif untuk perbaikan DSB yang diinduksi oleh sistem CRISPR-Cas pada mikobakteri 18 .
Di sini, kami melaporkan untuk pertama kalinya bahwa penyuntingan gen menggunakan strategi CRISPR-NHEJ efisien dalam M. abscessus . Kami juga menemukan bahwa NrgA, komponen sistem NHEJ dalam M. marinum , sangat diperlukan untuk perbaikan DSB yang dimediasi NHEJ yang diinduksi oleh sistem CRISPR-Cas dalam M. abscessus . Selain itu, berdasarkan penelitian sebelumnya, kami menyelidiki dampak recX pada efisiensi penyuntingan gen dari strategi CRISPR-NHEJ dalam M. abscessus dan M. smegmatis dan mengamati hasil yang berbeda. Kami selanjutnya mengeksplorasi hubungan antara tiga jalur perbaikan DSB dalam M. abscessus . Temuan kami menunjukkan interaksi yang kompleks antara ketiga jalur perbaikan ini selama proses perbaikan DSB, yang menyediakan dasar untuk penelitian masa depan untuk lebih menjelaskan peran dan interaksi spesifik mereka.
HASIL
Ekspresi komponen NHEJ M. marinum meningkatkan pengeditan gen CRISPR-Cpf1 pada M. abscessus
Dibandingkan dengan sistem NHEJ kompleks pada eukariota, sistem NHEJ pada M. marinum relatif sederhana, hanya terdiri dari tiga komponen: LigD, Ku, dan NrgA. Telah ditunjukkan bahwa sistem NHEJ endogen pada M. marinum dapat secara efektif memperbaiki DSB yang diinduksi oleh sistem CRISPR-Cas, yang menggarisbawahi potensinya sebagai mekanisme perbaikan yang kuat 18 . Untuk mengeksplorasi kegunaannya dalam meningkatkan penyuntingan gen, pertama-tama kami membuat plasmid, pNHEJ-Cpf1, yang secara bersamaan mengekspresikan CRISPR-Cpf1 dan sistem perbaikan NHEJ M. marinum yang lengkap (Ku, NrgA, LigD) (Gambar S1 ). Dalam plasmid ini, ekspresi Cpf1 diinduksi oleh anhidrotetrasiklin (ATc), sedangkan komponen NHEJ dikendalikan oleh promotor aslinya.
Untuk menyelidiki efek sistem NHEJ M. marinum pada efisiensi penyuntingan gen dalam M. abscessus , kami mentransformasi sel M. abscessus dengan pNHEJ-Cpf1 atau plasmid kontrol pJV53-Cpf1. Dengan tidak adanya induksi asetamida, pJV53-Cpf1 hanya mengekspresikan Cpf1 dalam sel M. abscessus (plasmid yang digunakan dalam penelitian ini tercantum dalam Tabel S1 ). Setelah transformasi, kami memperkenalkan plasmid kedua, pCR-ZEO-3513c, yang mengekspresikan crRNA yang menargetkan gen MAB_3513c (Gambar 1A ). Sistem plasmid ganda ini kemudian digunakan untuk melumpuhkan gen MAB_3513c , dan selanjutnya, perbedaan dalam tingkat kelangsungan hidup dan efisiensi penyuntingan gen diamati. Setelah ditransformasi dengan plasmid pCR-ZEO-3513c, bakteri diinkubasi selama 4–5 jam, sebelum ditanam pada pelat agar 7H11 yang berisi antibiotik yang sesuai dan 200 ng/ml ATc. Pelat yang tidak memiliki ATc digunakan sebagai kontrol. Tingkat kelangsungan hidup didefinisikan sebagai rasio unit pembentuk koloni (CFU) pada pelat yang berisi ATc dengan yang ada pada pelat kontrol tanpa ATc. Tingkat kelangsungan hidup kelompok pNHEJ-Cpf1 (71,00% ± 2,83%) secara signifikan lebih tinggi daripada kelompok pJV53-Cpf1 (47,50% ± 3,54%) ( p = 0,0156, Gambar 1B dan foto pelat untuk kelompok pNHEJ-Cpf1 ditunjukkan pada Gambar S2 ). Ini menunjukkan bahwa ekspresi sistem NHEJ M. marinum memperbaiki beberapa DSB yang disebabkan oleh CRISPR-Cpf1, yang mengarah pada pemulihan koloni parsial. Kami selanjutnya menganalisis efisiensi penyuntingan gen M. abscessus yang diperoleh melalui strategi CRISPR-NHEJ. Koloni tunggal dari pelat yang mengandung ATc dipilih secara acak, dan gen MAB_3513c diperkuat menggunakan pasangan primer Mab_3513c-F/R (Gambar 1C ). Hasil elektroforesis yang disajikan pada Gambar 1D menunjukkan bahwa produk PCR dari koloni tunggal tertentu secara signifikan lebih kecil daripada galur tipe liar atau sama sekali tidak ada. Hasil ini kemungkinan besar disebabkan oleh penghapusan DNA yang luas selama proses perbaikan NHEJ. Namun, ukuran produk PCR dari koloni tunggal tertentu hampir identik dengan galur tipe liar. Ini tidak serta merta menunjukkan bahwa situs target tetap tidak berubah, karena perubahan kecil hanya pada beberapa pasangan basa tidak dapat dengan mudah dideteksi oleh elektroforesis saja. Oleh karena itu, kami melanjutkan dengan mengurutkan koloni tunggal ini. Hasil sekuensing untuk situs target yang diubah ditunjukkan pada Gambar 1E (data sekuensing mentah dapat ditemukan pada Gambar S3). Selain delesi fragmen besar yang dapat dilihat dari hasil PCR, beberapa koloni tunggal, seperti koloni 4, 17, 20, 21, dan 29, hanya menunjukkan beberapa delesi pasangan basa. Delesi fragmen DNA ini, yang bukan kelipatan tiga, mengakibatkan mutasi frameshift yang akhirnya menyebabkan inaktivasi gen sebagian atau lengkap. Analisis statistik mengungkapkan bahwa efisiensi penyuntingan gen mencapai 63,35% ± 4,74% untuk menyingkirkan gen MAB_3513c menggunakan strategi CRISPR-NHEJ. Sebaliknya, tidak ada koloni tunggal yang dipilih secara acak dari kelompok pJV53-Cpf1 yang menunjukkan bukti penyuntingan gen (Gambar 1B ). Ini menunjukkan bahwa sistem perbaikan NHEJ endogen dalam M. abscessus tidak efektif dalam memperbaiki DSB yang disebabkan oleh CRISPR-Cpf1. Namun, ketika sistem NHEJ M. marinum eksogen diekspresikan, hal itu memfasilitasi perbaikan DSB yang rentan kesalahan yang diinduksi oleh CRISPR-Cpf1.
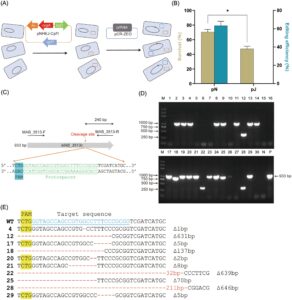
Setelah berhasil menyingkirkan gen MAB_3513c menggunakan strategi CRISPR-NHEJ, kami bermaksud menilai penerapan metode ini secara lebih luas dengan menargetkan gen-gen tambahan pada M. abscessus . Hingga saat ini, kami telah berhasil menyingkirkan lebih dari 30 gen pada M. abscessus (Tabel S2 ). Dibandingkan dengan metode yang ada, pendekatan ini telah meningkatkan efisiensi pembuatan mutan M. abscessus secara signifikan.
NrgA berperan sebagai faktor krusial dalam memperbaiki DSB yang diinduksi CRISPR-Cas melalui NHEJ di M. abscessus
Meskipun M. abscessus memiliki sistem perbaikan NHEJ endogennya sendiri, temuan kami menunjukkan bahwa sistem ini tidak efektif untuk memperbaiki DSB yang diinduksi oleh sistem CRISPR-Cpf1. Perbaikan DSB yang efektif pada M. abscessus memerlukan pengenalan sistem perbaikan NHEJ eksogen dari M. marinum .
Dibandingkan dengan sistem perbaikan NHEJ M. abscessus , sistem NHEJ M. marinum tidak hanya mencakup LigD dan Ku tetapi juga NrgA (Gambar 2A ). Pada M. marinum , NrgA telah terbukti meningkatkan efisiensi penyuntingan gen yang dimediasi CRISPR-NHEJ 18. Dengan demikian, dua faktor dapat menjelaskan perlunya memperkenalkan sistem NHEJ M. marinum ke dalam M. abscessus : perbedaan LigD dan Ku antara kedua spesies dan keberadaan faktor NrgA tambahan pada M. marinum .
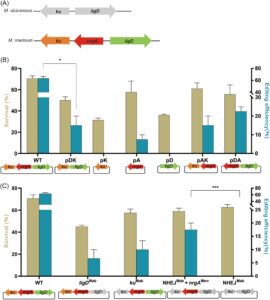
Untuk menyelidiki hal ini, kami membuat plasmid yang mengandung berbagai kombinasi komponen NHEJ M. marinum , khususnya ku , nrgA , ligD , ku+nrgA , nrgA+ligD , atau ligD+ku beserta Cpf1. Plasmid ini masing-masing diberi nama pK-Cpf1, pA-Cpf1, pD-Cpf1, pAK-Cpf1, pDA-Cpf1, dan pDK-Cpf1. Kami kemudian menganalisis tingkat kelangsungan hidup dan efisiensi penyuntingan gen pada galur M. abscessus yang membawa plasmid ini setelah penyuntingan gen CRISPR-NHEJ.
Dibandingkan dengan kelompok pNHEJ-Cpf1, galur M. abscessus yang mengandung plasmid dengan hanya sebagian komponen NHEJ M. marinum menunjukkan tingkat kelangsungan hidup yang berkurang, yang menunjukkan penurunan jumlah koloni tunggal yang diperoleh melalui perbaikan NHEJ (Gambar 2B ). Analisis lebih lanjut tentang efisiensi penyuntingan gen mengungkapkan bahwa galur yang mengekspresikan M. marinum ku dan ligD secara bersamaan menunjukkan pengurangan yang signifikan dalam efisiensi penyuntingan gen dibandingkan dengan kelompok pNHEJ-Cpf1, hanya mencapai 15,00% ± 7,07% ( p = 0,0151). Galur yang mengekspresikan ku atau ligD saja gagal menghasilkan koloni yang diedit.
Menariknya, dalam kelompok yang hanya mengekspresikan M. marinum nrgA , sekitar 7,50% ± 3,54% koloni tunggal menunjukkan penyuntingan gen yang berhasil. Ini menunjukkan bahwa sistem NHEJ endogen M. abscessus mungkin menunjukkan efisiensi terbatas dalam memperbaiki DSB yang disebabkan oleh sistem CRISPR-Cpf1 dengan adanya NrgA. Dibandingkan dengan kelompok NrgA, dalam kelompok yang mengekspresikan M. marinum nrgA bersama ku atau ligD , efisiensi penyuntingan gen meningkat menjadi 15,00% ± 7,07% dan 22,50% ± 3,53%, berturut-turut. Hasil ini menunjukkan bahwa NrgA memfasilitasi proses perbaikan dan bahwa Ku dan LigD eksogen sebagian dapat melengkapi sistem NHEJ endogen dalam M. abscessus (Gambar 2B ).
Untuk menyelidiki lebih lanjut perbedaan dalam tingkat kelangsungan hidup dan efisiensi penyuntingan gen, kami mengganti komponen NHEJ M. marinum dengan komponen padanannya dari M. abscessus . Plasmid dibuat dengan mengandung berbagai kombinasi komponen NHEJ M. abscessus dan M. marinum : pNHEJ-Cpf1 ( ligD Mab ), pNHEJ-Cpf1 ( ku Mab ), pNHEJ-Cpf1 (NHEJ Mab + nrgA Mmr ), dan plasmid yang hanya mengandung komponen NHEJ M. abscessus tanpa nrgA M. marinum , pNHEJ-Cpf1 (NHEJ Mab ). Percobaan penyuntingan gen dilakukan pada galur M. abscessus yang membawa plasmid ini.
Tingkat kelangsungan hidup dan efisiensi penyuntingan gen dalam kelompok yang membawa plasmid ini secara konsisten lebih rendah daripada yang diamati pada galur yang mengekspresikan plasmid pNHEJ-Cpf1 yang mengandung sistem NHEJ M. marinum yang lengkap (Gambar 2C ). Khususnya, efisiensi penyuntingan gen dalam kelompok di mana ligD dan ku dari M. marinum digantikan dengan ligD dan ku dari M. abscessus (17,50% ± 3,54%) lebih tinggi daripada yang ada dalam kelompok di mana hanya ligD (6,65% ± 4,72%) atau ku (10,00% ± 4,71%) dari M. marinum digantikan dengan komponen M. abscessus masing-masing . Hasil ini menunjukkan bahwa efisiensi knockout gen yang tinggi membutuhkan LigD dan Ku untuk berasal dari spesies bakteri yang sama. Ini juga menjelaskan efisiensi penyuntingan gen yang sedikit berkurang yang diamati pada galur M. abscessus yang mengekspresikan komponen NHEJ campuran dibandingkan dengan yang hanya mengekspresikan komponen M. marinum . Penurunan efisiensi perbaikan NHEJ yang diamati dengan meningkatnya proporsi komponen NHEJ campuran menyoroti pentingnya kompatibilitas antara LigD dan Ku dari spesies yang sama (Gambar 2B,C ). Lebih jauh lagi, tidak ada koloni tunggal yang menunjukkan penyuntingan gen yang ditargetkan yang diamati dalam kelompok NHEJ Mab ( p < 0,001), berbeda dengan kelompok NHEJ Mab + nrgA Mmr , yang selanjutnya mengonfirmasi peran penting nrgA Mmr , yang tidak ada dalam M. abscessus , dalam memfasilitasi perbaikan NHEJ dan mencapai penyuntingan gen yang efisien dalam M. abscessus .
Penghambatan HR secara berbeda mempengaruhi efisiensi penyuntingan gen CRISPR-NHEJ pada M. smegmatis dan M. abscessus
Penelitian sebelumnya telah menunjukkan bahwa penghambatan HR pada M. smegmatis secara signifikan meningkatkan efisiensi penyuntingan CRISPR-NHEJ, yang menunjukkan adanya hubungan kompetitif antara HR dan NHEJ selama proses perbaikan DSB pada organisme ini 18 . Sebaliknya, pada M. abscessus , kami mencapai penyuntingan gen yang efisien menggunakan strategi CRISPR-NHEJ tanpa ekspresi tambahan recX . Hasil yang kontras antara M. smegmatis dan M. abscessus mendorong penyelidikan lebih lanjut.
Kami pertama kali mengevaluasi dampak recX pada efisiensi penyuntingan gen CRISPR-NHEJ pada M. smegmatis . Secara khusus, kami menilai perbaikan NHEJ pada DSB yang diinduksi oleh dua protein efektor CRISPR yang berbeda (Cas9 dan Cpf1) di bawah pengaruh recX pada M. smegmatis . Ketika menggunakan Cas9 sebagai protein efektor, efisiensi penyuntingan gen pada kelompok tanpa ekspresi recX adalah 49,45% ± 14,92%, sedangkan efisiensi penyuntingan gen dengan recX adalah 60,00% ± 14,14%, tidak menunjukkan perbedaan yang signifikan ( p = 0,5434, Gambar 3A ). Dalam kasus penggunaan Cpf1 sebagai protein efektor, efisiensi penyuntingan gen dalam kelompok tanpa recX adalah 78,35% ± 11,81%, dan dengan recX , adalah 85,00% ± 7,07%, yang juga tidak menunjukkan perbedaan signifikan ( p = 0,5650, Gambar 3 ). Temuan ini menunjukkan bahwa dalam M. smegmatis , kita dapat mencapai penyuntingan gen efisiensi tinggi tanpa memerlukan ekspresi recX tambahan atau manipulasi sistem HR inang, yang secara signifikan berbeda dari hasil yang dilaporkan sebelumnya 18 .
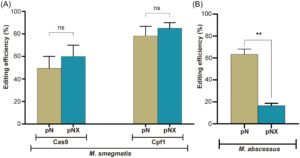
Dalam M. abscessus , penelitian pendahuluan kami juga menunjukkan bahwa penyuntingan gen berbasis CRISPR-NHEJ efisiensi tinggi tidak memerlukan ekspresi recX tambahan . Kami selanjutnya mengamati efek dari ekspresi berlebihan recX pada efisiensi penyuntingan gen dari strategi CRISPR-Cpf1-NHEJ di M. abscessus . Anehnya, dengan ekspresi berlebihan recX , efisiensi penyuntingan gen menurun secara signifikan menjadi hanya 16,55% ± 2,19%, sekitar 1/4 dari efisiensi asli (Gambar 3B ). Hasil ini sangat menyarankan bahwa, di M. abscessus , menghambat HR berdampak negatif pada efisiensi perbaikan yang dimediasi NHEJ selama proses perbaikan DSB.
Jalur perbaikan DSB—NHEJ, HR, dan SSA pada M. abscessus —ada dalam keseimbangan dinamis
Dalam mikobakteri, jalur perbaikan DSB tidak hanya mencakup HR dan NHEJ tetapi juga SSA. Sementara penelitian sebelumnya telah mengeksplorasi pengaruh SSA pada efisiensi HR dalam mikobakteri 25 , efek potensial SSA pada NHEJ belum diselidiki secara memadai. Untuk mengatasi kesenjangan ini, kami memeriksa apakah mengganggu HR atau SSA memengaruhi efisiensi penyuntingan gen yang bergantung pada NHEJ dalam M. abscessus . Dengan menggunakan rekombinasi berbantuan CRISPR seperti yang dijelaskan dalam penelitian kami sebelumnya 19 , kami membangun strain penghapusan in-frame knockout bebas penanda seleksi yang menargetkan gen recA , ruvB , recC , recO , ligD , dan ku . RecA memainkan peran penting dalam HR, khususnya pada tahap inisiasi perbaikan, sedangkan RuvB memfasilitasi migrasi cabang dari sambungan Holliday, memastikan perbaikan DSB yang akurat 26 – 28 . Kompleks RecBCD, termasuk RecC, penting untuk SSA dan tidak bergantung pada HR yang dimediasi RecA 13 . Selain itu, RecO berpartisipasi dalam jalur HR dan SSA 29 , 30 . LigD dan Ku adalah dua komponen inti dari sistem perbaikan NHEJ endogen di M. abscessus .
Kami melakukan percobaan penyuntingan gen pada galur-galur perbaikan HR, SSA, atau NHEJ endogen ini untuk mengamati efek gangguan jalur perbaikan ini pada efisiensi penyuntingan gen. Efisiensi penyuntingan gen adalah 3,33% ± 2,88%, 22,50% ± 3,54%, 17,50% ± 3,54%, dan 7,50% ± 3,54% pada galur knockout recA , ruvB , recC, atau recO , masing-masing (Gambar 4A ). Seperti yang diharapkan, efisiensi penyuntingan gen pada galur knockout recA secara signifikan lebih rendah daripada pada galur tipe liar ( p = 0,0004). Demikian pula, efisiensi penyuntingan gen pada galur-galur yang kehilangan gen ruvB , recC, atau recO berkurang secara signifikan dibandingkan dengan galur tipe liar ( masing-masing p = 0,0103, p = 0,0082, dan p = 0,0056, Gambar 4A ). Semua hasil ini menegaskan bahwa gangguan pada jalur perbaikan HR atau SSA akan menurunkan efisiensi penyuntingan gen yang dimediasi NHEJ dengan bantuan CRISPR-Cas12a.
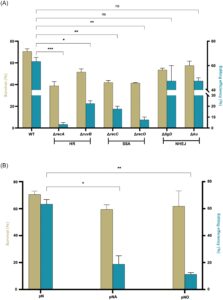
Sebaliknya, galur knockout ligD dan ku menunjukkan efisiensi penyuntingan gen masing-masing sebesar 47,50% ± 17,68% dan 47,50% ± 3,54%. Meskipun perbedaan efisiensi penyuntingan antara galur ini dan galur tipe liar tidak signifikan, tetap saja ada sedikit penurunan (Gambar 4A ). Hal ini sejalan dengan temuan kami sebelumnya, yang menunjukkan bahwa sistem NHEJ endogen dalam M. abscessus dapat mengelola perbaikan DSB efisiensi rendah ketika hanya nrgA yang diperkenalkan (Gambar 2B ). Oleh karena itu, knockout ligD atau ku menghilangkan kapasitas perbaikan yang bergantung pada NHEJ endogen ini, sehingga menghasilkan sedikit penurunan efisiensi penyuntingan gen dibandingkan dengan galur tipe liar.
Menariknya, efisiensi penyuntingan strain knockout diperingkat sebagai berikut: recA (HR) ≤ recO (HR & SSA) ≤ recC (SSA) ≤ ruvB (HR). Perbedaan signifikan dalam efisiensi penyuntingan diamati antara recA dan recC ( p = 0,0156) dan antara recA dan ruvB ( p = 0,0067). Ini menunjukkan bahwa efisiensi penyuntingan gen yang bergantung pada NHEJ dipengaruhi secara berbeda oleh gen-gen spesifik dalam jalur perbaikan DSB HR dan SSA. Gen-gen yang terlibat dalam inisiasi perbaikan HR mungkin memiliki dampak yang lebih besar pada efisiensi penyuntingan dibandingkan dengan yang terlibat di kemudian hari dalam proses tersebut. Lebih jauh lagi, gen-gen yang berpartisipasi dalam jalur-jalur HR mungkin memberikan pengaruh yang lebih kuat pada efisiensi penyuntingan daripada yang hanya memengaruhi SSA. Sementara recO dapat memengaruhi HR dan SSA, ia terutama memengaruhi jalur cabang HR, tidak seperti recA , yang memainkan peran sentral dalam HR 28 , 30 , 31 .
Berdasarkan hasil di atas, kami menemukan bahwa menghambat jalur HR dan SSA di M. abscessus menyebabkan penurunan signifikan dalam efisiensi perbaikan NHEJ. Hal ini menimbulkan pertanyaan apakah peningkatan jalur HR atau SSA dapat meningkatkan efisiensi perbaikan NHEJ. Untuk menguji hipotesis ini, kami selanjutnya mengekspresikan gen recA dan recO secara berlebihan dan mengulangi percobaan penyuntingan gen. Bertentangan dengan harapan kami, mengekspresikan recA atau recO secara berlebihan tidak meningkatkan efisiensi penyuntingan gen yang bergantung pada NHEJ. Sebaliknya, dalam kelompok yang mengekspresikan recA dan recO secara berlebihan, efisiensi penyuntingan gen menurun secara signifikan masing-masing sebesar 18,75% ± 8,84% dan 11,25% ± 1,77%, dibandingkan dengan galur tipe liar (Gambar 4B ).
Hasil ini menunjukkan bahwa peningkatan atau penghambatan berlebihan pada jalur HR atau SSA menyebabkan penurunan efisiensi pengeditan berbasis NHEJ. Penurunan ini mungkin disebabkan oleh terganggunya keseimbangan yang rumit antara jalur perbaikan HR, SSA, dan NHEJ. Singkatnya, alih-alih berfungsi sebagai mekanisme yang terisolasi atau bersaing, HR, SSA, dan NHEJ berinteraksi secara dinamis selama perbaikan DSB, mempertahankan keadaan keseimbangan yang penting untuk proses perbaikan yang efisien.
DISKUSI
M. abscessus , NTM yang lazim, telah muncul sebagai masalah kesehatan global yang signifikan karena meningkatnya insidensi dan resistensi intrinsik terhadap banyak antibiotik yang umum digunakan, yang secara signifikan membatasi efektivitas rejimen pengobatan saat ini, yang membuat infeksi yang disebabkan oleh M. abscessus sangat sulit diobati dan menimbulkan ancaman serius bagi kesehatan masyarakat 5 , 32 . Masalah resistensi obat yang berkembang tidak hanya menyoroti keterbatasan terapi antimikroba yang ada tetapi juga menggarisbawahi kebutuhan mendesak untuk mempercepat pengembangan strategi pengobatan baru. Pemahaman yang komprehensif tentang mekanisme resistensi dan target obat M. abscessus sangat penting untuk merancang obat dan rejimen terapi yang lebih efektif. Oleh karena itu, mengembangkan alat manipulasi genetika canggih untuk menghasilkan strain knockout gen M. abscessus dengan cepat dan efisien adalah sangat penting 33 , 34 .
Metode berbasis rekombinasi tradisional untuk penyuntingan gen dalam M. abscessus terhalang oleh beberapa keterbatasan, termasuk efisiensi rendah, ketergantungan pada templat homolog, dan potensi untuk memperkenalkan bekas luka genom. Kendala ini membatasi pembuatan cepat sejumlah besar mutan knockout 16 . Sebaliknya, strategi CRISPR-Cas12a-NHEJ yang kami kembangkan menawarkan peningkatan yang nyata, mencapai efisiensi penyuntingan gen yang melebihi 60% untuk gen MAB_3513c dan berkisar antara 40% hingga 90% di lebih dari 30 gen target. Pendekatan ini mempercepat laju penelitian pada M. abscessus dengan mengatasi keterbatasan metode konvensional. Yang penting, pendekatan ini menghasilkan mutan dengan penghapusan berbagai panjang di sekitar situs target, memfasilitasi pemilihan galur dengan mutasi spesifik sesuai dengan persyaratan eksperimental.
Temuan kami juga menggarisbawahi peran penting NrgA dalam proses perbaikan NHEJ. Tidak seperti M. marinum , yang memiliki LigD, Ku, dan NrgA, sistem NHEJ di M. abscessus tidak memiliki NrgA. Sebuah studi sebelumnya telah menunjukkan bahwa NrgA meningkatkan efisiensi perbaikan NHEJ di M. marinum dan M. tuberculosis , yang menunjukkan peran pentingnya dalam memperbaiki DSB yang diinduksi CRISPR-Cas 18. Eksperimen kami mengonfirmasi hipotesis ini, menunjukkan bahwa NrgA dapat bersinergi dengan sistem NHEJ endogen di M. abscessus untuk memungkinkan pengeditan gen efisiensi rendah. Selain itu, menggabungkan komponen NHEJ dari sumber yang berbeda (misalnya, M. abscessus LigD dan Ku dengan M. marinum NrgA) menghasilkan efisiensi pengeditan yang menurun secara signifikan dibandingkan dengan mengekspresikan sistem NHEJ M. marinum yang lengkap . Hal ini menyoroti pentingnya kompatibilitas di antara komponen perbaikan DSB dalam mencapai perbaikan NHEJ yang efisien.
Aspek penting lain yang perlu dipertimbangkan adalah tingkat kelangsungan hidup. Ketika sistem perbaikan NHEJ M. marinum lengkap diperkenalkan, tingkat pemulihan koloni meningkat secara signifikan dibandingkan dengan kelompok pJ (Gambar 1B ). Namun, perubahan dalam tingkat kelangsungan hidup tidak secara langsung berhubungan dengan perubahan dalam efisiensi penyuntingan gen. Khususnya, dalam M. abscessus , tidak ada modifikasi pada situs target yang diamati sebelum pengenalan sistem perbaikan NHEJ M. marinum , terlepas dari apakah perbaikan DSB dimediasi oleh HR endogen, SSA, atau NHEJ. Setelah memperkenalkan sistem perbaikan NHEJ atau komponen-komponennya, baik peran perbaikan independen dari NHEJ eksogen dan interaksinya dengan jalur perbaikan DSB endogen harus dipertimbangkan. Kompleksitas ini sejalan dengan temuan dari penelitian sebelumnya, yang telah menunjukkan bahwa memperkenalkan sistem NHEJ mikobakteri ke dalam mikobakteri atau bakteri lain menginduksi interaksi antara NHEJ eksogen dan mekanisme perbaikan endogen 18 , 35 . Di bawah pengaruh sistem NHEJ M. marinum eksogen yang lengkap , proses perbaikan yang awalnya dikelola oleh perbaikan DSB endogen menjadi dapat dimodifikasi di lokasi target, sehingga menghasilkan peningkatan efisiensi penyuntingan gen. Kompleksitas ini mungkin berkontribusi pada kurangnya korelasi ketat antara tingkat kelangsungan hidup dan efisiensi penyuntingan gen.
Menariknya, kelompok tertentu menunjukkan tingkat kelangsungan hidup yang tinggi meskipun efisiensi penyuntingan gen rendah (Gambar 2B ). Pengamatan ini konsisten dengan penelitian sebelumnya di mana efisiensi penyuntingan gen bervariasi secara signifikan bahkan di antara kelompok dengan tingkat kelangsungan hidup yang sama 18 . Kelompok yang hanya mengekspresikan komponen NHEJ parsial dari M. marinum atau M. abscessus kemungkinan mengalami peningkatan kelangsungan hidup karena komponen-komponen ini mendukung perbaikan DSB endogen, tetapi penyuntingan gen yang efektif tidak tercapai. Selain itu, stabilitas sistem CRISPR-Cas sendiri dapat memengaruhi hasil ini. Mutasi dalam urutan protein efektor CRISPR atau urutan kaset sgRNA dapat memungkinkan kelangsungan hidup koloni tanpa memperkenalkan modifikasi di situs target. Hipotesis ini didukung oleh penelitian sebelumnya tentang strategi CRISPR-NHEJ di Escherichia coli 36 . Dalam penelitian masa depan, pengurutan gen protein efektor CRISPR dan kaset sgRNA dari koloni yang bertahan hidup dapat memvalidasi hipotesis ini.
Temuan kunci dari studi ini adalah keseimbangan dinamis di antara tiga jalur perbaikan DSB—HR, SSA, dan NHEJ—di M. abscessus . Tidak seperti studi sebelumnya yang menunjukkan persaingan di antara jalur-jalur ini 18 , 25 , hasil kami menunjukkan potensi interaksi sinergis. Awalnya, kami mengamati bahwa mengganggu HR tidak memengaruhi efisiensi penyuntingan gen NHEJ yang dibantu CRISPR-Cas12a atau CRISPR-Cas9 di M. smegmatis (Gambar 3A ), sebuah temuan yang konsisten dengan studi sebelumnya yang menunjukkan bahwa gangguan HR tidak meningkatkan efisiensi perbaikan DSB yang dimediasi NHEJ di M. smegmatis 13 . Di M. abscessus , hasil utama kami menunjukkan bahwa strategi CRISPR-NHEJ dapat berhasil diterapkan untuk penyuntingan gen yang efisien tanpa menghambat jalur HR. Namun, penyelidikan lebih lanjut mengungkapkan bahwa galur M. abscessus yang kekurangan HR atau SSA menunjukkan penurunan efisiensi penyuntingan gen berbasis NHEJ secara signifikan, yang menunjukkan adanya interaksi sinergis antara HR, SSA, dan NHEJ. Temuan serupa telah dilaporkan pada Halomonas bluephagenesis , di mana penghambatan HR menyebabkan penurunan tajam dalam efisiensi penyuntingan gen yang dimediasi NHEJ 35 .
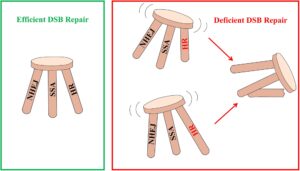
Menariknya, ekspresi berlebihan gen jalur HR atau SSA kunci, seperti recA atau recO , di M. abscessus juga mengakibatkan penurunan signifikan dalam efisiensi NHEJ. Hasil ini menunjukkan bahwa aktivitas berlebihan jalur HR atau SSA dapat menghambat perbaikan NHEJ, menyoroti pentingnya keseimbangan yang halus di antara ketiga jalur perbaikan DSB. Kami mengusulkan bahwa HR, SSA, dan NHEJ di M. abscessus berfungsi dalam keseimbangan dinamis, mirip dengan bangku berkaki tiga: perbaikan DSB yang efisien dicapai hanya ketika ketiga jalur seimbang, sementara gangguan keseimbangan ini menyebabkan perbaikan DSB yang tidak efisien (Gambar 5 ). Studi masa depan dapat mengeksplorasi penggunaan promotor dengan kekuatan yang bervariasi untuk memodulasi aktivitas HR atau SSA, memberikan wawasan lebih jauh tentang bagaimana jalur ini memengaruhi efisiensi perbaikan NHEJ.
Struktur ujung DSB juga kemungkinan memengaruhi interaksi di antara ketiga jalur dan memengaruhi hasil perbaikan. Misalnya, Cpf1 menghasilkan DSB dengan overhang 5′, sedangkan Cas9 menghasilkan ujung tumpul 7 . Jalur dan hasil perbaikan NHEJ pada DSB bergantung pada struktur ujung DNA yang rusak 37 . Pemrosesan berbagai jenis ujung DNA dapat melibatkan interaksi kompleks di antara HR, SSA, dan NHEJ. Perbedaan dalam struktur ujung DNA ini dapat memengaruhi preferensi dan interaksi di antara jalur perbaikan HR, SSA, dan NHEJ 13 . Semua faktor ini berpotensi memengaruhi interaksi di antara ketiga sistem perbaikan DSB. Menyelidiki interaksi ini lebih lanjut akan meningkatkan pemahaman kita tentang peran mereka dalam pengeditan gen berbantuan CRISPR di berbagai spesies mikobakteri.
Sebagai kesimpulan, kami berhasil menunjukkan penerapan strategi CRISPR-Cas12a-NHEJ untuk penyuntingan gen yang efisien dalam M. abscessus untuk pertama kalinya. Temuan kami menyoroti peran penting NrgA dalam proses perbaikan NHEJ dan mengungkap interaksi kompleks di antara berbagai jalur perbaikan dalam M. abscessus . Penemuan ini tidak hanya menantang perspektif yang telah ditetapkan sebelumnya tetapi juga memberikan wawasan baru untuk memajukan manipulasi genetik dalam M. abscessus dan mikobakteri lainnya. Dengan memperdalam pemahaman kita tentang mekanisme perbaikan ini, pekerjaan ini meletakkan dasar untuk mengembangkan alat penyuntingan gen yang lebih efektif, yang pada akhirnya berkontribusi pada upaya penelitian yang ditujukan untuk memerangi resistensi antibiotik dan penyakit menular.
BAHAN DAN METODE
Strain, media, dan kondisi pertumbuhan
Galur E. coli Trans1-T1 yang tumbuh dalam medium LB digunakan untuk kloning molekuler dan manipulasi plasmid. M. abscessus GZ002 (nomor akses NCBI GenBank: CP034181) 38 , 39 dan galur turunannya beserta M. smegmatis MC 2 155 diawetkan oleh laboratorium kami. Kultur cair M. abscessus dan M. smegmatis tumbuh dalam medium 7H9 yang dilengkapi dengan 10% asam oleat-albumin-dekstrosa-katalase (OADC) dan 0,05% Tween80, sedangkan kultur padat tumbuh pada medium 7H11 yang dilengkapi dengan 10% OADC dan 0,05% Tween80 setelah elektroporasi. Konsentrasi kerja anhidrotetrasiklin, kanamisin, dan zeosin masing-masing adalah 200 ng/ml, 100 μg/ml, dan 30 μg/ml untuk M. abscessus dan 50 ng/ml, 50 μg/ml, dan 30 μg/ml untuk M. smegmatis .
Konstruksi plasmid
Primer yang digunakan untuk konstruksi plasmid dalam penelitian ini tercantum dalam Tabel S3 . Plasmid yang terkait dengan sistem penyuntingan gen CRISPR-Cpf1-NHEJ meliputi pCR-Zeo, pNHEJ-Cpf1, pDK-Cpf1, pK-Cpf1, pA-Cpf1, pD-Cpf1, pAK-Cpf1, pDA-Cpf1, pNHEJ-Cpf1 ( ligD Mab ), pNHEJ-Cpf1 ( ku Mab ), pNHEJ-Cpf1 (NHEJ Mab + nrgA Mmr ), pNHEJ-Cpf1 (NHEJ Mab ), pNHEJX Mab -Cpf1, dan pNHEJX Msm -Cpf1. Plasmid yang terkait dengan sistem penyuntingan gen CRISPR-Cas9-NHEJ meliputi pZEO2085, pNHEJ-SacB, dan pNHEJ-SacBX Msm . Urutan pengkodean cpf1 berasal dari plasmid pJV53-Cpf1. Komponen NHEJ dari M. abscessus dan M. marinum serta recX dari M. abscessus dan M. smegmatis atau recA dan recO dari M. abscessus diperkuat menggunakan primer yang sesuai dan diligasikan ke dalam tulang punggung plasmid yang mengandung cpf1 melalui metode rekombinasi. Urutan crRNA atau sgRNA disintesis sebagai pasangan primer, dianil, dan diligasikan ke dalam plasmid pCR-Zeo atau pZEO2085 yang dilinearisasi.
Pengeditan gen pada M. abscessus dan M. smegmatis
M. abscessus dan strain turunannya atau M. smegmatis yang membawa plasmid masing-masing dikultur dalam labu goyang yang berisi 40 ml medium 7H9 lengkap pada suhu 37°C, 200 rpm, hingga OD 600 = 0,8−1,0. Kultur bakteri kemudian dipanen untuk persiapan sel kompeten seperti yang dijelaskan sebelumnya 40 . Sekitar 500 ng plasmid yang mengekspresikan RNA pemandu (primer untuk membangun crRNA tercantum dalam Tabel S1 ) dicampur dengan 100 μl sel kompeten, dipindahkan ke kuvet elektroporasi 2 mm, dan diinkubasi di atas es selama 10 menit. Elektroporasi dilakukan dengan menggunakan tegangan 2500 V, kapasitansi 25 μF, dan resistansi 1000 Ω. Setelah elektroporasi, 2 ml medium 7H9 ditambahkan ke kuvet elektroporasi untuk menangguhkan kembali bakteri, yang kemudian dipindahkan ke tabung 50 ml dan diinkubasi pada 30°C selama 4−5 jam untuk memfasilitasi pemulihan. Kemudian, kultur ditanam secara terpisah pada agar 7H11 yang dilengkapi dengan antibiotik dan ATc yang sesuai dan diinkubasi pada 30°C. Efisiensi penyuntingan dihitung dengan mengukur proporsi koloni dengan mutasi pada situs target di antara total klon yang dipilih secara acak. Tingkat kelangsungan hidup didefinisikan sebagai rasio jumlah CFU yang diperoleh dari pelat yang berisi ATc dengan jumlah CFU yang diperoleh dari pelat tanpa ATc. Untuk setiap penilaian, setidaknya 20 koloni dipilih secara acak untuk PCR (primer ditunjukkan pada Tabel S1 ) dan analisis sekuensing. Koloni yang tidak memiliki pita target dalam PCR atau menunjukkan hasil sekuensing yang menyimpang dari sekuens tipe liar diidentifikasi sebagai yang diedit.
