ABSTRAK
Kofaktor metalloenzim dan kondisi oksigen sangat penting untuk metabolisme mikroba, namun efek gabungannya pada ekosistem mikroba masih belum dieksplorasi. Studi ini mengeksplorasi dampak amandemen mikronutrien (Zn, Fe, Co dan kombinasinya) pada komposisi komunitas mikroba di perairan teroksigenasi (73 m) dan terdeoksigenasi (200 m) di Laut Arab. Melalui eksperimen mikrokosmos terkontrol dan sekuensing amplikon 16S rRNA, kami mengamati bahwa mikronutrien secara signifikan mengubah konsentrasi nutrisi dan dinamika mikroba. Pada kedalaman 73 m, perlakuan mikronutrien mengurangi kadar nitrat, nitrit dan amonia, sedangkan pada kedalaman 200 m, meningkatkan kadar nitrat dan silikat. Jumlah total bakteri (TBC) lebih tinggi di semua perlakuan pada kedua kedalaman, dengan Fe menunjukkan jumlah tertinggi. Keragaman alfa menunjukkan bahwa labu yang diberi amandemen Fe meningkatkan keragaman mikroba paling banyak pada kedalaman 73 m, sedangkan perlakuan campuran memiliki efek yang nyata pada kedalaman 200 m. Analisis taksonomi mengungkap variasi tingkat genus yang signifikan pada bakteri dan archaea. Analisis varians satu arah (ANOVA) mengonfirmasi dampak mikronutrien pada nutrisi dan TBC. Analisis korespondensi kanonik (CCA) dan penskalaan multidimensi nonmetrik (NMDS) mengungkap pengelompokan yang berbeda berdasarkan kondisi oksigen. Hasil ini mengonfirmasi hipotesis kami bahwa amandemen mikronutrien dalam berbagai tingkat oksigen secara jelas mengubah komposisi komunitas mikroba dan siklus nutrisi di lingkungan laut.
Abstrak Grafis
Percobaan mikrokosmos dan sekuensing amplikon 16S rRNA menunjukkan bahwa mikronutrien (Zn, Fe, Co) atau kombinasinya (Zn + Fe + Co) secara signifikan memengaruhi konsentrasi nutrisi dan dinamika mikroba di perairan Laut Arab yang teroksigenasi (73 m) dan terdeoksigenasi (200 m). Temuan kami menyoroti bahwa Fe sangat berdampak, meningkatkan keanekaragaman mikroba dan jumlah total bakteri, terutama dalam kondisi teroksigenasi, sementara perlakuan mikronutrien campuran memiliki efek paling signifikan pada kedalaman terdeoksigenasi.
1 Pendahuluan
Mikroorganisme sangat penting dalam lingkungan laut yang berkontribusi secara signifikan terhadap proses ekologi dan siklus biogeokimia global. Mereka meliputi beragam taksa yang secara kolektif membentuk dinamika ekosistem laut (Falkowski, Fenchel, dan Delong 2008 ). Mikroorganisme laut sangat penting untuk siklus nutrisi, karena mereka berpartisipasi dalam proses seperti fiksasi nitrogen, denitrifikasi dan penyerapan karbon (Azam dan Malfatti 2007 ). Mikrobiota autotrofik juga penting untuk produksi primer melalui fotosintesis yang berkontribusi secara signifikan terhadap produksi oksigen (O 2 ) global (Worden et al. 2015 ). Lebih jauh lagi, mikrobiota laut memainkan peran penting dalam memungkinkan fungsi ekosistem dengan membentuk hubungan simbiosis dengan organisme akuatik lainnya, baik makro maupun mikro, di berbagai tingkat trofik, sehingga mempertahankan pertukaran nutrisi (Wommack dan Ravel 2013 ).
Struktur dan komposisi komunitas mikroba dipengaruhi oleh berbagai faktor lingkungan, termasuk ketersediaan mikronutrien dan kondisi oksigen (Zhang et al. 2018 ). Dalam ekosistem laut, mikroba memediasi reaksi redoks utama yang bertanggung jawab untuk mengubah energi dan materi melalui aktivitas enzimatik yang terlibat dalam jalur metabolisme utama (Falkowski, Fenchel, dan Delong 2008 ). Banyak dari enzim utama tersebut mengandung/bergantung pada mikronutrien/logam jejak, yang menjelaskan mengapa logam tersebut penting bagi kehidupan mikroba di laut (Morel dan Price 2003 ). Karena kelarutannya yang rendah, konsentrasi logam di laut biasanya minimal, dengan ketersediaannya menurun tajam dalam jarak pendek dari pantai (Johnson, Gordon, dan Kenneth 1997 ). Mikroba planktonik memainkan peran penting dalam siklus biogeokimia sebagian besar logam laut yang esensial. Namun, logam-logam ini juga mengatur sebagian pertumbuhan mikroba ini dan siklus karbon (C) dan nitrogen (N) yang dimediasi mikroba (Morel dan Price 2003 ). Akibatnya, perubahan dalam ketersediaan mikronutrien dapat berdampak signifikan pada struktur dan fungsi komunitas mikroba (Louca et al. 2018 ). Misalnya, keterbatasan zat besi (Fe) telah terbukti mengurangi efisiensi rantai transpor elektron (ETC) dalam sel bakteri, yang mengakibatkan penurunan efisiensi pertumbuhan berbasis karbon (Tortell, Maldonado, dan Price 1996 ). Penelitian sebelumnya telah menyoroti dampak substansial dari ketersediaan mikronutrien pada produktivitas primer, komposisi komunitas fitoplankton, dan penyerapan karbon (Buitenhuis, Timmermans, dan de Baar 2003 ; Saito dan Goepfert 2008 ; Saito, Goepfert, dan Ritt 2008 ). Namun, sementara banyak yang diketahui tentang efek mikronutrien pada proses ini, pengaruhnya terhadap keseluruhan struktur komunitas mikroba laut masih kurang dieksplorasi.
Ketersediaan oksigen adalah faktor penting lain yang membentuk komposisi komunitas mikroba dan aktivitas metabolisme (Fierer et al. 2012 ; Zhang et al. 2018 ). Mikroorganisme memiliki adaptasi fisiologis yang beragam terhadap berbagai kondisi oksigen, dengan mikroba aerobik, anaerobik fakultatif, dan anaerobik obligat menempati relung yang berbeda (Zhang et al. 2018 ). Di zona minimum oksigen (OMZ), tempat konsentrasi O₂ turun di bawah < 20 μm, mikronutrien bertindak sebagai kofaktor esensial untuk enzim yang terlibat dalam jalur anaerobik seperti denitrifikasi, reduksi sulfat, dan produksi metana. Proses-proses ini, pada gilirannya, memengaruhi siklus nutrisi dan proses biogeokimia (Luther et al. 1997 ). Ketersediaan dan siklus mikronutrien di OMZ dipengaruhi oleh interaksi kompleks antara aktivitas mikroba, kondisi redoks, dan proses fisikokimia. Misalnya, denitrifikasi yang didorong oleh mikroba dan reduksi sulfat memengaruhi kelarutan dan bioavailabilitas mikronutrien utama seperti Fe, Mn, dan Zn melalui reaksi redoks, sementara faktor-faktor seperti pH, suhu, dan bahan organik lebih lanjut memodulasi dinamika ini (Luther et al. 1997 ). Meskipun ada penelitian substansial tentang dampak kadar oksigen rendah pada komunitas mikroba di OMZ (Fierer et al. 2012 ), lebih sedikit penelitian yang meneliti bagaimana mikronutrien membentuk dinamika komunitas mikroba di wilayah tersebut.
Laut Arab (AS) menyediakan latar yang ideal untuk mempelajari respons rumit mikroba terhadap mikronutrien dan ketersediaan oksigen karena OMZ-nya yang luas. Sifat dinamis AS, yang dipengaruhi oleh arus naik, pendinginan musim dingin, dan angin muson musiman (Madhupratap, Prasanna, et al. 1996 ; Prasanna et al. 2001 ), menghasilkan variasi temporal dan spasial yang signifikan dalam ketersediaan nutrisi dan produktivitas primer (Hansell dan Peltzer 1998 ). Musim barat daya meningkatkan pencampuran vertikal, membawa air kaya nutrisi dari dasar ke permukaan dan meningkatkan konsentrasi mikro-makronutrien (Naqvi et al. 1990 ). Keanekaragaman mikroba telah terbukti bervariasi secara signifikan antara wilayah OMZ dan non-OMZ di AS (Bandekar et al. 2018 ). Penelitian sebelumnya di lingkungan laut lain telah menunjukkan bahwa ketersediaan mikronutrien dapat secara signifikan memengaruhi pertumbuhan dan aktivitas mikrobioma laut (Tortell, Maldonado, dan Price 1996 ), dan beberapa mikroba, seperti bakteri heterotrofik, telah beradaptasi untuk secara efisien membersihkan mikronutrien dari lingkungan mereka dengan memanfaatkan rasio luas permukaan terhadap volume yang tinggi dan menghasilkan ligan organik untuk mengkompleks dan mengangkut logam-logam ini (Azam et al. 1983 ; Granger dan Price 1999 ). Namun, terlepas dari adaptasi ini, masih ada kesenjangan dalam pemahaman kita tentang pertumbuhan dan aktivitas mikroba mengenai mikronutrien di perairan teroksigenasi versus terdeoksigenasi di AS.
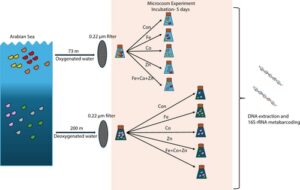
Untuk penelitian ini, kami berhipotesis bahwa perubahan dalam ketersediaan mikronutrien akan menyebabkan perubahan dalam komposisi dan keanekaragaman komunitas mikroba, dengan besarnya efek ini bergantung pada kadar oksigen. Untuk menguji hipotesis ini, kami melakukan percobaan mikrokosmos di mana kami sengaja mengubah komposisi mikronutrien, termasuk seng (Zn), Fe, kobalt (Co) dan kombinasinya (Zn + Fe + Co) dalam sampel air yang dikumpulkan dari kedalaman teroksigenasi (73 m) dan terdeoksigenasi (200 m) di lokasi Arabian Sea Time Series (ASTS). Mikronutrien dipilih karena peran pentingnya sebagai kofaktor dalam enzim mikroba yang penting untuk proses seperti fiksasi nitrogen, siklus karbon, dan respirasi. Ketersediaannya sering kali membatasi pertumbuhan dan aktivitas mikroba, terutama di lingkungan laut terbuka (Morel dan Price 2003 ). Dengan menggunakan sekuensing amplikon 16S rRNA, kami menyelidiki dampak amandemen mikronutrien pada komposisi taksonomi dan keanekaragaman komunitas mikroba dengan dan tanpa oksigen.
2 Bahan dan Metode
2.1 Percobaan Mikrokosmos
Percobaan mikrokosmos dilakukan di ASTS yang terletak di 17°0.126’N, 67°59.772′ E di AS timur laut di atas ORV Sindhu Sadhana pada bulan Januari 2020. Tujuan utamanya adalah untuk memeriksa dampak modifikasi mikronutrien, yang meliputi Zn, Fe, dan Co pada tingkat nutrisi, jumlah total bakteri (TBC), dan struktur komunitas mikroba. Untuk percobaan ini, 80 L air laut yang tidak disaring dikumpulkan dari kedalaman teroksigenasi (73 m) dan terdeoksigenasi (200 m) menggunakan pengambil sampel CTD Niskin yang bersih. Sampel air dikumpulkan dan kemudian didistribusikan secara merata di antara labu berkapasitas 5 L yang telah dibersihkan sebelumnya. Sebelum percobaan, labu dibersihkan secara menyeluruh dan berurutan dengan deterjen, asam nitrat 50% v/v (kelas ACS, Sigma-Aldrich, India) dan asam klorida 10% v/v (kelas ACS, Sigma-Aldrich, India). Selanjutnya, labu direndam dengan asam klorida 10% selama 1 minggu sebelum dibilas secara menyeluruh dan diisi dengan air ultramurni (kelas Tipe-I) sehari sebelum percobaan. Air ultramurni kemudian dibuang, dan labu dibilas terakhir dengan air laut sampel. Jejak logam dalam bentuk garam klorida, yang diperoleh dari Sigma-Aldrich, India, dilarutkan dalam HCl 0,01 N kelas ACS, dengan pH ~1,0. Setelah labu diisi dengan sampel air laut, 1 mL larutan logam jejak pekat, yaitu, Zn, Fe, Co dan campuran (Zn + Fe + Co), ditambahkan secara terpisah ke dalam labu untuk mencapai konsentrasi akhir 10 nM L −1 . Konsentrasi logam jejak untuk percobaan diputuskan berdasarkan studi sebelumnya yang menunjukkan bahwa level ini cukup untuk memicu perubahan komunitas mikroba tanpa toksisitas atau presipitasi pada konsentrasi yang lebih tinggi (Hutchins et al. 2002 ; Eldridge et al. 2007 ; Becquevort, Lancelot, dan Schoemann 2007 ). Sebanyak 15 labu, yang terdiri dari 12 perlakuan (tiga labu per amandemen mikronutrien) dan 3 kontrol, diinkubasi selama 5 hari dengan paparan intensitas cahaya 150 μmol m −2 s −1 di bawah siklus terang:gelap 16:8 jam. Untuk mencegah adanya jejak kontaminasi logam, dinding bagian dalam ruang inkubasi ditutup dengan lembaran plastik tipis sebelum percobaan. Sampel air dikumpulkan dari kontrol pada Hari ke-0 (C-0) dan pada akhir Hari ke-5 dari kontrol (C-5) dan labu perlakuan. Untuk analisis nutrisi, 100 mL sampel dikumpulkan dalam botol bersih yang dicuci dengan asam dan diawetkan pada suhu -20°C hingga analisis (Avanzino dan Kennedy 1993 ). TBC diperoleh dengan mengumpulkan 50 mL sampel dalam wadah steril, yang difiksasi dengan formaldehida buffer hingga konsentrasi akhir 2% dan disimpan pada suhu 4°C dalam gelap hingga analisis. Untuk analisis komunitas mikroba, sampel disaring, dan filter disimpan pada suhu -80°C hingga ekstraksi DNA.
2.2 Parameter Fisika dan Kimia
Untuk setiap sampel, kedalaman, suhu, salinitas dan pH diukur di tempat menggunakan sensor pada konsol SBE911 CTD yang dipasang pada sampler air roset SBE 32 (Sea-Bird, Scientific). Kadar oksigen diukur dalam beberapa jam pengambilan sampel menggunakan metode titrasi Winkler yang dimodifikasi seperti yang dijelaskan oleh Carpenter ( 1965 ) untuk memastikan kuantifikasi yang akurat. Sebaliknya, kadar nutrisi [nitrat (NO3− ) , nitrit (NO2− ) , amonia (NH4 + ) , silikat (SiO32− ) dan fosfat (PO43− ) ] dianalisis dari sampel beku di Institut Oseanografi Nasional (NIO) menggunakan autoanalyser Skalar (Skalar Analytical, Belanda), mengikuti protokol yang ditetapkan untuk menjaga integritas sampel untuk analisis nutrisi yang andal (Grasshoff, Ehrhardt, dan Kremling 1983 ) .
2.3 Pencacahan TBC
TBC dinilai menggunakan versi modifikasi dari metode Porter dan Feig ( 1980 ). Aliquot 1–5 mL dari sampel yang diawetkan ini dikenakan inkubasi dengan 4′6-diamidino-2-phenylindole (DAPI), menggunakan larutan kerja 1 mg mL −1 (20 mL per mL sampel). Selanjutnya, sampel disaring ke membran polikarbonat hitam 0,22 mm (Millipore, AS). Mikroskopi epifluoresensi dilakukan menggunakan mikroskop Olympus BX-51, dibantu oleh perangkat lunak Image Pro-plus (Media Cybernetics, AS), dan TBC ditentukan dari minimal 20 bidang mikroskopis yang dipilih secara acak di setiap sampel untuk memastikan keandalan statistik.
2.4 Ekstraksi dan Pengurutan DNA
Sub-sampel (3,0 L) dari setiap mikrokosmos disaring dengan melewatkannya melalui kartrid Sterivex dengan filter membran berukuran pori 0,22 μm (Millipore, AS). Proses penyaringan ini dilakukan menggunakan pompa peristaltik pada laju alir 60 mL per menit. Kartrid Sterivex kemudian diisi dengan 1,8 mL buffer penyimpanan DNA (50 mM Tris pH 8,3, 40 mM EDTA dan sukrosa 0,75 M), disegel dan disimpan dalam keadaan beku pada suhu -80°C hingga ekstraksi asam nukleat mengikuti metode Ferrari & Hollibaugh (Ferrari dan Hollibaugh 1999 ). Selanjutnya, DNA dielusi dan disuspensikan dalam 40 mL buffer TE. Elektroforesis gel dengan agarosa 0,8% dilakukan untuk memverifikasi integritas DNA, dan ekstrak selanjutnya disimpan pada suhu -80°C untuk analisis lebih lanjut. Ekstrak DNA digunakan untuk sekuensing berthroughput tinggi untuk menjelaskan komposisi dan kelimpahan relatif komunitas bakteri, dengan fokus pada wilayah hipervariabel V3–V4 dari gen 16S rRNA. Wilayah ini diperkuat menggunakan pasangan primer 341F (CCTAYGGGRBGCASCAG) dan 806R (GGACTACNNGGGTATCTAAT). Semua reaksi PCR dilakukan dengan 15 μL Phusion High-Fidelity PCR Master Mix (New England Biolabs), 0,2 μM primer maju dan mundur, dan sekitar 10 ng DNA cetakan. Siklus termal terdiri dari denaturasi awal pada suhu 98°C selama 1 menit, diikuti oleh 30 siklus denaturasi pada suhu 98°C selama 10 detik, annealing pada suhu 50°C selama 30 detik, dan elongasi pada suhu 72°C selama 30 detik dan 72°C selama 5 menit. Amplikon gen 16S rRNA sekitar 400–450 bp diisolasi menggunakan elektroforesis gel agarosa (2%) dan digabungkan pada rasio kepadatan yang sama. Setelah amplifikasi dan persiapan pustaka, pengurutan dilakukan pada platform Illumina Novaseq 6000 berpasangan oleh Novogene Company Limited (Cambridge, Inggris).
2.5 Pengolahan Data Pasca-Sekuensing
Pemrosesan data sekuensing melibatkan beberapa langkah untuk memastikan keakuratan dan keandalan. Awalnya, pembacaan berpasangan didemultipleks berdasarkan kode batang unik dan selanjutnya dipangkas untuk menghilangkan kode batang dan sekuens primer menggunakan trimmomatic. Pembacaan berpasangan digabungkan menggunakan FLASH (V1.2.7) (Magoč dan Salzberg 2011 ). Pembacaan yang digabungkan selanjutnya difilter kualitasnya menggunakan Qiime (V1.7.0) (Caporaso et al. 2010 ), menghasilkan serangkaian pembacaan bersih berkualitas tinggi. Pembacaan bersih ini kemudian dibandingkan dengan basis data referensi SILVA (V138.1), menggunakan algoritma UCHIME (Edgar et al. 2011 ) untuk mengidentifikasi dan selanjutnya menghilangkan sekuens chimera. Unit taksonomi operasional (OTU) dihasilkan menggunakan perangkat lunak Uparse (v7.0.1090) (Edgar 2013 ) dengan mengelompokkan sekuens dengan kesamaan ≥ 97%. Urutan representatif untuk setiap OTU dipilih untuk anotasi taksonomi lebih lanjut. Qiime dalam metode Mothur dilakukan terhadap basis data rRNA SSU dari Basis Data SILVA (Wang et al. 2007 ) untuk anotasi spesies pada setiap peringkat taksonomi. Kelimpahan OTU dinormalisasi menggunakan nomor urutan standar yang sesuai dengan sampel dengan urutan paling sedikit untuk menghilangkan bias yang disebabkan oleh variasi jumlah urutan dalam sampel yang berbeda. Urutan gen rRNA 16S diserahkan ke Pusat Informasi Bioteknologi Nasional (NCBI) dengan nomor Bio-Project PRJNA1137820 dengan nomor akses GenBank SRX25419583-SRX25419612.
2.6 Analisis Statistik
Analisis keragaman alfa dan beta dilakukan pada data yang dinormalisasi untuk menjelaskan keragaman spesies intra dan inter-sampel menggunakan Qiime. Keragaman alfa (α) untuk setiap sampel dinilai melalui enam indeks, termasuk kekayaan spesies, Chao1, Shannon, Simpson, penaksir cakupan berbasis kelimpahan (ACE) dan cakupan baik menggunakan paket vegan di R. Penskalaan multidimensi non-metrik (NMDS) dan analisis kesamaan (ANOSIM) dari total mikrobiota, bakteri, dan archaea dilakukan menggunakan paket yang sama di R. Analisis komponen utama (PCA) dilakukan menggunakan paket FactoMineR dan paket ggplot2 dalam perangkat lunak R (V4.0.3). Menggunakan perangkat lunak statistik IBM SPSS 23.0 (IBM Corp., Armonk, NY, AS), analisis varians satu arah (ANOVA) dilakukan untuk memahami dampak logam jejak pada TBC dan nutrisi. Selanjutnya, uji Dunnett post hoc dilakukan untuk membandingkan sampel kontrol Hari ke-0 dan Hari ke-5 (#C1 dan #C2) dengan sampel yang diberi perlakuan (#T1 (Zn), #T2 (Fe), #T3 (Co) dan #T4 (Zn + Fe + Co). Analisis korespondensi kanonik (CCA) dilakukan dengan menggunakan perangkat lunak Past-3 ( https://folk.uio.no/ohammer/past/ ) untuk memahami hubungan antara nutrisi dan keanekaragaman mikroba dalam sampel kontrol dan sampel yang diberi perlakuan.
3 Hasil
3.1 Konsentrasi Nutrisi
Secara umum, suhu, salinitas, pH dan DO secara konsisten lebih tinggi di lapisan teroksigenasi daripada di lapisan deoksigenasi yang lebih dalam (Tabel S1 ). Pada kedalaman 73 m, penambahan Zn, Fe, Co dan campurannya menghasilkan efek yang bervariasi pada konsentrasi nutrisi dibandingkan dengan kelompok kontrol setelah Hari ke-5. Kadar nitrat menurun di semua perlakuan, kecuali Zn, yang sebanding dengan nilai kontrol. Konsentrasi nitrit dan amonia menurun di semua perlakuan, dengan kadar terendah diamati pada perlakuan campuran. Sebaliknya, konsentrasi fosfat meningkat di semua perlakuan, terutama pada perlakuan Fe. Konsentrasi silikat menunjukkan variasi yang cukup besar, dengan konsentrasi tertinggi diamati pada perlakuan campuran, secara signifikan melebihi konsentrasi pada perlakuan lain (Tabel 1 ).
| Kedalaman | Nutrisi (μmol L −1 ) | Perlakuan | Hari 0 | Hari ke 5 | Kedalaman | Nutrisi (μmol L −1 ) | Perlakuan | Hari 0 | Hari ke 5 |
|---|---|---|---|---|---|---|---|---|---|
| 73 (m) | Nitrat | Menipu | 5.74 | 4.74 | 200 (meter) | Nitrat | Menipu | 8.62 | 5.98 |
| Seng | 2.86 | Seng | 17.39 | ||||||
| Fe | 2.38 | Fe | 9.14 | ||||||
| Bersama | 3.09 | Bersama | 8.27 | ||||||
| Zn + Fe + Co | 3.21 | Zn + Fe + Co | 13.78 | ||||||
| Nitrit | Menipu | 0.29 | 0.22 | Nitrit | Menipu | 0,89 | 0.76 | ||
| Seng | 0.12 | Seng | 0.32 | ||||||
| Fe | 0.13 | Fe | 0.63 | ||||||
| Bersama | 0.13 | Bersama | 0.5 | ||||||
| Zn + Fe + Co | 0,05 | Zn + Fe + Co | 0.7 | ||||||
| Amonia | Menipu | 1.65 | 0.26 | Amonia | Menipu | 1.51 | 1.08 | ||
| Seng | 1.1 | Seng | 1.82 | ||||||
| Fe | 1.42 | Fe | 1.76 | ||||||
| Bersama | 2.39 | Bersama | 1.77 | ||||||
| Zn + Fe + Co | 0.67 | Zn + Fe + Co | 0,91 | ||||||
| Fosfat | Menipu | 0.64 | 2.12 | Fosfat | Menipu | 2.91 | 2.12 | ||
| Seng | 1.58 | Seng | 1.51 | ||||||
| Fe | 2.94 | Fe | 0,75 | ||||||
| Bersama | 0,58 | Bersama | 0.69 | ||||||
| Zn + Fe + Co | 0.5 | Zn + Fe + Co | 0,94 | ||||||
| Silikat | Menipu | 3.07 | 2.91 | Silikat | Menipu | 7.46 | 6.48 | ||
| Seng | 2.51 | Seng | 9.14 | ||||||
| Fe | 1.96 | Fe | 8.48 | ||||||
| Bersama | 1.83 | Bersama | 6.25 | ||||||
| Zn + Fe + Co | pukul 16.55 | Zn + Fe + Co | 10.26 |
Singkatan: Con = Kontrol, Zn = Seng, Fe = Besi, Co = Kobalt.
Pada kedalaman 200 m, nitrat meningkat di semua perlakuan relatif terhadap kontrol dengan peningkatan dua kali lipat, khususnya pada perlakuan Zn dan campuran. Konsentrasi amonia menunjukkan variasi minimal di semua perlakuan. Konsentrasi fosfat menurun di semua kelompok eksperimen dibandingkan dengan kontrol, dengan tingkat terendah diamati pada Co-treatment. Konsentrasi nitrit menunjukkan perubahan yang bervariasi di semua perlakuan tetapi secara umum tetap sama dengan perlakuan kontrol. Konsentrasi silikat meningkat di semua kelompok perlakuan, dengan tingkat tertinggi diamati pada perlakuan campuran (Tabel 1 ). Secara keseluruhan, penambahan mikronutrien ini mengubah konsentrasi nutrisi dibandingkan dengan kelompok kontrol.
3.2 Keanekaragaman Alfa dan Beta
Analisis sekuens kami menunjukkan pengurutan komunitas mikroba yang hampir lengkap, dengan perkiraan cakupan sebesar 99% (cakupan Good sebesar 0,99) untuk semua sampel. Kurva rarefaksi menunjukkan saturasi, yang menunjukkan pengurutan komunitas mikroba yang dalam (Gambar S1 ). Kami mengevaluasi keragaman α komunitas mikroba menggunakan indeks keragaman (Shannon, Simpson) dan kemerataan (Chao1 dan ACE). Khususnya, C-5 menunjukkan kekayaan spesies yang lebih rendah daripada C-0, meskipun analisis statistik menunjukkan tidak ada perbedaan signifikan dalam keragaman Shannon. Secara umum, pada 73 m, indeks keragaman alfa menunjukkan variasi minimal di berbagai perlakuan dibandingkan dengan kontrol (Gambar 1a–e ). Di antara perlakuan, Fe menunjukkan keragaman tertinggi (4,91), sedangkan Co (4,6) adalah yang terendah. Perlakuan campuran memiliki jumlah OTU tertinggi (352), sedangkan perlakuan Co memiliki yang terendah. Pola ini juga tercermin dalam indeks Chao1 dan ACE, dengan perlakuan Fe menunjukkan kekayaan yang diperkirakan tertinggi. Pada kedalaman 200 m, perlakuan campuran mencatat jumlah OTU tertinggi (329) dan indeks keanekaragaman tertinggi (5,07). Secara keseluruhan, sampel yang diberi perlakuan menunjukkan jumlah OTU yang lebih tinggi daripada kelompok kontrol (Gambar 1a–e ).

Analisis keanekaragaman terpisah untuk komunitas bakteri dan arkea mengungkapkan pola yang berbeda. Untuk komunitas bakteri, sampel yang diberi perlakuan menunjukkan pola keanekaragaman yang relatif stabil di kedua kedalaman. Pada kedalaman 73 m, jumlah OTU secara konsisten menurun pada sampel yang diberi perlakuan dibandingkan dengan sampel dalam kontrol, sedangkan pada kedalaman 200 m, peningkatan OTU diamati pada sampel yang diberi perlakuan. Keanekaragaman bakteri tertinggi (5,01) dan jumlah OTU (300) ditemukan pada sampel yang diberi perlakuan Fe pada kedalaman 73 m, sedangkan sampel campuran memiliki keanekaragaman dan OTU tertinggi pada kedalaman 200 m. Sampel yang diberi perlakuan bersama mencatat nilai terendah di kedua kedalaman (Gambar 1f–j ). Sebaliknya, komunitas arkea menunjukkan OTU yang jauh lebih rendah dibandingkan dengan taksa bakteri di kedua kedalaman. Pada kedalaman 73 m, sampel yang diberi perlakuan Fe memiliki jumlah OTU (10) dan keanekaragaman (1,40) tertinggi, sedangkan Co memiliki yang terendah. Pada kedalaman 200 m, perlakuan bersama (16) menghasilkan OTU maksimum, dengan keanekaragaman tertinggi yang diamati pada sampel campuran (2,21). Sampel yang diberi perlakuan Fe memiliki OTU (11) dan keanekaragaman terendah pada kedalaman 200 m. Keanekaragaman arkea tetap relatif stabil di semua perlakuan pada kedua kedalaman tetapi lebih tinggi pada kedalaman 200 m dibandingkan dengan kedalaman 73 m (Gambar 1k–o ).
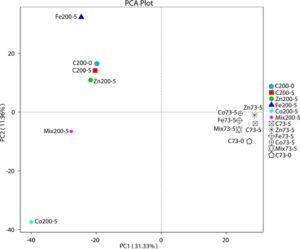
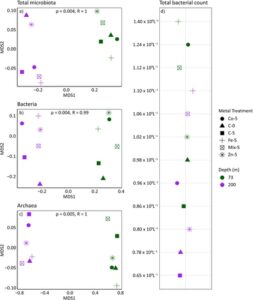
Efek dari perlakuan mikronutrien pada komunitas mikroba pada kedalaman 73 m dan 200 m ditunjukkan menggunakan plot PCA (Gambar 2 ). PC1 dan PC2 bersama-sama menangkap porsi yang signifikan yaitu 31,33% dan 11,96%, berturut-turut. Sampel dari kedalaman 200 m, C200-0 dan C200-5 (sampel kontrol) menunjukkan struktur komunitas yang sama antara kontrol Hari 0 dan Hari 5. Namun, perlakuan logam jejak seperti Fe200-5, mix200-5 dan terutama Co200-5 menunjukkan penyimpangan yang signifikan sepanjang PC1 dan PC2, yang mencerminkan pergeseran komunitas yang berbeda karena perlakuan ini. Untuk kedalaman 73 m, sampel kontrol (C73-0 dan C73-5) berkelompok rapat, dengan pergeseran sedang pada sampel yang diberi perlakuan, terutama untuk perlakuan Zn dan campuran. Secara keseluruhan, setiap perlakuan menghasilkan struktur komunitas bakteri yang berbeda dibandingkan dengan kontrol, yang menunjukkan bahwa mikronutrien ini mengubah komunitas bakteri. Pemisahan sampel yang jelas dari 73 hingga 200 m sepanjang sumbu PCA menyoroti efek yang bergantung pada kedalaman dari perlakuan mikronutrien ini, dengan semua perlakuan secara umum memiliki efek positif pada komunitas bakteri. Secara keseluruhan, plot NMDS (Gambar 3a ) menunjukkan nilai stres yang sangat rendah (0,001), yang menunjukkan representasi yang sangat baik dari komunitas mikroba dalam dua dimensi. Analisis NMDS mengungkapkan pemisahan yang bergantung pada kedalaman dari keragaman bakteri (Gambar 3b ) dan arkea (Gambar 3c ) di semua perlakuan mikronutrien.
3.3 Akan diumumkan
TBC pada kedua kedalaman, 73 dan 200 m (Gambar 3d ), menunjukkan respons yang berbeda terhadap amandemen mikronutrien. Pada kedua kedalaman, jumlah bakteri yang lebih tinggi diamati pada semua perlakuan dibandingkan dengan kelompok kontrolnya. Pada 73 m, jumlah bakteri tertinggi diamati dalam labu yang diperkaya Fe (1,4 × 109 L −1 ) , diikuti oleh Co (1,24 × 109 L −1 ), campuran (1,12 × 109 L −1 ) dan Zn (1,02 × 109 L −1 ), semuanya melebihi kelompok kontrol 0 (0,98 × 109 L −1 ) dan 5 (0,86 × 109 L −1 ). Pada kedalaman 200 m, perlakuan Fe kembali menunjukkan TBC tertinggi (1,1 × 109 L −1 ) , diikuti oleh perlakuan campuran (1,06 × 109 L −1 ) dan Co (0,96 × 109 L −1 ) . Labu yang diberi Zn menunjukkan peningkatan yang lebih kecil (0,8 × 109 L −1 ) dibandingkan dengan kelompok kontrol 0 (0,78 × 109 L −1 ) dan 5 (0,65 × 109 L −1 ). Secara keseluruhan, jumlah bakteri secara konsisten lebih tinggi pada kedalaman 73 m dibandingkan dengan kedalaman 200 m, dengan perlakuan Fe menunjukkan efek yang paling menonjol pada kedua kedalaman.
3.4 Struktur dan Kelimpahan Komunitas Prokariotik
Komposisi taksonomi semua sampel dievaluasi dengan menganalisis sekuens dengan kelimpahan ≥ 1%, yang mewakili komunitas prokariotik. Analisis kelimpahan relatif difokuskan pada 10 genera paling melimpah di setiap perlakuan. Awalnya, sekuens diperiksa pada tingkat filum, diikuti oleh analisis yang lebih rinci pada tingkat genus untuk resolusi yang lebih baik. Replikasi biologis menunjukkan konsistensi tinggi dan secara statistik sebanding. Oleh karena itu, kami menggabungkan data dari replikasi untuk setiap perlakuan menjadi satu representasi untuk analisis data komunitas.
3.4.1 Komunitas Bakteri dan Archaea di Lapisan Oksigenasi
Pada kedalaman teroksigenasi 73 m, Proteobacteria mendominasi semua perlakuan, meliputi 42%–52% komunitas, dengan kelimpahan tertinggi (52%) teramati pada perlakuan Fe (Tabel S2 ). Actinobacteriota (20,9%) dan Thermoplasmatota (19,2%) adalah filum paling melimpah berikutnya pada kelompok kontrol. Pada perlakuan Zn dan Co, kelimpahan Actinobacteriota menurun relatif terhadap Bdellovibrionota , yang meningkat menjadi 22,5% dan 12%, berturut-turut. Sebaliknya, Thermoplasmatota secara konsisten menurun pada semua perlakuan, kecuali peningkatan signifikan pada perlakuan campuran (19,9%). Cyanobacteria menunjukkan penurunan substansial pada semua perlakuan (1,5%–3,1%) dibandingkan dengan sampel kontrol (8%) (Tabel S2 ).
Pada tingkat genus, kelimpahan bakteri bervariasi secara jelas di antara perlakuan logam (Tabel 2 ). Dalam kontrol, Clade_Ia (15,8%) dan Candidatus_Actinomarina (10,6%) adalah yang paling melimpah, di samping jumlah bakteri yang tidak terklasifikasi yang menonjol (23,7%). Dalam perlakuan Zn, Peredibacter meningkat secara signifikan menjadi 23,2%, sementara Clade_Ia (15,8%) dan Candidatus_Actinomarina (7,2%) tetap menonjol. Perlakuan Fe menunjukkan distribusi yang sama dengan kontrol, sementara perlakuan Co melihat sedikit peningkatan pada Clade_Ia (21%) dan Candidatus_Actinomarina (12,5%), di samping peningkatan yang nyata pada Peredibacter (12%). Perlakuan logam campuran menunjukkan distribusi yang bervariasi, dengan kontribusi signifikan dari Candidatus_Actinomarina (18,5%) dan Clade_Ia (17,7%). Di semua perlakuan, bakteri yang tidak terklasifikasi (17,5%–23,8%), Clade_Ia (15,6%–21,07%) dan Candidatus_Actinomarina (7,1%–18,45%) secara konsisten menunjukkan kelimpahan yang tinggi, sementara Peredibacter meningkat secara signifikan pada perlakuan Zn dan Co. Analisis komunitas archaea (Tabel 3 ) menunjukkan bahwa Marine Group II (46%–88%) dominan, meskipun menurun pada perlakuan Fe (69%) dan Co (46%) dibandingkan dengan kontrol (79%). Candidatus Nitrosopelagicus menunjukkan peningkatan sedang pada perlakuan Zn (24,5%) dan Fe (27%), dengan peningkatan substansial pada perlakuan Co (51%) relatif terhadap kontrol (18,1%). Taksa lain termasuk Woesearchaeales , Nitrosopumilaceae , Marine Group III , Marine Benthic Group A , SCGC AAA011-D5 dan Candidatus Iainarchaeum hadir dalam proporsi yang lebih kecil.
| 73 meter | 200 meter persegi | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Genus Bakteri | C73-0 | C73-5 | Zn73-5 | Fe73-5 | Co73-5 | Campuran73-5 | C200-0 | C200-5 | Zn200-5 | Fe200-5 | Co200-5 | Campuran 200-5 |
| Bakteri yang tidak terklasifikasi | 24.98 | 23.72 | tanggal 19.11 | 21.61 | 18.91 | 17.48 | 22.52 | 19.32 | 19.81 | 19.98 | 16.61 | tanggal 19.16 |
| Mikroba laut ( klade SAR406 ) | 2.96 | 3.01 | 1.82 | 4.10 | 0,87 | 5.10 | 5.96 | 6.46 | 6.54 | 8.91 | 25.42 | tanggal 16.04 |
| Sva0996_kelompok_laut | 3.66 | 3.73 | 2.12 | 5.33 | 2.00 | 2.81 | 7.53 | 8.16 | 5.97 | 9.87 | 11.62 | 7.95 |
| SUP05_kluster | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 6.64 | 6.84 | 6.23 | 9.72 | 9.89 | 10.41 |
| LWQ8 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.16 | 0.18 | 16.37 | 1.97 | 0.11 | 13.52 |
| UBA10353_kelompok_laut | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 7.76 | 7.46 | 4.85 | 5.90 | 4.51 | Tanggal 5.09 |
| Alkanivoraks | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 16.25 | 17.37 | 1.04 | 2.21 | 2.90 | 4.22 |
| Klade SAR324 ( Kelompok_laut_B ) | 4.39 | 4.47 | 4.46 | 8.94 | 3.54 | 6.59 | 8.52 | 8.66 | 2.81 | 4.57 | 4.17 | 3.59 |
| Eritrobakteri | 1.05 | 1.06 | 8.89 | 0,99 | 1.84 | 0.68 | 0,85 | 1.12 | 7.06 | 11.97 | 1.35 | 2.02 |
| Nokardioides | 4.46 | 4.54 | 0.32 | 0.30 | 0,06 | 0.18 | 0.57 | 0.52 | 10.69 | 7.01 | 0.33 | 3.90 |
| Klade_Ia | 15.49 | 15.78 | 15.76 | 15.62 | tanggal 21.07 | 17.74 | 4.60 | 5.29 | 4.27 | 3.06 | 2.47 | 2.54 |
| Klade SAR202 | 0.68 | 0.68 | 0,59 | 0,77 | 0.73 | 2.86 | 2.62 | 2.72 | 2.12 | 1.59 | 6.57 | 3.31 |
| Klade_Ib | 2.40 | 2.47 | 3.67 | 4.33 | 4.88 | 5.17 | 5.51 | 5.83 | 3.17 | 2.81 | 1.49 | 1.80 |
| Kelompok laut AEGEAN-169 | 2.65 | 2.70 | 4.61 | 3.40 | 4.70 | 6.42 | 4.38 | 4.22 | 2.16 | 3.45 | 1.22 | 1.69 |
| Alteromonas adalah nama lain dari Alteromonas. | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0,93 | 0.76 | 4.11 | 3.78 | 1.72 | 1.65 |
| Klade_II | 6.89 | 7.02 | 4.95 | 8.51 | 6.70 | 8.20 | 3.70 | 3.62 | 2.25 | 1.49 | 1.62 | 1.30 |
| Bakteri Peredibakteri | 0.29 | 0.29 | Tanggal 23.21 | 0.67 | Tanggal 12.02 | 0.37 | 0.64 | 0.72 | 0.41 | 1.07 | 5.34 | 0,55 |
| Bakteri Keto | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0,77 | 0.74 | 0.16 | 0.63 | 2.66 | 1.26 |
| Penyakit pseudomonas | 0,04 | 0,03 | 0,01 | 0,09 | 2.47 | 0.18 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| PENGEMBANGAN007 | 0.62 | 0.63 | 0,07 | 0.36 | 4.01 | 0.18 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| Kelompok SAR86 | 2.45 | 2.49 | 1.72 | 3.07 | 1.22 | 2.59 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| Bakteri sianobakteri | 6.84 | 6.95 | 0.92 | 0,77 | 2.13 | 2.57 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| Bakteri Olei | 4.33 | 4.41 | 0.54 | 6.91 | 0.38 | 2.09 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| Candidatus_Actinomarina | 10.39 | 10.59 | 7.19 | tanggal 14.17 | pukul 12.45 | pukul 18.45 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
| Bakteri Mikobakterium | 5.33 | 5.43 | 0,05 | 0,07 | 0,02 | 0.33 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
Catatan: Lihat Gambar 2 untuk singkatan.
| 73 meter | 200 meter persegi | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Genus Arkeal | C73-0 | C73-5 | Zn73-5 | Fe73-5 | Co73-5 | Campuran73-5 | C200-0 | C200-5 | Zn200-5 | Fe200-5 | Co200-5 | Campuran 200-5 |
| Nitrosopumilaceae | 0.39 | 0.33 | 0.33 | 0.41 | 0.18 | 0,03 | 74.74 | 76.54 | 67.73 | 72.77 | 17.95 | 32.66 |
| Kelompok_Bentik_Laut_A | 0.16 | 0.12 | 0,04 | 0,02 | 0.00 | 0,02 | 8.57 | 8.03 | 7.63 | 7.17 | 5.83 | 8.93 |
| Woesearchaeales | 0.61 | 0,55 | 0,25 | 0,25 | 0,03 | 0.17 | 6.46 | 5.65 | 12.16 | 9.53 | 42.91 | 30.65 |
| Candidatus_Iainarchaeum | 0,04 | 0,01 | 0,01 | 0,01 | 0.00 | 0,01 | 2.59 | 2.46 | 1.59 | 1.00 | 1.43 | 1.61 |
| Candidatus_Nitrosopelagicus | Tanggal 18.15 | 18.22 | 24.55 | 27.97 | 51.70 | 8.92 | 1.50 | 2.19 | 2.38 | 3.91 | 0.46 | 1.46 |
| SCGC_AAA011-D5 | 0,04 | 0.00 | 0,01 | 0,01 | 0.00 | 0,01 | 1.69 | 1.67 | 3.44 | 0,85 | 2.95 | 2.83 |
| Kelompok_Marinir_III | 0.76 | 0.71 | 0.22 | 1.65 | 0,99 | 2.06 | 1.76 | 1.57 | 3.34 | 2.31 | 24.84 | 17.49 |
| Bakteri yang tidak terklasifikasi | 0,35 | 0.19 | 1.02 | 0.61 | 0.73 | 0.10 | 2.06 | 1.08 | 0.71 | 1.45 | 0.64 | 1.04 |
| Kelompok_Laut_II | 79.46 | 79.86 | 73.55 | 69.07 | 46.37 | 88.71 | 0.60 | 0.81 | 1.04 | 1.00 | 2.98 | 3.32 |
Catatan: Lihat Gambar 2 untuk singkatan.
3.4.2 Komunitas Bakteri dan Archaea di Lapisan Deoksigenasi
Pada kedalaman deoksigenasi yang lebih dalam yaitu 200 m, Proteobacteria merupakan filum yang dominan di semua sampel, menunjukkan penurunan yang konsisten dalam kelimpahan relatif, khususnya pada perlakuan Co (43,9%) dan campuran (48,9%). Sebaliknya, kelimpahan relatif Actinobacteriota meningkat dibandingkan dengan kontrol, dengan peningkatan yang signifikan pada perlakuan Zn (16,9%) dan Fe (18,9%). Klade SAR324 menurun di semua perlakuan, sementara Marinimicrobia meningkat secara signifikan pada perlakuan Co (22,9%) dan campuran (15,3%), melampaui nilai kontrol. Kelimpahan Patescibacteria meningkat secara signifikan pada perlakuan Zn (13,9%) dan campuran (12,9%) dibandingkan dengan kontrol (0,97%). Sebaliknya, Crenarchaeota secara konsisten mengalami penurunan dalam kelimpahan relatif di semua perlakuan, dan Nanoarchaeota menunjukkan peningkatan yang nyata pada sampel yang diberi perlakuan Co (8,9%) (Tabel S2 ).
Analisis tingkat genus pada kedalaman 200 m menunjukkan komposisi bakteri yang berbeda di seluruh perlakuan (Tabel 2 ). Pada sampel kontrol, Alcanivorax dominan (17,4%), diikuti oleh bakteri yang tidak terklasifikasi (19,3%), SAR324_clade (8,7%), Sva0996_marine_group (8,6%), UBA10353_marine_group (7,5%), SUP05_cluster (6,8%) dan Marinimicrobia (6,5%). Perlakuan Zn menunjukkan peningkatan signifikan pada LWQ8 (16,4%), Nocardioides (10,7%) dan Erythrobacter (7%). Perlakuan Fe menunjukkan pola yang sama dengan perlakuan Zn, sedangkan perlakuan Co ditandai dengan peningkatan signifikan pada Marinimicrobia (25,4%) dan Sva0996_marine_group (11,6%). Di semua perlakuan, Marinimicrobia , SUP05_cluster , Sva0996_marine_group , UBA10353_marine_group dan bakteri yang tidak terklasifikasi tetap berlimpah secara konsisten. Alteromonas lebih prevalen dalam perlakuan Zn (4,1%) dan Fe (3,8%), sementara Peredibacter (5,3%) dan Ketobacter (2,7%) meningkat secara signifikan dalam perlakuan Co. Dalam komunitas archaea (Tabel 3 ), Nitrosopumilaceae mendominasi dalam sampel kontrol (76,5%). Perlakuan Zn (67,7%) dan Fe (72,7%) sangat mirip dengan pola ini, tetapi perlakuan Co (17,9%) dan campuran (32,6%) menghasilkan pergeseran yang signifikan, dengan Woesearchaeales meningkat secara substansial (30%–42%) sementara Nitrosopumilaceae menurun (17%–32%). Selain itu, Marine Group III mengalami peningkatan yang signifikan (17%–24%) dalam perlakuan Co dan campuran.
3.5 Pengaruh Parameter Lingkungan terhadap Struktur Komunitas Bakteri dan Archaea
Hasil ANOVA menunjukkan perbedaan yang sangat signifikan dalam semua parameter yang diukur (nitrat, nitrit, amonia, fosfat, silikat dan TBC) di seluruh kedalaman (Tabel 4 ), seperti yang ditunjukkan oleh nilai- F yang sangat tinggi dan nilai- p < 0,0001 pada 73 dan 200 m. Hasil-hasil ini menunjukkan variabilitas yang kuat dalam konsentrasi nutrisi dan aktivitas mikroba antara kedalaman ini yang menunjukkan stratifikasi nutrisi yang signifikan dalam kolom air. Demikian pula, nilai- F yang tinggi untuk TBC menunjukkan variasi terkait kedalaman yang kuat dalam proses biogeokimia. Uji perbandingan berganda Dunnett post hoc (Tabel 5 ) selanjutnya mengonfirmasi temuan signifikan dari hasil ANOVA satu arah. Perbandingan antara kontrol Hari 0 dan berbagai perlakuan menunjukkan bahwa perlakuan secara signifikan ( p < 0,0001) memengaruhi TBC dan nutrisi di kedua kedalaman. Sebaliknya, kontrol hari ke-5 tidak menunjukkan perubahan signifikan dibandingkan dengan kontrol hari ke-0, yang mengonfirmasi stabilitas dari waktu ke waktu tanpa perlakuan.
| 73 meter | 200 meter persegi | |||
|---|---|---|---|---|
| Parameter | F | P | F | P |
| Nitrat | 8177.978 | < 0,0001 | 515.881 | < 0,0001 |
| Nitrit | 295.7 | < 0,0001 | 53.988 | < 0,0001 |
| Amonia | 578.497 | < 0,0001 | 3355.2 | < 0,0001 |
| Fosfat | 1644.526 | < 0,0001 | 32546.9 | < 0,0001 |
| Silikat | 996.060,5 juta | < 0,0001 | 94970.9 | < 0,0001 |
| Akan segera diumumkan | 1161.6 | < 0,0001 | 977.3 | < 0,0001 |
| Variabel dependen | (I) Perawatan | (J) Perawatan | ukuran (73 m) | hal (200m) |
|---|---|---|---|---|
| Bahasa Indonesia: #C2 | Bahasa Indonesia: #C1 | 1 | 1 | |
| #T1 | < 0,0001 | < 0,0001 | ||
| Nitrat | Bahasa Indonesia: #T2 | < 0,0001 | < 0,0001 | |
| Bahasa Indonesia: #T3 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #T4 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #C2 | Bahasa Indonesia: #C1 | 0.109 | 1 | |
| #T1 | < 0,0001 | 0,001 | ||
| Nitrit | Bahasa Indonesia: #T2 | < 0,0001 | 0,001 | |
| Bahasa Indonesia: #T3 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #T4 | < 0,0001 | 0.361 | ||
| Bahasa Indonesia: #C2 | Bahasa Indonesia: #C1 | 0,963 | 1 | |
| #T1 | < 0,0001 | < 0,0001 | ||
| Amonia | Bahasa Indonesia: #T2 | < 0,0001 | < 0,0001 | |
| Bahasa Indonesia: #T3 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #T4 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #C2 | Bahasa Indonesia: #C1 | 0,963 | 1 | |
| #T1 | < 0,0001 | < 0,0001 | ||
| Fosfat | Bahasa Indonesia: #T2 | < 0,0001 | < 0,0001 | |
| Bahasa Indonesia: #T3 | 0.324 | < 0,0001 | ||
| Bahasa Indonesia: #T4 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #C2 | Bahasa Indonesia: #C1 | 0.109 | 1 | |
| #T1 | < 0,0001 | < 0,0001 | ||
| Silikat | Bahasa Indonesia: #T2 | < 0,0001 | < 0,0001 | |
| Bahasa Indonesia: #T3 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #T4 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #C2 | Bahasa Indonesia: #C1 | < 0,0001 | <0.0001 | |
| #T1 | < 0,0001 | < 0,0001 | ||
| Akan segera diumumkan | Bahasa Indonesia: #T2 | < 0,0001 | 0,013 | |
| Bahasa Indonesia: #T3 | < 0,0001 | < 0,0001 | ||
| Bahasa Indonesia: #T4 | < 0,0001 | < 0,0001 |
Catatan: Kontrol Hari 0 (#C1) dibandingkan dengan kontrol Hari 5 (#C2), Zn (#T1), Fe (#T2), Co (#T3) dan perlakuan Zn + Fe + Co (#T4). Perbedaan rata-rata signifikan pada tingkat p < 0,05.
Plot ordinasi CCA (Gambar 4 ) menggambarkan dampak signifikan variabel lingkungan dan mikronutrien pada struktur komunitas bakteri di kedua kedalaman. Analisis mengungkapkan pemisahan yang jelas dan pengelompokan yang jelas dari keluarga bakteri antara zona oksik dan suboksik. Kelompok bakteri seperti Sava0996_marine_group , SUP05_cluster , Alcanivorax dan UBA10353_marine_group berkorelasi positif, yang menunjukkan proliferasi mereka di lingkungan yang kaya fosfat, silikat dan nitrit, berbeda dengan kelompok seperti Candidatus_Actinomarina dan Pseudomonas . Selain itu, cluster termasuk SAR324_clade ( Marine_group_B ), AEGEAN-169_marine_group , Clade_Ia , Clade_Ib dan Clade_II terutama dipengaruhi oleh Fe dan perlakuan campuran. Taksa bakteri lainnya, seperti Ketobacter , Erythrobacter , SAR202_clade , Marinimicrobia ( SAR406_clade ), Alteromonas , Nocardioides dan LWQ8 , menunjukkan korelasi positif dengan amonia, nitrat Co, Fe, Zn dan perlakuan campuran.

Demikian pula, plot CCA archaea (Gambar 5 ) menunjukkan bahwa Sumbu 1 menjelaskan mayoritas varians. Taksa seperti Marine_Benthic_Group_A , CSGC_AAA011-D5 , Woesearchaeles , Marine_Group_III , Candidatus_lainarchaeum , Nitrosumpimilaceae , dan archaea yang tidak terklasifikasi menunjukkan hubungan positif yang kuat dengan konsentrasi nitrat, nitrit, dan fosfat. Sebaliknya, Marine_Group_II dan Candidatus_Nitrosopelagicus berkorelasi negatif dengan nutrisi ini, yang menunjukkan hubungan terbalik. Selain itu, Woesearchaeales dan Marine_Group_III berkorelasi positif dengan tingkat silikat yang lebih tinggi. Sampel kontrol (C73-0, C73-5) dan yang diberi perlakuan (Fe73-5, Zn73-5, Co73-5) menunjukkan pengaruh minimal pada keanekaragaman archaea. Namun, sampel kontrol (C200-0, C200-5) dan sampel yang diberi perlakuan (Fe200-5 dan Zn200-5) bergeser ke arah ujung positif Sumbu 1 pada Hari ke-5, yang menyoroti pengaruh signifikan Fe dan Zn pada Candidatus_lainarchaeum , Nitrosumpimilaceae dan archaea yang tidak terklasifikasi.

4 Diskusi
Peran mikronutrien sebagai pengatur utama komunitas mikroba semakin diakui dalam ekosistem laut (Bertrand et al. 2015 ). Mikronutrien terlibat dalam metabolisme sekunder dan reaksi redoks, dengan ketersediaannya terutama memengaruhi perakitan komunitas mikroba (Dai et al. 2023 ). Penelitian sebelumnya telah menunjukkan bahwa tingkat mikronutrien memengaruhi aktivitas dan keanekaragaman mikroba heterotrofik di air tawar serta lautan global (Ramaiah et al. 2015 ; Jain et al. 2015 ; Baltar et al. 2018 ). Meskipun demikian, kontribusi mikronutrien terhadap struktur mikrobioma di daerah kekurangan oksigen sebagian besar masih belum dieksplorasi. Temuan kami, berdasarkan percobaan mikrokosmos, menyoroti signifikansi mikronutrien dalam membentuk komposisi komunitas mikroba dalam AS-OMZ. Selain itu, kami menyelidiki efek mikronutrien pada keanekaragaman mikroba baik di perairan permukaan yang teroksigenasi maupun perairan dalam yang terdeoksigenasi di AS-OMZ.
4.1 Efek pada Konsentrasi Nutrisi
Pengamatan kami terhadap konsentrasi nitrat dan silikat yang berkurang dalam perlakuan dari lapisan teroksigenasi atas selaras dengan temuan dari Eastern Tropical Pacific, di mana perlakuan Fe dan Zn individual memengaruhi kadar nitrat dan silikat (Franck et al. 2003 ). Selain itu, ketersediaan Fe diketahui membatasi enzim pereduksi nitrat (Morel dan Price 2003 ). Dengan demikian, penambahan Fe mungkin telah memfasilitasi reduksi nitrat, yang menyebabkan penurunan konsentrasinya. Sebaliknya, Zn dilaporkan menghambat reduksi nitrat (Waara 1992 ; Stone et al. 2006 ), namun temuan kami menunjukkan pemanfaatan nitrat, yang menunjukkan perlunya penyelidikan lebih lanjut ke dalam jalur biokimia reduksi nitrat bakteri. Selain itu, peningkatan signifikan dalam konsentrasi silikat dalam perlakuan campuran menyiratkan bahwa Fe, Zn dan Co secara kolektif dapat merangsang pertumbuhan dan aktivitas bakteri heterotrofik dan zooplankton yang merumput di diatom, sehingga melepaskan silikat ke dalam kolom air (Brzezinski, Villareal, dan Lipschultz 1998 ; Shaked dan Lis 2012 ).
Konsentrasi nitrat dan silikat yang tinggi pada kedalaman deoksigenasi yang lebih dalam mengindikasikan daur ulang bahan organik, nitrogen, dan diatom yang terurai dari sampel awal yang dimediasi oleh mikroba (Bidle dan Azam 2001 ; Sanders et al. 2007 ). Dalam mikrokosmos, konsentrasi yang lebih tinggi ini dibandingkan dengan kontrol menunjukkan mineralisasi cepat bahan organik dan regenerasi nutrisi melalui lingkaran mikroba (Becquevort, Lancelot, dan Schoemann 2007 ). Kadar nitrat yang sangat tinggi dalam labu yang diolah dapat disebabkan oleh proses mikroba seperti anammox atau nitrifikasi-denitrifikasi yang digabungkan. Dalam lingkungan yang terkendali ini, nitrifikasi yang ditingkatkan mendorong oksidasi amonia menjadi nitrat, sementara denitrifikasi mungkin tidak cukup menghilangkannya. Ini menunjukkan bahwa oksigen di lapisan atas meningkatkan daur ulang bahan organik dan pertumbuhan fitoplankton yang efisien, sedangkan lapisan deoksigenasi yang lebih dalam menghambat proses ini, yang mengarah pada akumulasi nutrisi dan menyoroti peran penting oksigen dalam mengatur dinamika nutrisi dalam AS-OMZ.
4.2 Dampak terhadap TBC
Peningkatan jumlah bakteri dalam Fe, Zn, Co dan mikrokosmos campuran setelah inkubasi menunjukkan bahwa pertumbuhan bakteri dalam AS-OMZ mungkin dibatasi oleh Fe, Zn dan Co dan dibatasi bersama oleh ketiganya. Unsur-unsur ini dapat secara langsung atau tidak langsung mempengaruhi metabolisme mikroba atau menginduksi perubahan dalam kualitas bahan organik yang dihasilkan oleh fitoplankton atau keduanya. Penelitian sebelumnya telah menunjukkan bahwa penambahan Fe secara langsung merangsang pertumbuhan bakteri, seperti yang diamati dalam percobaan mikrokosmos di Samudra Pasifik Khatulistiwa Timur (Cochlan 2001 ) dan Sistem Arus California (Manck et al. 2024 ). Dampak langsung dari penambahan Co pada pertumbuhan atau kelimpahan bakteri heterotrofik laut masih belum jelas (Antony et al. 2011 ), kecuali untuk Cyanobacteria laut tertentu , termasuk anggota genus Synechococcus dan Prochlorococcus , yang secara khusus membutuhkan Co untuk pertumbuhan (Sunda dan Huntsman 1995 ; Saito et al. 2002 ). Sebaliknya, efek penambahan Zn pada bakteri heterotrofik laut dilaporkan bergantung pada konsentrasi dengan dampak minimal pada kelimpahan bakteri (Bong et al. 2010 , Rasmussen dan Olapade 2016 ), konsisten dengan temuan kami.
4.3 Dampak terhadap Keanekaragaman dan Keseragaman Mikroba
Penurunan yang diamati dalam keanekaragaman mikroba dan indeks keseragaman setelah inkubasi di lapisan atas menunjukkan pengayaan filotipe tertentu. Keanekaragaman mikroba dalam sistem akuatik diatur oleh faktor bottom-up dan top-down dengan persaingan sumber daya dan akses ke karbon organik yang tersedia secara hayati sering kali membatasi pertumbuhan mikroba (Kirchman dan Rich 1997 ; Van Wambeke et al. 2002 ). Keanekaragaman yang berkurang yang diamati dalam penelitian kami kemungkinan besar merupakan hasil dari kontrol bottom-up. Namun, karena air laut yang tidak disaring digunakan dalam percobaan, pengaruh top-down yang potensial terhadap keanekaragaman tidak dapat dikesampingkan.
Dalam lapisan teroksigenasi, keanekaragaman tertinggi dari bakteri dan archaea diamati dalam perlakuan Fe. Sebaliknya, dalam lapisan terdeoksigenasi, perlakuan campuran menunjukkan keanekaragaman maksimum. Hal ini dapat dikaitkan dengan Fe sebagai nutrisi pembatas penting dalam perairan teroksigenasi, yang merangsang pertumbuhan fitoplankton dan selanjutnya mendukung beragam bakteri heterotrofik dan archaea (Moore et al. 2013 ). Dalam perairan terdeoksigenasi, komunitas mikroba didominasi oleh mikroorganisme anaerobik atau anaerobik fakultatif yang memerlukan kombinasi mikronutrien untuk mempertahankan proses metabolisme mereka (Twining dan Baines 2013 ). Misalnya, Zn sangat penting untuk dehidrogenase yang terlibat dalam fermentasi; Fe sangat penting untuk nitrogenase, enzim yang terlibat dalam fiksasi nitrogen (Twining dan Baines 2013 ); dan Co diperlukan untuk sintesis vitamin B12, yang diperlukan untuk enzim yang terlibat dalam metabolisme anaerobik, seperti metilmalonil-CoA mutase dan metionina sintase (Saito, Rocap, dan Moffett 2005 ; Noble et al. 2008 ). Oleh karena itu, keberadaan mikronutrien ini mendorong keragaman yang lebih besar di antara mikroorganisme anaerobik. Temuan ini menyoroti peran penting ketersediaan oksigen dalam memengaruhi dinamika nutrisi dan komposisi komunitas mikroba dalam ekosistem laut.
4.4 Efek pada Struktur Komunitas Prokariotik
Analisis taksonomi komunitas mikroba pada tingkat filum dan genus mengungkap respons berbeda terhadap amandemen mikronutrien pada kedalaman teroksigenasi dan deoksigenasi, yang menekankan pengaruh kritis ketersediaan oksigen dan beragam reaksi terhadap berbagai mikronutrien. Komunitas mikroba dalam sampel air yang dikumpulkan dari ASTS untuk percobaan mikrokosmos sebagian besar terdiri dari Proteobacteria , Actinobacteria , dan Thermoplasmatota (sebelumnya Marine_Group_II ). Pengamatan ini selaras dengan temuan sebelumnya dari AS-OMZ (Bandekar et al. 2018 ; Fernandes, Shenoy, dan Damare 2020 ; Paingankar et al. 2020 ; Li et al. 2024 ).
4.4.1 Kelimpahan Tingkat Filum
Dalam lingkungan aerobik, Proteobacteria menunjukkan fleksibilitas metabolik yang signifikan, memanfaatkan berbagai mekanisme ketahanan logam seperti pompa efluks dan sekuestrasi untuk menahan paparan logam (Nies 2003 ; Emerson, Fleming, dan McBeth 2010 ). Namun, dalam kondisi anaerobik, pergeseran dalam bioavailabilitas dan toksisitas logam dapat menghambat Proteobacteria yang bergantung pada respirasi aerobik (Gadd 1992 , 2010 ), yang mengarah pada penurunan populasi. Sebaliknya, Actinobacteria , yang lazim di lapisan ini, memainkan peran penting dalam dekomposisi bahan organik tetapi mungkin menghadapi kelimpahan yang berkurang di bawah tekanan logam karena gangguan dalam proses enzimatik (Haferburg dan Kothe 2007 ). Di perairan terdeoksigenasi, logam seperti Fe dan Zn dapat bertindak sebagai kofaktor dalam proses metabolisme, yang berpotensi meningkatkan kelimpahannya seperti yang diamati dalam penelitian kami (Haferburg dan Kothe 2007 ). Kehadiran eksklusif Thermoplasmatota dalam sampel air beroksigen dan peningkatan signifikan dalam perlakuan campuran menunjukkan efek sinergis, mengaktifkan beragam jalur metabolisme untuk mengatasi stres (Distaso et al. 2020 ; Yang et al. 2022 ). Demikian pula, peningkatan kelimpahan Bdellovibrionota dalam perlakuan Zn dan Co dapat dikaitkan dengan perilaku predatornya, yang menguntungkan untuk perolehan nutrisi dalam kondisi stres (Sockett 2009 ). Sebaliknya, penurunan Cyanobacteria yang nyata di semua perlakuan menyoroti sensitivitas mereka terhadap toksisitas logam, yang mengganggu mesin fotosintesis mereka (Cassier-Chauvat dan Chauvat 2014 ).
4.4.2 Kelimpahan pada Tingkat Genus
Pada lapisan teroksigenasi, bakteri Clade_Ia meningkat sebagai respons terhadap Co, yang menunjukkan kemampuan beradaptasi terhadap logam ini (Dulaquais et al. 2014 ). Demikian pula, Candidatus_Actinomarina tumbuh subur di bawah perlakuan Fe, Co, dan campuran, yang menunjukkan bahwa elemen-elemen ini merupakan kofaktor metabolik utama (Genchi et al. 2023 ). Peredibacter meningkat dalam paparan Zn dan Fe, mungkin karena peningkatan proses metabolisme (Simon, Robinson, dan Rodríguez-Quiñones 2003 ; Saper dan Rash 2009 ). Proliferasi SAR324 dalam perlakuan Fe menunjukkan keterlibatan dalam oksidasi dan reduksi yang bergantung pada Fe, meskipun perannya masih belum jelas (Boeuf et al. 2021 ; Baltar et al. 2018 ). Peningkatan AEGEAN-169 dan Clade Ib di seluruh perlakuan mencerminkan kapasitas mereka untuk menggunakan mikronutrien, memberikan keunggulan kompetitif di lingkungan kaya logam (Coclet et al. 2019 ). Penurunan populasi Mycobacterium dan Nocardioides dapat disebabkan oleh toksisitas logam, yang menyebabkan perubahan genetik dan kerentanan penyakit (Nies 2003 ; Xiong dan Yuan 2019 ). Prevalensi bakteri yang tidak terklasifikasi menunjukkan komunitas baru yang beradaptasi dengan tingkat mikronutrien yang lebih tinggi (Coclet et al. 2019 ). Dalam komunitas archaea, Marine Group II (MG-II) mendominasi perairan permukaan, karena mekanisme resistensi toksisitas logam (Timkov et al. 2019 ). Candidatus Nitrosopelagicus , archaeon pengoksidasi amonia laut, meningkat dengan Co, kemungkinan karena kemampuannya untuk menghasilkan kobalamin, kofaktor metabolik esensial (Santoro et al. 2015 ). Tingkat Co yang lebih tinggi meningkatkan produksi kobalamin, yang mendorong pertumbuhan Nitrosopelagicus , sementara stabilitasnya dalam perawatan lain mungkin disebabkan oleh adaptasi melalui gen resistensi logam atau toleransi bawaan terhadap konsentrasi logam yang tinggi (Steinert et al. 2020 ).
Dalam lingkungan yang kekurangan oksigen, genus bakteri, Marinimicrobia ( klade SAR406 ) dan SUP05 , menggunakan sulfur dan nitrogen sebagai akseptor elektron (Bertagnolli et al. 2017 ; Rathore, Sheikh, dan Singh 2021 ). Logam-logam ini meningkatkan enzim seperti hidratase nitril yang bergantung pada Fe/Co-dependent dan reduktase polisulfida yang penting untuk siklus nitrogen dan sulfur (Dulaquais et al. 2014 ; Hawley et al. 2017 ). LWQ8 meningkat dengan Zn dan perlakuan campuran, menyoroti peran Zn sebagai kofaktor metalloenzim Alcanivorax , terlibat dalam degradasi hidrokarbon, penurunan dalam perlakuan logam, mungkin karena penghambatan enzim atau diubah dalam jalur yang digerakkan oleh ion logam (Zadjelovic et al. 2020 ; Sirajuddin et al. 2014 ; Coclet et al. 2019 ). SAR202 , umum di perairan dalam yang kaya logam, kemungkinan mengoksidasi bahan organik yang membandel, dan penelitian lebih lanjut diperlukan untuk mengonfirmasi apakah Co meningkatkan kapasitas oksidasinya di lingkungan rendah oksigen (Landry et al. 2017 ). Erythrobacter , fotoheterotrof aerobik, meningkat di perairan terdeoksigenasi yang diolah dengan Zn dan Fe, menunjukkan bahwa logam ini mendorong jalur metabolisme alternatif di lingkungan yang kekurangan oksigen. Sebaliknya, SAR324 , Clade_Ia , Clade_Ib , AEGEAN-169 , dan UBA10353 menurun dalam lingkungan anaerobik, kemungkinan karena keterbatasan fleksibilitas metabolik (Chen et al. 2021 ). Archaeon, Nitrosopumilaceae , yang terkait dengan oksidasi amonia, mendominasi dalam kontrol, perlakuan Zn dan Fe, tetapi berkurang dengan Co. Perlakuan campuran mengurangi efek negatif Co, yang menunjukkan bahwa Fe dan Zn menawarkan manfaat perlindungan. Efek spesifik logam-logam ini pada Nitrosopumilaceae masih belum jelas karena kurangnya studi berbasis kultur (Herber et al. 2020 ). Woesearchaeales , yang terkait dengan metabolisme karbon dan hidrogen dalam kondisi anoksik, meningkat dengan Co dan perlakuan campuran, kemungkinan karena Co sebagai kofaktor (Huang et al. 2021 ). Kelompok Kelautan III juga dapat memanfaatkan Co, memberi mereka keuntungan dalam lingkungan yang diperkaya logam (Jose et al. 2017 ).
4.5 Pengaruh Parameter Lingkungan terhadap Komunitas Bakteri dan Archaea
Analisis statistik kami menggunakan ANOVA satu arah dan uji Dunnett post hoc mengonfirmasi bahwa setiap mikronutrien, baik yang diberikan secara individual maupun dalam kombinasi, dapat memberikan pengaruh yang berbeda pada tingkat nutrisi dan populasi mikroba baik dalam kondisi teroksigenasi maupun terdeoksigenasi. Fluktuasi yang signifikan dalam konsentrasi nutrisi menunjukkan bahwa logam jejak ini dapat memodulasi proses daur ulang nutrisi, berpotensi melalui mekanisme seperti khelasi, adsorpsi atau perubahan aktivitas mikroba yang memengaruhi ketersediaan nutrisi (Boyd dan Ellwood 2010 ; Morel dan Price 2003 ). Perubahan yang diamati dalam TBC menunjukkan bahwa mikronutrien ini dapat meningkatkan atau menghambat pertumbuhan bakteri, tergantung pada konsentrasinya dan komunitas bakteri spesifik yang ada.
Analisis komposisi komunitas bakteri menggunakan CCA mengungkapkan pengaruh mikronutrien yang mendalam pada keanekaragaman dan komposisi bakteri. Pengelompokan kelompok bakteri yang berbeda menunjukkan respons spesies yang bervariasi terhadap paparan logam, dengan beberapa kelompok mungkin mengembangkan resistensi atau mekanisme adaptif (Silver dan Phung 1996 ; Emerson, Fleming, dan McBeth 2010 ), sementara yang lain lebih rentan terhadap stres logam karena sensitivitas atau kurangnya adaptasi. Demikian pula, analisis CCA archaea menyoroti nitrat, nitrit dan fosfat sebagai nutrisi penting yang memengaruhi struktur komunitas archaea. Kehadiran silikat dan amonia menggarisbawahi relung ekologi beragam yang ditempati oleh taksa archaea yang berbeda. Taksa ini memainkan peran penting dalam memengaruhi dinamika nutrisi melalui dekomposisi organisme mengandung silika, yang mengarah pada pelepasan silikat dan amonia kembali ke kolom air, menyoroti pentingnya mereka dalam ekosistem laut dalam. Secara khusus, sampel yang diolah dengan Fe, Zn, dan Co menunjukkan peningkatan pertumbuhan taksa arkea tertentu, dengan pola pengelompokan yang jelas yang menunjukkan perubahan signifikan dalam komposisi komunitas arkea dari waktu ke waktu. Analisis korelasi antara variabel lingkungan dan keanekaragaman mikroba menggarisbawahi bagaimana amandemen logam memengaruhi dinamika nutrisi, sehingga membentuk dinamika ekologi komunitas mikroba di lingkungan laut, baik yang teroksigenasi maupun yang terdeoksigenasi.
5 Kesimpulan
Studi kami menggarisbawahi pengaruh signifikan dari mikronutrien seperti Zn, Fe dan Co pada keanekaragaman dan komposisi komunitas bakteri dan archaea di habitat laut yang teroksigenasi dan terdeoksigenasi (Yin et al. 2019 ). Meskipun penting sebagai metalloenzim (Velasco et al. 2018 ), ketidakseimbangan konsentrasi mereka dapat mengganggu struktur komunitas mikroba (Yin et al. 2019 ). Variasi tingkat nitrat dan silikat dalam sampel yang diolah menyoroti perubahan ekosistem yang berbeda antara lingkungan aerobik dan anaerobik. Kami menemukan bahwa pertumbuhan mikroba dalam AS-OMZ terutama dipengaruhi oleh ketersediaan Fe, Co dan perlakuan gabungan, dengan Fe memainkan peran penting dalam perairan teroksigenasi. Selain itu, studi kami menekankan peran signifikan ketersediaan oksigen dalam membentuk ekologi mikroba di lingkungan laut. Lebih jauh lagi, penelitian kami menyoroti kebutuhan mendesak untuk studi berbasis kultur dari berbagai bakteri dan archaea. Secara keseluruhan, temuan kami tidak hanya menyoroti beragam dampak mikronutrien pada dinamika nutrisi dan komunitas mikroba dalam kondisi oksigen berbeda, tetapi juga menekankan pentingnya karakterisasi fisiologis terperinci dari mikroba lingkungan.
