ABSTRAK
Tujuan
Studi longitudinal ini menyelidiki penuaan otak patologis pada sklerosis lateral amiotrofik (ALS) dengan mengevaluasi perbedaan antara usia kronologis dan usia struktur otak (BSA) yang diperoleh dari pembelajaran mendalam dan mengeksplorasi hubungan dengan penurunan kognitif dan fungsional.
Metode
Sepuluh pasien ALS dengan onset anggota tubuh (tujuh laki-laki) dan 10 kontrol sehat (HC) yang demografinya sesuai menjalani pencitraan resonansi magnetik struktural (sMRI) dan penilaian kognitif pada awal dan tindak lanjut. BSA diperkirakan menggunakan platform volBrain yang tervalidasi. Domain kognitif (bahasa, kelancaran verbal, fungsi eksekutif, memori, dan keterampilan visuospasial) dan kognisi global (skor total Adaptive Edinburgh Cognitive and Behavioral ALS Screen [ECAS] Persia) dinilai bersama dengan status fungsional (ALSFRS-R).
Hasil
Pasien ALS menunjukkan disparitas usia kronologis BSA yang signifikan pada awal (Δ = +7,31 tahun, p = 0,009) dan tindak lanjut (Δ = +8,39 tahun, p = 0,003), dengan percepatan perkembangan BSA dari waktu ke waktu ( p = 0,004). HC tidak menunjukkan disparitas seperti itu ( p = 0,931). Peningkatan BSA longitudinal berkorelasi dengan penurunan fungsi eksekutif ( r = -0,651, p = 0,042). Pendidikan tinggi memprediksi bahasa yang terpelihara ( r = 0,831, p = 0,003) dan kelancaran verbal ( r = 0,738, p = 0,015). Penurunan ALSFRS-R sejajar dengan visuospasial ( r = 0,642, p = 0,045) dan penurunan kognitif global ( r = 0,667, p = 0,035).
Kesimpulan
ALS ditandai dengan percepatan penuaan struktural otak yang berkembang secara independen dari usia kronologis dan berkorelasi dengan disfungsi eksekutif. Pendidikan dapat mengurangi penurunan kognitif, sementara penurunan fungsi motorik sejalan dengan gangguan kognitif visuospasial dan global. BSA telah muncul sebagai biomarker potensial untuk melacak lintasan penuaan patologis pada ALS, yang memerlukan validasi menggunakan kelompok yang lebih besar.
1 Pendahuluan
Amyotrophic lateral sclerosis (ALS) adalah penyakit neurodegeneratif progresif yang terutama memengaruhi neuron motorik atas dan bawah dan memiliki dampak kompleks pada struktur motorik dan ekstra-motorik (Christidi et al., 2018 ; Hardiman et al., 2017 ). ALS menyebabkan kelemahan otot yang melemahkan, pemborosan, dan fitur lain dari disfungsi neuron motorik (Fatehi et al., 2018 ). Ini sering berkembang dengan cepat, dengan kelangsungan hidup rata-rata 2-5 tahun setelah onset (Masrori dan Van Damme, 2020 ). Pilihan pengobatan terbatas, dan saat ini tidak ada obat yang tersedia (Tzeplaeff et al., 2023 ). Meskipun ALS dapat memengaruhi individu dari berbagai usia, risikonya meningkat secara signifikan seiring bertambahnya usia (Ingre et al., 2015 ). Khususnya, baik bentuk sporadis maupun genetis dari ALS menunjukkan karakteristik patofisiologis yang tumpang tindih dengan ciri-ciri penuaan, termasuk ketidakstabilan genomik, kerusakan DNA, disfungsi mitokondria, inflamasi, proteostasis, dan penuaan sel (Dashtmian et al., 2024 ; Jagaraj et al., 2024 ). Meskipun perawatan suportif tetap menjadi andalan manajemen ALS, beberapa tahun terakhir telah menyaksikan munculnya terapi pengubah penyakit. Riluzole (Bensimon et al., 1994 ), penghambat pelepasan glutamat, dan edaravone ( Writing Group, Edaravone (MCI-186) ALS 19 Study Group 2017 ), pemulung radikal bebas, telah menunjukkan manfaat kelangsungan hidup yang sederhana pada ALS sporadis. Selain itu, tofersen, terapi baru yang menargetkan kadar protein superoksida dismutase 1 (SOD1), telah disetujui untuk ALS familial (Miller et al., 2022 ). Meskipun menjanjikan, kemajuan ini menyoroti kebutuhan berkelanjutan akan perawatan yang lebih efektif untuk mengatasi patofisiologi ALS yang kompleks terkait penuaan dan ciri khas ALS lainnya.
Banyak proses penuaan biologis yang diatur secara berbeda dalam penyakit neurodegeneratif, termasuk disfungsi mitokondria, autofagi abnormal, perubahan epigenetik, dan peradangan (Gonzales et al., 2022 ). Penuaan merupakan faktor risiko paling signifikan untuk ALS, dengan usia rata-rata 55 tahun saat diagnosis ALS (Jagaraj et al., 2024 ). Disfungsi terkait usia pada sambungan neuromuskular dapat menjadi mekanisme patologis utama dalam ALS. Tumpang tindih antara penuaan dan ciri khas terkait ALS menunjukkan bahwa penuaan spesifik jenis sel mungkin merupakan kontributor penting untuk penyakit multifaktorial dan kompleks ini (Jagaraj et al., 2024 ).
Penuaan dikaitkan dengan beberapa perubahan struktural dan fungsional di otak, seperti atrofi materi abu-abu dan putih, perubahan cairan serebrospinal dan volume ventrikel, dan perubahan integritas mikrostruktur materi putih (Coelho dan Sousa, 2022 ). Perubahan ini terkait dengan penurunan kognitif dan peningkatan risiko gangguan neurodegeneratif. Pada ALS, daerah otak tertentu, termasuk korteks motorik, ganglia basal, dan otak kecil, dipengaruhi oleh neurodegenerasi (Menke et al., 2014 ; Ghaderi et al., 2024 ). Memahami bagaimana perubahan struktural otak ini terkait dengan penuaan dan perkembangan ALS sangat penting untuk mengembangkan alat diagnostik yang akurat dan terapi yang efektif. Baru-baru ini, pendekatan berbasis pembelajaran mendalam yang baru, usia struktur otak (BSA), diperkenalkan untuk memperkirakan usia struktur otak individu (Gambar 1 ) (Nguyen et al., 2024 ). BSA, ukuran bagaimana struktur otak seseorang dibandingkan dengan norma yang diharapkan untuk usia kronologis, menawarkan wawasan berharga tentang perkembangan penyakit neurologis, neuropsikiatri, dan neurodegeneratif. BSA ditentukan dengan menganalisis data pencitraan resonansi magnetik struktural (sMRI), awalnya membuat peta usia otak berdasarkan voxel. Peta terperinci ini kemudian digunakan untuk menghitung usia rata-rata yang diprediksi dari berbagai struktur otak untuk menghasilkan BSA. Oleh karena itu, karena penuaan menyebabkan perubahan heterogen dalam anatomi otak, penyimpangan dari lintasan penuaan yang khas dapat mengindikasikan kondisi neurologis yang mendasarinya, menjadikan BSA sangat berharga (Nguyen et al., 2024 ).
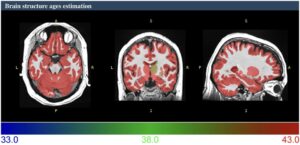
Oleh karena itu, penelitian kami bertujuan untuk (1) menyelidiki perbedaan antara estimasi BSA dan usia kronologis pada pasien ALS, (2) menentukan apakah BSA meningkat seiring waktu dibandingkan dengan penuaan sehat, dan (3) mengeksplorasi hubungan antara percepatan penuaan otak dan penurunan kognitif dan fungsional longitudinal.
2 Metode
2.1 Persetujuan Etika dan Peserta
Komite Etik Universitas Ilmu Kedokteran Teheran menyetujui penelitian ini (Kode Etik: IR.TUMS.MEDICINE.REC.1400.1173 ). Persetujuan tertulis diperoleh dari semua partisipan. Sebanyak 10 pasien dengan ALS direkrut dan ditindaklanjuti, menjalani pemeriksaan klinis untuk memastikan tidak adanya riwayat masalah neurologis, psikiatris, atau kognitif. Penilaian standar meliputi wawancara klinis, pemeriksaan neurologis, dan sMRI. Partisipan dengan riwayat keluhan sensoris, gangguan sistem saraf lainnya, atau trauma psikiatris atau otak tidak diikutsertakan. Diagnosis dipastikan melalui konsensus multidisiplin, mengikuti kriteria Awaji (Costa et al., 2012 ), dengan pasien tetap menjalankan pengobatan rutin.
Penilaian kognitif dilakukan menggunakan baterai standar, seperti yang dijelaskan secara rinci dalam penelitian kami sebelumnya (Ghaderi et al., 2024 ), untuk mengevaluasi fungsi domain tertentu, termasuk bahasa, kelancaran verbal, fungsi eksekutif, memori, dan kemampuan visuospasial. Edinburgh Cognitive and Behavioral ALS Screen (ECAS) yang diadaptasi dari bahasa Persia digunakan untuk menangkap profil kognitif.
2.2 MRI
2.2.1 Akuisisi
Citra MRI diperoleh menggunakan Siemens Prisma Scanner (2016), yang dilengkapi dengan kumparan kepala GRAPPA 64-saluran. Data struktural beresolusi tinggi diambil menggunakan sekuens MPRAGE berbobot T1 3D dengan 176 irisan aksial. Parameter pencitraan meliputi waktu pengulangan, 1840 ms; waktu gema, 2,43 ms; waktu inversi, 900 ms; ketebalan irisan, 1 mm; sudut flip, 8°; dan bidang pandang, 255 mm 2 × 255 mm 2 .
2.2.2 Analisis Gambar dan Pengukuran Usia Struktur Otak (BSA)
Awalnya, data gambar berbobot T1 diproses menggunakan perintah mri_convert ( https://surfer.nmr.mgh.harvard.edu/fswiki/mri_convert ) untuk menyesuaikan ukuran voksel, memastikan voksel isotropik (1 mm × 1 mm × 1 mm (Fatehi et al., 2018 )), seperti yang dipersyaratkan untuk analisis BSA (Nguyen et al., 2024 ; de Senneville et al., 2020 ) ( https://volbrain.net/services/BrainStructureAges ). Selanjutnya, menggunakan platform daring gratis volBrain (Manjón dan Coupé, 2016 ) ( https://volbrain.net/ ), kami menerapkan pengukuran BSA, sebuah alur kerja yang secara khusus dirancang untuk memperkirakan usia subjek biologis secara otomatis melalui pemindaian MRI otak berbobot T1. Metodologi BSA menyediakan estimasi usia untuk setiap struktur otak dengan mengandalkan model pembelajaran mendalam yang canggih. Kelompok usia ini berkontribusi dalam menentukan usia biologis subjek secara keseluruhan. Model BSA dilatih menggunakan subjek kontrol yang berusia 0 hingga 100 tahun. Pada langkah terakhir, semua struktur otak disegmentasi menggunakan AssemblyNet (Coupé et al., 2020 ). Semua data dan analisis yang diproses tersedia atas permintaan dari penulis terkait.
2.3 Analisis Statistik
Normalitas variabel dinilai menggunakan uji Shapiro–Wilk. Untuk menilai perbedaan dalam kelompok, kami menggunakan uji- t berpasangan untuk variabel parametrik untuk membandingkan usia kronologis dengan estimasi BSA pada awal, tindak lanjut, dan kontrol sehat (HC) dan estimasi BSA pada awal dengan estimasi BSA pada tindak lanjut. Uji-t sampel independen digunakan untuk perbandingan antara pasien dengan ALS dan HC. Besarnya perbedaan ditentukan dengan menggunakan ukuran efek perbedaan rata-rata terstandarisasi (SMD), dengan batas umum 0,2 untuk efek kecil, 0,5 untuk efek sedang, dan 0,8 untuk efek besar (Hedges dan Olkin, 1985 ). Analisis korelasional digunakan untuk menilai hubungan antara estimasi usia biologis dan lintasan kognitif dan fungsional (misalnya, ALSFRS-R, skor kognitif). Semua data dilaporkan sebagai rata-rata ± simpangan baku (SD). Tingkat signifikansi ditetapkan pada p < 0,05. Semua analisis statistik dilakukan menggunakan perangkat lunak SPSS V.27.0 (IBM SPSS Statistics). 3 Hasil 3.1 Gambaran Umum Karakteristik Subjek Penelitian ini melibatkan 10 pasien ALS dengan onset tungkai (tujuh laki-laki) pada awal dan tindak lanjut, dengan jenis kelamin, usia, tahun pendidikan, dan indeks massa tubuh (IMT) yang disesuaikan dengan HC (10 peserta, 7 laki-laki). Skor kognitif di semua domain menurun secara numerik dari awal hingga tindak lanjut, meskipun perubahan ini tidak signifikan secara statistik (semua p > 0,05) (Tabel 1 ). Estimasi usia kronologis dan BSA pada awal dan tindak lanjut untuk setiap pasien disajikan dalam Tabel 2 .
| Garis dasar | Menindaklanjuti | Kontrol yang sehat | nilai p a | |
|---|---|---|---|---|
| Pasien dengan ALS (timbulnya anggota badan)/laki-laki | 10/7 | 10/7 | 10/7 | 1.00 |
| Usia kronologis, tahun | 52.41 (13.93) | 52.86 (13.95) | 45.70 (7.51) | 0.353 |
| Tahun pendidikan | 14.40 (3.95) | 14.40 (3.95) | 18.50 (5.28) | 0,075 hari |
| BMI, kg/ m2 | 30.28 (4.61) | Tanggal 29.12 (6.16) | 25.60 (3.81) | 0,108 |
| Durasi penyakit, bulan | 11.70 (8.80) | 15.80 (8.69) | Bahasa Indonesia | 0.309 |
| ALSFRS-R | 41.90 (2.42) | 37.40 (2.67) | Bahasa Indonesia | 0,001 |
| Skor bahasa total (0–28) | 19.80 (6.77) | Jam 17.30 (8.13) | Bahasa Indonesia | 0.464 |
| Skor total kelancaran verbal (0–24) | 12.40 (8.53) | 9.90 (6.23) | Bahasa Indonesia | 0.464 |
| Skor eksekutif total (0–48) | Jam 24.30 (13.91) | 20.90 (12.28) | Bahasa Indonesia | 0,569 tahun |
| Skor memori total (0–24) | 11.80 (8.05) | 10.70 (7.79) | Bahasa Indonesia | 0.760 |
| Skor visuospasial total (0–12) | 9.50 (3.21) | 7.80 (3.68) | Bahasa Indonesia | 0,285 |
| Skor ECAS (0–136) | 77.80 (36.90) | 66.60 (35.02) | Bahasa Indonesia | 0.495 |
Catatan: Data disajikan sebagai mean (SD) untuk variabel kontinu atau jumlah n (%) untuk variabel kategorikal. Singkatan: ALS, amiotrofik lateral sklerosis; ALSFRS-R, skala penilaian fungsional ALS yang direvisi; BMI, indeks massa tubuh; Tidak berlaku NA. Signifikansi statistik ditetapkan pada p < 0,05.
| Garis dasar | Menindaklanjuti | |||
|---|---|---|---|---|
| Seks | Usia kronologis | Usia biologis | Usia kronologis | Usia biologis |
| M | 59.52 | 61.59 | 59.92 | 63.82 |
| F | 28.42 | 43.71 | 28.85 | 46.94 |
| M | 42.71 | 55.98 | 43.17 | 55.19 |
| M | 38.02 | 40.79 | 38.57 | 42.65 |
| M | 53.11 | 50.16 | 53.53 | 51.98 |
| M | 67.52 | 80.33 | 67.88 | 80.17 |
| M | 71.34 | 73.09 | 71.73 | 74.63 |
| F | 64.04 | 77.61 | 64.86 | 78.40 |
| F | 56.12 | 69.87 | 56.49 | 72.44 |
| M | 43.28 | tanggal 44.09 | 43.56 | 46.26 |
3.2 Perbandingan Kelompok
Kami menemukan perbedaan signifikan antara usia kronologis dan estimasi BSA pada pasien ALS pada awal dan tindak lanjut (Tabel 3 ). Pada awal, pasien dengan ALS memiliki usia kronologis rata-rata 52,41 tahun (SD = 13,93), sementara BSA yang diestimasikan secara signifikan lebih tinggi (rata-rata = 59,72 tahun, SD = 14,89; p = 0,009), dengan SMD yang besar (SMD = 1,01). Kesenjangan ini berlanjut dan melebar pada tindak lanjut, dengan usia kronologis meningkat sedikit menjadi 52,86 tahun (SD = 13,95) dan BSA meningkat menjadi 61,25 tahun (SD = 14,38; p = 0,003 vs. usia kronologis, SMD = 1,20). Perbandingan longitudinal menunjukkan percepatan signifikan dalam BSA antara garis dasar dan tindak lanjut ( p = 0,004, SMD = 1,18). Sebaliknya, HC tidak menunjukkan perbedaan signifikan dalam usia kronologis (rata-rata = 45,70 tahun, SD = 7,51) dan BSA (rata-rata = 45,55 tahun, SD = 11,87; p = 0,931, SMD = −0,028). Pasien ALS menunjukkan BSA yang jauh lebih tinggi dibandingkan dengan HC pada garis dasar ( p = 0,030, SMD = 1,01) dan tindak lanjut ( p = 0,016, SMD = 1,14), dengan ukuran efek yang besar menyoroti divergensi dalam lintasan penuaan otak.
| Estimasi usia biologis vs. usia kronologis | Perbandingan estimasi usia biologis | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Usia kronologis | Estimasi usia biologis | nilai p c | T | SMD d | Perbandingan | nilai p | T | SMD | |
| Garis dasar | 52.41 (13.93) bulan | 59.72 (14.89) | 0,009 | 3.32 | 1.01 | (Data dasar vs. tindak lanjut ) | 0,004 tahun | -3,89 | -1,18 |
| Menindaklanjuti | 52.86 (13.95) | 61.25 (14.38) | 0,003 | 3.95 | 1.20 | ||||
| Kontrol yang sehat | 45.70 (7.51) | 45.55 (11.87) | 0.931 | -0,089 | -0,028 | (Dasar vs. HC ) | 0,030 | 2.35 | 1.01 |
| (Tindak lanjut vs. HC) e | 0,016 | 2.66 | 1.14 | ||||||
Singkatan: ALS, amiotrofik lateral sklerosis; BSA, usia struktur otak; HC, kontrol sehat; SMD, perbedaan rata-rata standar. Perbandingan berpasangan diuji menggunakan uji- t sampel berpasangan untuk variabel parametrik. b Data disajikan sebagai rata-rata (SD). c Signifikansi statistik ditetapkan pada p < 0,05. d Ukuran efek, koreksi Hedges, dihitung menggunakan deviasi standar sampel dari perbedaan rata-rata (batas; sepele: −0,19 hingga 0,19; kecil: 0,2 hingga 0,49 dan −0,49 hingga −0,2; sedang: 0,5 hingga 0,79 dan −0,79 hingga −0,5; besar: ≥ 0,8 dan ≤ −0,8).
Perbandingan independen diuji menggunakan uji sampel independen untuk variabel parametrik. 3.3
Asosiasi Kognitif dan Fungsional Pada awal, usia biologis tidak berkorelasi secara signifikan dengan tahun pendidikan, BMI, durasi penyakit, skor ALSFRS-R, atau domain kognitif (semua p > 0,05). Namun, tindak lanjut longitudinal mengidentifikasi korelasi negatif yang signifikan antara usia biologis dan skor eksekutif total ( r = -0,651, p = 0,042, 95% CI: -0,908 hingga -0,035). Tahun pendidikan menunjukkan hubungan positif yang kuat dengan kinerja kognitif pada kedua titik waktu, khususnya dengan skor bahasa total (dasar: r = 0,831, p = 0,003; tindak lanjut: r = 0,661, p = 0,038) dan skor kelancaran verbal total (dasar: r = 0,727, p = 0,017; tindak lanjut: r = 0,738, p = 0,015). Skor ALSFRS-R berkorelasi dengan skor memori total pada awal ( r = 0,796, p = 0,006), skor visuospasial total ( r = 0,642, p = 0,045), dan skor ECAS ( r = 0,667, p = 0,035) pada tindak lanjut.
4 Diskusi
Estimasi BSA menawarkan penilaian yang lebih individual, yang berpotensi memungkinkan identifikasi pasien yang berisiko lebih tinggi mengalami perkembangan penyakit yang cepat. Hasil kami menunjukkan perbedaan yang signifikan antara usia kronologis dan estimasi BSA pada pasien dengan ALS, baik pada awal maupun tindak lanjut, sementara tidak ada perbedaan pada HC. Disparitas ini, yang dicirikan oleh peningkatan substansial dalam BSA relatif terhadap usia kronologis, menggarisbawahi percepatan laju penuaan biologis pada individu-individu ini. Peningkatan yang konsisten dalam estimasi BSA dari waktu ke waktu semakin mendukung gagasan tentang kemunduran biologis progresif pada ALS (Dashtmian et al., 2024 ). Disparitas antara usia kronologis dan biologis tersebut telah dilaporkan pada penyakit neurodegeneratif lainnya, di mana stresor sistemik dan seluler berkontribusi pada fenotipe penuaan yang dipercepat (Gonzales et al., 2022 ; Guo et al., 2022 ; López-Otín et al., 2023 ). Pada ALS, hal ini mungkin mencerminkan efek kumulatif dari neuroinflamasi, stres oksidatif, dan disfungsi mitokondria, yang semuanya merupakan ciri khas penyakit ini (Dashtmian et al., 2024 ; Obrador et al., 2020 ; Zhang et al., 2023 ; Xiong et al., 2022 ).
Pengamatan bahwa estimasi BSA secara signifikan lebih tinggi daripada usia kronologis pada pasien ALS sejalan dengan hubungan yang mapan antara usia dan ALS. Penuaan dianggap sebagai faktor risiko paling menonjol untuk ALS (Jagaraj et al., 2024 ); risiko sebelum usia 40 tahun sangat rendah, mencapai puncaknya setelah usia paruh baya (Mehta et al., 2022 ), dan tampaknya menurun pada orang dewasa yang sangat tua dengan insidensi puncak antara usia 70 dan 79 tahun (Ingre et al., 2015 ; Alonso et al., 2009 ; Huisman et al., 2011 ). Insiden ALS kontras dengan penyakit neurodegeneratif terkait usia lainnya (Dashtmian et al., 2024 ) seperti penyakit Alzheimer (Mukadam et al., 2024 ; Kukull et al., 2002 ) dan penyakit Parkinson (Van Den Eeden et al., 2003 ; Willis et al., 2022 ; Wright Willis et al., 2010 ), yang menunjukkan interaksi unik antara penuaan dan patofisiologi ALS (Dashtmian et al., 2024 ). Lebih jauh lagi, temuan kami menunjukkan bahwa ALS tidak hanya berkorelasi dengan penuaan tetapi dapat secara aktif mempercepat proses penuaan (Jagaraj et al., 2024 ). Penuaan yang dipercepat dapat memperburuk mekanisme neurodegeneratif dan menciptakan siklus yang memperkuat diri yang mendorong perkembangan penyakit.
Perkembangan BSA yang signifikan antara awal dan tindak lanjut semakin memperkuat argumen untuk percepatan penuaan pada ALS, dan memperkenalkan penuaan otak patologis. Percepatan penuaan biologis ini dapat dikaitkan dengan berbagai faktor, termasuk akumulasi kerusakan seluler, seperti kerusakan DNA, disfungsi mitokondria, neuroinflamasi, stres oksidatif, dan penuaan seluler (Hou et al., 2019 ; Mitra et al., 2019 ; Wang et al., 2016 ; Lopez-Gonzalez et al., 2016 ). Pada ALS, proses ini dapat diperburuk oleh degenerasi neuron motorik dan hilangnya massa dan fungsi otot berikutnya (Dashtmian et al., 2024 ; Campbell et al., 1973 ). Selain itu, peradangan kronis, ciri khas ALS, dapat mempercepat penuaan seluler dan berkontribusi pada penuaan sistemik (Baechle et al., 2023 ). Dengan demikian, ciri-ciri penuaan, termasuk faktor-faktor ini, semakin diakui sebagai pendorong potensial penuaan dan penyakit terkait usia seperti ALS (Guo et al., 2022 ; Baechle et al., 2023 ; Shafiq et al., 2021 ).
Tidak adanya korelasi dasar antara usia biologis dan skor kognitif dapat mencerminkan mekanisme kompensasi tahap awal atau perkembangan penyakit yang tidak memadai untuk mengungkap hubungan ini, yang menjadi jelas secara longitudinal (Jellinger, 2023 ). Korelasi negatif yang signifikan antara usia biologis dan fungsi eksekutif pada tindak lanjut menyoroti hubungan yang bergantung pada waktu antara percepatan penuaan otak dan disfungsi eksekutif. Ini sejalan dengan penelitian sebelumnya yang mengimplikasikan degenerasi jaringan frontal-striatal pada gangguan eksekutif terkait ALS (Štukovnik et al., 2010 ), yang menunjukkan bahwa BSA dapat berfungsi sebagai biomarker untuk melacak penurunan kognitif spesifik domain. Hubungan yang kuat antara pendidikan dan kinerja kelancaran bahasa/verbal yang terjaga mendukung hipotesis cadangan kognitif, di mana pencapaian pendidikan yang lebih tinggi dapat mengurangi ekspresi klinis neurodegenerasi pada ALS (Temp et al., 2022 ). Khususnya, hubungan longitudinal antara penurunan ALSFRS-R dan memburuknya skor visuospasial/ECAS menunjukkan adanya perkembangan disfungsi motorik dan kognitif yang bersamaan, konsisten dengan konsep ALS sebagai gangguan multisistem (Chiò et al., 2019 ; Ghaderi et al., 2024 ).
5 Keterbatasan dan Arah untuk Penelitian Masa Depan
Meskipun penelitian ini berfokus pada BSA sebagai indikator percepatan penuaan pada ALS, berbagai sumber mengakui peran penting genetika dalam penyakit kompleks ini. Sekitar 10% kasus ALS adalah ALS familial, yang terkait dengan mutasi pada berbagai gen, termasuk SOD1, kromosom 9 open reading frame 72 (c9orf72), transactive response DNA-binding protein 43 kDa (TAR DNA-binding protein 43 atau TDP-43), dan fused in sarcoma/translated in liposarcoma (FUS/TLS) (Shafiq et al., 2021 ; Volk et al., 2018 ; Wang et al., 2023 ). Gen-gen ini, khususnya SOD1, terlibat dalam proses seluler kritis yang, jika terganggu, berkontribusi pada ciri-ciri penuaan (Guo et al., 2024 ). Misalnya, SOD1, yang bertanggung jawab untuk mendetoksifikasi radikal superoksida, berperan dalam menjaga stabilitas genom, ciri utama penuaan (Eleutherio et al., 2021 ). Mutasi pada SOD1, yang umum ditemukan pada ALS familial, dapat menyebabkan perolehan fungsi toksik, yang menyebabkan akumulasi protein SOD1 yang salah lipat dan mengganggu homeostasis seluler (Brasil et al., 2018 ; Peggion et al., 2022 ). Gangguan ini berpotensi mempercepat penuaan dengan memperburuk stres seluler, mengganggu proteostasis, dan mendorong disfungsi mitokondria (Shafiq et al., 2021 ). Studi pada tikus transgenik SOD1 lebih lanjut menggambarkan pengaruh genetik pada manifestasi penyakit terkait usia, dengan timbulnya penyakit berkorelasi dengan tingkat ekspresi SOD1 mutan (De Giorgio et al., 2019 ). Meskipun penelitian ini tidak secara langsung menyelidiki susunan genetik peserta, penuaan dini yang diamati, tercermin dalam BSA yang meningkat secara signifikan pada kelompok yang relatif muda (usia rata-rata 52,41 tahun), menunjukkan peran potensial predisposisi genetik dalam mendorong penuaan dini pada ALS (Shafiq et al., 2021 ). Penelitian lebih lanjut diperlukan untuk mengeksplorasi interaksi kompleks antara varian genetik tertentu dan penuaan dini pada ALS, yang berpotensi mengungkap subtipe penyakit, perkembangan, dan strategi pengobatan yang dipersonalisasi.
Meskipun penelitian ini menawarkan bukti awal yang mendukung konsep penuaan patologis pada ALS, penelitian lebih lanjut diperlukan untuk menjelaskan sepenuhnya mekanisme yang mendasari dan implikasi klinis. Penelitian di masa mendatang harus menyelidiki daerah otak spesifik yang paling terpengaruh oleh penuaan yang dipercepat pada ALS menggunakan estimasi kesenjangan usia otak (BSAGE) (Nguyen et al., 2024 ). Lebih jauh lagi, keterbatasan penelitian ini, termasuk ukuran sampelnya yang kecil dan data genetik, harus ditangani dalam penelitian di masa mendatang. Memperluas populasi penelitian dan memasukkan individu dengan berbagai subtipe ALS, seperti ALS onset bulbar, akan meningkatkan generalisasi temuan kami. Selain itu, menggabungkan ukuran penuaan biologis lainnya, seperti panjang telomer dan jam epigenetik, dapat memberikan pemahaman yang lebih komprehensif tentang proses penuaan (Zhang et al., 2023 ; Horvath dan Ritz, 2015 ; Salvioli et al., 2023 ; Rodríguez-Fernández et al., 2022 ). Periode tindak lanjut relatif singkat, yang mungkin membatasi kemampuan untuk menangkap tren jangka panjang dalam penuaan biologis. Memperpanjang periode tindak lanjut akan memberikan pemahaman yang lebih menyeluruh tentang dinamika temporal perkembangan BSA pada pasien ALS.
6 Kesimpulan
Studi kami mengungkap percepatan penuaan biologis dan mengonfirmasi penuaan patologis temporal pada pasien ALS, sebagaimana dibuktikan oleh perbedaan signifikan antara estimasi BSA dan usia kronologis. Perkembangan BSA dari waktu ke waktu menggarisbawahi sifat dinamis dan majemuk penuaan dalam konteks patofisiologi ALS, yang menunjukkan bahwa menargetkan proses penuaan itu sendiri dapat menjadi jalan yang menjanjikan untuk intervensi terapeutik di masa mendatang yang bertujuan untuk memperlambat atau membalikkan proses penuaan pada pasien ALS. Temuan neuroimaging primer ini memberikan dasar untuk penelitian di masa mendatang yang bertujuan untuk mengungkap mekanisme yang mendorong percepatan penuaan pada ALS dan mengidentifikasi intervensi untuk mengurangi dampaknya.
