ABSTRAK
Perkembangan keratitis bakteri yang cepat memerlukan intervensi terapeutik yang cepat. Metodologi terapeutik saat ini dicirikan oleh durasinya yang lama dan sifatnya yang invasif, yang sering kali mengakibatkan terapi antibiotik yang kurang optimal. Akibatnya, ada persyaratan penting untuk pengembangan pendekatan terapeutik baru untuk penanganan keratitis bakteri. Dalam penelitian ini, kami menyajikan dua jenis XOF yang dihubungkan oleh interaksi [N···Br + ···N]. Kerangka kerja ini dikarakterisasi menggunakan 1 H NMR, IR, XPS, SAXS, dan HR-TEM. Model struktural dua dimensi (2D) dibuat berdasarkan data PXRD dan simulasi teoritis. Aplikasi XOF ini sebagai agen antibakteri baru untuk pengobatan keratitis bakteri dieksplorasi, dan efek dari simpul koneksi yang berbeda dan hidrofilisitas pada kemanjuran antibakteri XOF dibandingkan. Seperti yang diharapkan, efek terapi XOF berdasarkan interaksi [N···Br + ···N] lebih unggul daripada XOF berdasarkan interaksi [N···I + ···N]. Efek terapi XOF berbasis TPPA dengan hidrofilisitas yang baik lebih baik daripada XOF berbasis TPPE . Selain itu, agen fototermal (IR820) dimasukkan ke dalam XOF(Br)-TPPA untuk fototermal dan kemoterapi gabungan, dengan hasil eksperimen yang menunjukkan peningkatan substansial dalam kemanjuran terapi. Pekerjaan ini tidak hanya memperdalam pemahaman kita tentang kerangka organik berikatan halogen tetapi juga membuka jalan bagi penerapan XOF dalam bahan biomedis.
1 Pendahuluan
Keratitis bakterial adalah kondisi mata yang mengancam penglihatan yang dikenal sebagai penyebab utama kebutaan monokuler di negara maju dan berkembang [ 1 – 3 ]. Keratitis bakterial akibat infeksi oleh P. aeruginosa dapat menyebabkan kerusakan kornea yang parah, nyeri, gangguan penglihatan, dan bahkan kebutaan jika tidak diobati tepat waktu [ 4 ]. Di klinik, obat tetes mata antibiotik yang diperkaya spektrum luas umumnya digunakan sebagai pengobatan utama untuk keratitis bakterial [ 5 ]. Meskipun aplikasinya luas, pendekatan ini memiliki beberapa keterbatasan, termasuk efisiensi terapi yang rendah, bioavailabilitas yang tidak memadai, dan masalah infeksi yang resistan terhadap antibiotik yang semakin meningkat [ 6 – 8 ]. Penggunaan antibiotik ini dalam jangka panjang juga dapat menyebabkan toksisitas pada epitel kornea, yang berpotensi mengakibatkan kerusakan sekunder [ 9 – 12 ]. Strategi non-antibiotik dapat menawarkan solusi inovatif dalam menghindari masalah yang terkait dengan MDRO, memberikan intervensi terapi yang lebih efektif [ 13 ]. Saat ini, strategi pengobatan untuk keratitis bakteri telah mengeksplorasi berbagai bahan untuk meningkatkan hasil terapi [ 14 , 15 ], termasuk nanopartikel anorganik (NPs) [ 16 – 21 ], peptida antimikroba (AMPs) [ 22 , 23 ], kopolimer organik [ 24 – 26 ], dan kerangka organik [ 27 , 28 ]. Melihat gambaran umum dari bahan-bahan yang dilaporkan, kerangka organik dengan porositas tinggi dan struktur yang dapat disesuaikan menunjukkan janji tertentu dalam enkapsulasi dan pelepasan agen antimikroba yang efisien [ 29 , 30 ].
Dalam beberapa tahun terakhir, struktur supramolekul telah mendapatkan perhatian sebagai agen antibakteri yang efektif, memanfaatkan interaksi non-kovalen yang dapat beradaptasi dengan biomolekul dan kemampuan untuk mengintegrasikan agen aktif [ 31 , 32 ]. Bahan-bahan serbaguna ini semakin banyak digunakan dalam perawatan kesehatan untuk diagnostik dan mengobati infeksi bakteri [ 33 , 34 ]. Ikatan halogen (XB) adalah motif penting dalam interaksi kimia yang didasarkan pada interaksi tarik menarik bersih antara bagian elektrofilik yang terkait dengan atom halogen dalam entitas molekuler dan situs nukleofilik, baik yang terkait dengan entitas molekuler yang sama atau berbeda [ 35 ], Hal ini memungkinkan spesifisitas arah yang signifikan, menyediakan platform yang kuat untuk perakitan struktur supramolekul yang unik, yang telah banyak digunakan dalam rekayasa kristal [ 36 ], pengenalan molekuler [ 37 ], katalisis [ 38 ], dan desain obat [ 39 ]. Munculnya rangka organik terikat halogen (XOF) telah memperkenalkan kategori bahan supramolekul yang baru dan menarik [ 40 , 41 ]. Dalam rekayasa kristal, dengan merancang struktur donor dan akseptor XB tradisional, molekul organik netral secara elektrik atau ion garam zwitterionik dan anorganik dapat dihubungkan untuk membentuk kristal komponen tunggal atau eutektik multikomponen, membentuk struktur XOF tradisional dengan koneksi [R–X···Y] [ 42 , 43 ]. Khususnya, XOF tertentu, yang dibangun di atas tiga pusat empat elektron [N···X + ···N] XB yang khas, telah dieksplorasi secara ekstensif untuk mewujudkan fungsionalitas yang disesuaikan, termasuk penyerapan polutan [ 44 – 46 ], proses halogenasi [ 47 ], aktivitas katalitik [ 48 – 50 ], dan sifat magnetik [ 51 ]. Penggabungan ion halonium (X + ) dalam kerangka XOF memberikan kerangka organik kationik unik yang dicirikan oleh sifat oksidasi [ 49 ] dan atribut hidrofilik [ 50 ]. Stabilitas [N···X + ···N] XBs memastikan retensi integritas kerangka dalam lingkungan berair, yang merupakan pertimbangan penting dalam formulasi antibakteri. Peningkatan hidrofilisitas XOF yang rasional merupakan langkah penting dalam pengembangan bahan antibakteri supramolekul yang inovatif.
Terapi fototermal (PTT) memainkan peran penting dalam antimikroba, memungkinkan pengobatan non-invasif, selektif target dengan efek samping minimal [ 52 , 53 ]. Aplikasi PTT mengubah cahaya menjadi energi panas, yang dapat digunakan untuk membunuh bakteri dengan cara memecah membran sel dan mendenaturasi protein [ 54 ]. Panas yang dihasilkan dapat digunakan untuk meningkatkan efek terapi XOF (pada situs X + aktif ). Penelitian telah mengkonfirmasi bahwa kombinasi PTT dengan metode terapi lain menghasilkan respons antimikroba sinergis yang efektif, memungkinkan peningkatan efisiensi dengan efek samping yang berkurang [ 55 ].
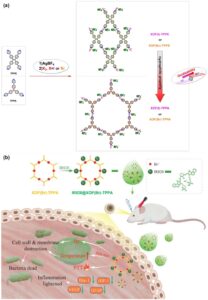
Di sini, dua XOF berdasarkan interaksi [N···Br + ···N] dengan ligan (1,1,2,2-tetrakis(4-(piridin-4-il)fenil) etilen ( TPPE ) dan tri(4-piridilfenil)amina ( TPPA )) berhasil dirancang dan dibangun. Efek dari memvariasikan simpul koneksi ion halonium (X + ) dan hidrofilisitas pada sifat antimikroba yang dihasilkan telah dieksplorasi. Aplikasi XOF untuk mengobati keratitis bakteri yang disebabkan oleh Pseudomonas aeruginosa pada tikus telah diperiksa. Efek terapeutik XOF(Br) lebih unggul daripada XOF(I) karena kemampuan oksidasi Br + yang lebih besar . Selain itu, efek terapeutik XOF berbasis TPPA hidrofilik melebihi XOF berbasis TPPE . Selain itu, IR820 ditambahkan sebagai fotosensitizer ke XOF(Br)-TPPA , memfasilitasi kemoterapi/PTT gabungan untuk terapi antibakteri sinergis, seperti yang diilustrasikan dalam Skema 1. Sistem IR820@XOF(Br)-TPPA memberikan efek terapeutik yang lebih unggul untuk XOF(Br)-TPPA , mengurangi waktu perawatan yang dibutuhkan, di mana peningkatan suhu mendorong oksidasi oleh XOF, meningkatkan efek terapeutik. Temuan studi ini telah memperluas struktur, fungsionalitas, dan aplikasi XOF, menawarkan sistem terapi material baru untuk keratitis bakteri.
2 Hasil dan Pembahasan
XOF (Br)-TPPA dan XOF(Br)-TPPE disiapkan menggunakan tri(4-piridilfenil) amina ( TPPA ) dan 1,1,2,2-tetrakis(4-(piridin-4-il) fenil) etilen ( TPPE ) dalam reaksi pertukaran kation [N···Ag + ···N] → [N···Br + ···N] in situ (Skema S1 ). XOF(I)-TPPA dan XOF(I)-TPPE disiapkan dan dikarakterisasi mengikuti prosedur yang dilaporkan [ 44 , 56 ].
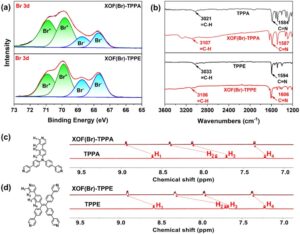
Pembentukan XOF(Br)-TPPA dan XOF(Br)-TPPE dievaluasi dengan spektroskopi fotoelektron sinar-X (XPS) (Gambar 1a ). Puncak pada 69,8 eV (Br 3d 3/2 ) dan 70,9 eV (Br 3d 5/2 ) dari XOF(Br)-TPPA dikaitkan dengan Br + , sedangkan puncak Br 3d 3/2 pada 67,7 eV dan Br 3d 5/2 pada 68,7 eV dikaitkan dengan Br − pada spesies AgBr. Spektrum XPS serupa diamati untuk XOF(Br)-TPPE . Spektrum inframerah transformasi Fourier (FT-IR) menunjukkan bahwa XOF(Br)-TPPA dan XOF(Br)-TPPE menunjukkan pergeseran biru yang signifikan pada vibrasi peregangan C═N masing-masing sebesar 3 dan 12 cm −1 , jika dibandingkan dengan monomer TPPA dan TPPE . Vibrasi peregangan ═C─H juga menunjukkan pergeseran biru masing-masing sebesar 86 dan 73 cm −1 (Gambar 1b ). Pembentukan XOF(Br)-TPPA/TPPE diteliti dengan 1 H NMR (Gambar 1c ). Pembentukan XOF(Br)-TPPA disertai dengan pergeseran puncak untuk H 1 dan H 2 dari 8,60 menjadi 8,94 ppm dan 7,83 menjadi 8,40 ppm, sedangkan puncak untuk H 3 dan H 4 bergeser dari 7,70 menjadi 8,12 ppm dan 7,22 menjadi 7,36 ppm, masing-masing. Dalam kasus XOF(Br)-TPPE , pergeseran downfield serupa diamati (dari 8,58 menjadi 8,90 ppm untuk H 1 , dari 7,69 menjadi 8,32 ppm untuk H 2 , dari 7,66 menjadi 7,96 ppm untuk H 3 , dan dari 7,37 menjadi 7,22 ppm untuk H 4 ). Efek deshielding ini dapat dikaitkan dengan penurunan kerapatan elektron dari gugus aromatik selama koordinasi dengan Br + .
Struktur kristal XOF(Br)-TPPE dan XOF(Br)-TPPA dievaluasi menggunakan analisis difraksi sinar-X serbuk (PXRD). Metode modul dinamika molekuler Forcite dan penyempurnaan Pawley di Materials Studio digunakan untuk menjelaskan strukturnya. Model penumpukan gerhana (AA) dan penumpukan stagger (AB) dari XOF(Br)-TPPE dan XOF(Br)-TPPA dibangun dan dioptimalkan menggunakan metode modul dinamika molekuler Forcite Materials Studio (Gambar S1–S4 ). Pola PXRD yang ditentukan secara eksperimen dari XOF(Br)-TPPE sangat cocok dengan pola simulasi model penumpukan AB (Gambar 2a ). Penyempurnaan Pawley dilakukan dengan pola difraksi untuk XOF(Br)-TPPE untuk menghasilkan sel satuan dengan a = 36,04 Å, b = 24,78 Å, c = 13,40 Å, α = β = γ = 90° ( R wp = 3,24%, R p = 1,48%). Puncak difraksi intens (110) diamati pada 2 θ = 4,50°, dan puncak difraksi pada 6,76°, 7,18°, 8,80°, 9,11°, dan 9,89° diindeks sebagai refleksi (001), (101), (220), (211), dan (021), masing-masing. Pola PXRD eksperimental XOF(Br)-TPPA sangat cocok dengan pola simulasi model penumpukan AA (Gambar 2d ). Penyempurnaan Pawley dilakukan dengan pola difraksi untuk XOF(Br)-TPPA untuk menghasilkan sel satuan dengan a = 36,38 Å, b = 36,03 Å, c = 4,16 Å, α = β = 90°, γ = 120° ( R wp = 2,74%, R p = 1,89%). Puncak difraksi intens (110) diamati pada 2 θ = 4,88°.
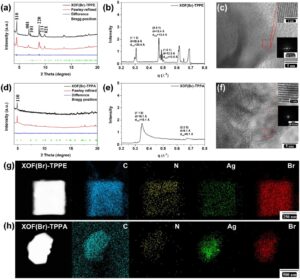
Urutan struktural XOF(Br)-TPPE dan XOF(Br)-TPPA juga diselidiki dengan hamburan sinar-X sudut kecil (SAXS). Profil SAXS untuk XOF(Br)-TPPE menunjukkan puncak pada jarak d 12,5, 13,4, dan 20,4 Å, yang masing-masing sesuai dengan jarak (101), (001), dan (110) (Gambar 2b ). Profil SAXS untuk XOF(Br)-TPPA menunjukkan dua puncak pada jarak d 9,1 Å dan 18,1 Å, yang sesuai dengan jarak (220) dan (110) (Gambar 2e ). Temuan ini menunjukkan bahwa XOF(Br)-TPPE dan XOF(Br)-TPPA membentuk jaringan organik supramolekul periodik. Morfologi XOF(Br)-TPPE dan XOF(Br)-TPPA diteliti dengan mikroskop elektron transmisi resolusi tinggi (HR-TEM). Citra HR-TEM dari XOF(Br)-TPPE dan XOF(Br)-TPPA menunjukkan pinggiran kisi yang jelas (Gambar 2c,f ), yang menunjukkan kristalinitas tinggi untuk semua kerangka organik. Selain itu, pemetaan unsur spektroskopi sinar-X dispersif energi (EDS) telah menunjukkan distribusi seragam C, N, Ag, dan Br dalam XOF(Br)-TPPE dan XOF(Br)-TPPA (Gambar 2g,h ). Analisis termogravimetri (TGA) mengungkapkan bahwa XOF(Br)-TPPA menunjukkan sedikit kehilangan berat hingga 200°C dalam atmosfer N2 (Gambar S5 ) . Berat XOF(Br)-TPPE sebagian besar tidak berubah hingga 250°C (Gambar S6 ). Hasil TGA untuk kedua XOF telah menunjukkan stabilitas termal yang baik.
Untuk menilai kemampuan antimikroba dari XOF(I)-TPPE , XOF(I)-TPPA , XOF(Br)-TPPE , dan XOF(Br)-TPPA , Escherichia coli (gram negatif) dan Staphylococcus aureus (gram positif) digunakan sebagai bakteri model untuk mengevaluasi aktivitas antibakteri; TPPE , TPPA , AgI, dan AgBr berfungsi sebagai kontrol. Zona penghambatan digunakan untuk mengevaluasi secara kualitatif kemampuan antibakteri relatif (Gambar 3a,b ). Diameter zona penghambatan untuk XOF(Br)-TPPA pada E. coli adalah 17,0 mm, dan S. aureus adalah 11,5 mm (Gambar 3c,d ). Diameter zona penghambatan untuk XOF(Br)-TPPE terhadap E. coli dan S. aureus adalah 11,0 dan 7,5 mm, berturut-turut. Sebaliknya, diameter zona inhibisi untuk XOF(I)-TPPA pada E. coli adalah 3,5 mm, dan S. aureus adalah 4,0 mm. Diameter zona inhibisi untuk XOF(I)-TPPE terhadap E. coli dan S. aureus masing-masing adalah 3,0 dan 4,0 mm. Baik E. coli maupun S. aureus tumbuh dengan baik pada media kultur di dekat TPPE dan TPPA , yang menyiratkan bahwa mereka tidak memiliki aktivitas antibakteri terhadap E. coli dan S. aureus (Gambar S7a,b ).
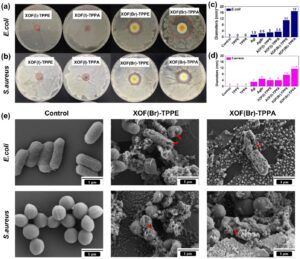
XOF (I)-TPPE/TPPA dan XOF(Br)-TPPE/TPPA menunjukkan efek penghambatan yang signifikan terhadap E. coli dan S. aureus , yang menunjukkan peran penting kation I + /Br + dalam menentukan aktivitas antibakteri. XOF(Br)-TPPE/TPPA menunjukkan aktivitas antibakteri yang lebih unggul dibandingkan dengan XOF(I)-TPPE/TPPA , yang dapat dikaitkan dengan kemampuan oksidasi kation Br + yang lebih tinggi . Lebih jauh, XOF(Br/I)-TPPA menunjukkan aktivitas antibakteri yang lebih baik daripada XOF(Br/I)-TPPE , yang dapat dikaitkan dengan peningkatan hidrofilisitas kerangka kerja berbasis TPPA dibandingkan dengan kerangka kerja berbasis TPPE . Kebasahan merupakan faktor penting yang memengaruhi efisiensi antibakteri. Sudut kontak air (WCA) terukur untuk XOF(Br)-TPPA , XOF(I)-TPPA , dan TPPA masing-masing adalah 20°, 54°, dan 61°, sedangkan WCA untuk XOF(Br)-TPPE , XOF(I)-TPPE , dan TPPE masing-masing adalah 35°, 64°, dan 70°. Sistem XOF(Br/I)-TPPA menunjukkan keterbasahan yang lebih unggul dibandingkan dengan XOF(Br/I)-TPPE , yang berkorelasi dengan peningkatan aktivitas antibakteri yang diamati.
Untuk lebih lanjut menunjukkan efek antibakteri dari XOF(Br)-TPPA dan XOF(Br)-TPPE , morfologi E. coli dan S. aureus yang diobati dengan XOF(Br)-TPPA dan XOF(Br)-TPPE dianalisis dengan SEM. E. coli yang tidak diobati menunjukkan struktur seperti batang dengan permukaan halus. Sebaliknya, permukaan bakteri setelah pengobatan XOF(Br)-TPPA dan XOF(Br)-TPPE (Gambar 3e ) menjadi kasar dan berkerut atau bahkan rusak; membran sel tidak lagi utuh. Perubahan serupa terjadi pada S. aureus , di mana permukaan tampak berkerut setelah pengobatan dengan XOF(Br)-TPPA dan XOF(Br)-TPPE . Dalam proses ini, I + atau Br + menembus bakteri, menghancurkan integritas membran. Selain itu, AgI atau AgBr yang dihasilkan selama persiapan material dapat memainkan peran sinergis dalam proses antibakteri. Hasilnya menegaskan bahwa kerangka organik XOF(Br)-TPPA dan XOF(Br)-TPPE yang terikat halogen dapat berfungsi sebagai bahan biomedis antibakteri yang efektif.
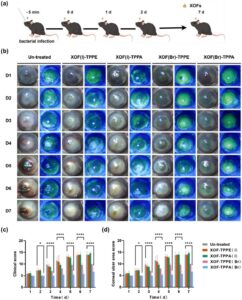
Khasiat antimikroba in vivo dari XOF diselidiki lebih lanjut dengan mengobati model murine keratitis bakteri yang disebabkan oleh P. aeruginosa . Infeksi dengan P. aeruginosa mengakibatkan kerusakan kornea, yang diberi label menggunakan pewarna yang larut dalam air (fluorescein). Dosis XOF (I/Br) untuk pengobatan keratitis P. aeruginosa pada tikus yang dimodelkan dioptimalkan menggunakan XOF(Br)-TPPA sebagai kasus representatif. Tiga gradien konsentrasi (10, 20, dan 50 mg/mL) XOF(Br)-TPPA diberikan pada dosis 20 µL per hari setelah 5 menit infeksi. Pada kelompok perlakuan, gejala tikus yang diobati dengan 20 mg/mL XOF(Br)-TPPA menunjukkan gejala paling ringan, dengan kekeruhan kornea sedikit, penetrasi pupil, dan area ulkus kornea dan neovaskularisasi yang secara signifikan lebih rendah daripada kelompok lain. Pada kelompok kontrol, ulkus menyebar ke hampir seluruh permukaan kornea dalam 24 jam. Kerusakan kornea pulih perlahan dalam waktu sekitar 1 minggu (Gambar S9 ). Hasil skor kritik klinis pada gambar representatif kornea tikus juga konsisten (Gambar S10 ). Efek terapeutik dievaluasi setelah 7 hari pengobatan. Kelompok pengobatan XOF(Br)-TPPA 20 mg/mL memiliki skor klinis terendah (6,3 ± 1,5), yang menunjukkan perbaikan paling signifikan dalam kesehatan kornea secara keseluruhan. Ini lebih unggul daripada kelompok 50 mg/mL (12,0 ± 1,7) dan 10 mg/mL (8,7 ± 0,6) dan kelompok yang tidak diobati (13,0 ± 1,4). Selain itu, kelompok pengobatan XOF(Br)-TPPA 20 mg/mL menunjukkan skor kedalaman lesi terendah (1,3 ± 0,6), yang menunjukkan pengurangan kerusakan kornea yang paling efektif. Hal ini lebih unggul dibandingkan kelompok 50 mg/mL (2,7 ± 0,6) dan 10 mg/mL (2,0 ± 0,0) dan kelompok yang tidak diobati (3,8 ± 0,5). Hasil ini mengonfirmasi efikasi antimikroba in vivo dari XOF(Br)-TPPA , di mana konsentrasi 20 mg/mL memberikan efek terapi yang optimal.
Bahasa Indonesia: Untuk menilai efikasi terapeutik XOF(I/Br)-TPPA dan XOF(I/Br)-TPPE terhadap keratitis bakterial, suspensi 20 mg/mL dari setiap sampel diberikan setiap hari kepada model murine keratitis yang diinduksi P. aeruginosa (Gambar 4a ). Tikus yang diobati dengan XOF(Br)-TPPA menunjukkan perbaikan signifikan, dengan pengurangan substansial dalam kekeruhan kornea, kekeruhan, neovaskularisasi, dan penyembuhan ulkus yang dipercepat (Gambar 4b dan S11) . Sebaliknya, tikus kontrol yang diobati dengan saline, XOF(I)-TPPA , dan XOF(I)-TPPE menunjukkan kondisi kornea yang memburuk, ditandai dengan peningkatan kekeruhan, akumulasi nanah, neovaskularisasi, dan, dalam beberapa kasus, perforasi. Setelah 5 hari pengobatan, kelompok yang diobati dengan XOF(Br)-TPPA menunjukkan skor klinis terendah (5,3 ± 0,6), yang menunjukkan kemanjuran terapi yang lebih unggul, dibandingkan dengan XOF(Br)-TPPE (9,7 ± 0,6), XOF(I)-TPPA (12,7 ± 0,6), XOF(I)-TPPE (13,0 ± 1,0), dan kelompok yang tidak diobati (13,2 ± 1,0) (Gambar 4c ). Tren serupa diamati sehubungan dengan skor area ulkus kornea: 5,3 ± 0,6 untuk XOF(Br)-TPPA , 9,7 ± 0,6 untuk XOF(Br)-TPPE , 12,7 ± 0,6 untuk XOF(I)-TPPA , 13,0 ± 1,0 untuk XOF(I)-TPPE , dan 5,3 ± 0,6 untuk kelompok yang tidak diobati (Gambar 4d ). Kedalaman lesi dan neovaskularisasi kornea memberikan hasil yang serupa (Gambar S11 ). Peningkatan efikasi XOF(Br)-TPPA dapat dikaitkan dengan kemampuan oksidasi yang lebih besar dari Br + dibandingkan dengan I + . Karena XOF, bahan-bahan tersebut didasarkan pada sambungan non-kovalen. Dalam proses pengobatan, kation halogen, yang berfungsi sebagai unit penghubung dalam XOF, memberikan pengaruh yang signifikan. Oleh karena itu, setelah pengobatan, kation halogen dikonsumsi, yang menyebabkan kolapsnya XOF, dan kesimpulan eksperimen yang sesuai dikarakterisasi oleh XPS (Gambar S12 ) dan XRD (Gambar S13 ). Selain itu, XOF berbasis TPPA menunjukkan kemanjuran terapi yang lebih baik daripada berbasis TPPE , yang dapat dikaitkan dengan hidrofilisitas terkait yang lebih tinggi. Temuan ini menunjukkan potensi XOF(Br)-TPPA sebagai pilihan terapi yang layak untuk keratitis bakteri. Namun, penelitian lebih lanjut diperlukan untuk mengoptimalkan pengobatan, karena infeksi tidak sepenuhnya sembuh.
Efek terapeutik lebih ditingkatkan dengan memuat XOF(Br)-TPPA dengan fotosensitizer anionik (IR820) menggunakan interaksi elektrostatik dan hidrofobik yang menggabungkan kemoterapi dan terapi fototermal (Gambar 5a ). IR820@XOF(Br)-TPPA menunjukkan puncak serapan karakteristik pada 843 nm, bergeser ke merah relatif terhadap IR820 bebas (814 nm) dalam air (Gambar S14 ), yang menunjukkan keberhasilan pemuatan IR820 ke XOF(Br)-TPPA . IR820@XOF(Br)-TPPA menunjukkan ζ -potensial yang secara signifikan lebih rendah (1,97 ± 0,38 mV) jika dibandingkan dengan XOF(Br)-TPPA (41,9 ± 1,6 mV), seperti yang ditunjukkan pada Gambar 5b . Pengurangan dalam potensial ζ dapat dikaitkan dengan interaksi elektrostatik antara kationik XOF(Br)-TPPA dan anionik IR820. Komposisi unsur IR820@XOF(Br)-TPPA dievaluasi oleh XPS. Munculnya puncak intens yang sesuai dengan S 2s, S 2p, dan Cl 2p dalam spektrum IR820@XOF(Br)-TPPA mengonfirmasi keberhasilan pemuatan IR820 (Gambar 5c dan S15 ). Lebih jauh, pemetaan unsur EDS telah menetapkan distribusi seragam S dan Cl sebagai unsur karakteristik yang terkait dengan IR820 (Gambar 5d ).
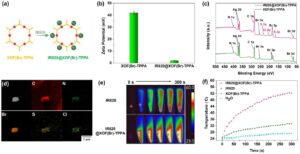
Kinerja fototermal IR820@XOF(Br)-TPPA dievaluasi dengan memantau variasi suhu larutan di bawah iradiasi cahaya 808 nm. Air murni, IR820 bebas, dan XOF(Br)-TPPA digunakan sebagai kontrol. Gambar termografik (Gambar 5e ) menunjukkan kinerja fototermal IR820@XOF(Br)-TPPA yang unggul dibandingkan dengan IR820 bebas. Suhu larutan IR820@XOF(Br)-TPPA meningkat dari 25,0°C menjadi 52,2°C dalam waktu 300 detik setelah iradiasi. Sebaliknya, suhu larutan air, XOF(Br)-TPPA , dan IR820 bebas masing-masing meningkat menjadi 27,5°C, 27,3°C, dan 33,3°C (Gambar 5f ). Hasil-hasil ini menunjukkan bahwa IR820@XOF(Br)-TPPA memberikan efisiensi konversi fototermal yang tinggi, yang dapat dimanfaatkan dalam terapi fototermal.
Untuk menyelidiki efek penambahan IR820 pada hasil pengobatan, durasi penyinaran cahaya dioptimalkan. Tikus diberikan larutan IR820@XOF(Br)-TPPA dan selanjutnya disinari dengan cahaya LED 808 nm selama durasi yang bervariasi: 5, 10, dan 20 menit. Temuan telah mengungkapkan bahwa dibandingkan dengan kelompok yang tidak diobati, yang menunjukkan ulkus kornea parah, neovaskularisasi, dan bahkan perforasi kornea setelah infeksi, tikus yang diobati dengan IR820@XOF(Br)-TPPA menunjukkan gejala yang berkurang secara signifikan. Kelompok yang disinari dengan cahaya LED selama 5 menit menunjukkan gejala paling ringan (Gambar S16 ). Analisis skor klinis menguatkan pengamatan ini. Setelah seminggu pengobatan, skor klinis untuk kelompok penyinaran cahaya LED 5 menit adalah 0,8 ± 0,5 (Gambar S17 ). Sebaliknya, kelompok yang tidak diobati menunjukkan skor klinis yang jauh lebih tinggi (10,3 ± 2,3). Skor klinis untuk kelompok penyinaran cahaya LED selama 10 menit (3,3 ± 0,6) dan 20 menit (1,7 ± 0,6) juga lebih rendah daripada kelompok yang tidak diobati. Skor kedalaman lesi dan neovaskularisasi kornea menunjukkan tren yang sama (Gambar S18 ). Hasil ini telah menetapkan penyinaran selama 5 menit sebagai pengobatan yang optimal.
Khasiat terapi IR820@XOF(Br)-TPPA selanjutnya dieksplorasi dengan perbandingan langsung dengan XOF(Br)-TPPA dan IR820. Tikus diobati dengan saline, XOF(Br)-TPPA dan IR820 (dengan paparan cahaya LED 808 nm selama 5 menit), atau IR820@XOF(Br)-TPPA (dengan paparan cahaya LED 808 nm selama 5 menit) setelah infeksi (Gambar 6a ). Kornea tikus yang diobati dengan IR820@XOF(Br)-TPPA kembali hampir transparan penuh pada Hari ke-2, mencapai penyembuhan yang hampir lengkap pada Hari ke-6, tanpa kekeruhan kornea yang terlihat, neovaskularisasi, atau pewarnaan natrium fluorescein. Pengobatan dengan XOF(Br)-TPPA memperbaiki kondisi kornea, tetapi kekeruhan kornea tetap ada, dan transparansi penuh tidak dipulihkan (Gambar 6b ). Penerapan IR820 sendiri pada dasarnya tidak menunjukkan efek pengobatan.
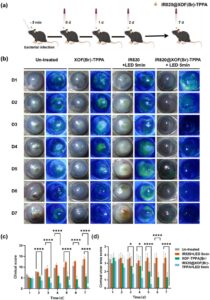
Setelah perawatan selama 1 minggu, skor klinis untuk kelompok IR820@XOF(Br)-TPPA adalah 0,8 ± 0,5, yang menunjukkan penyembuhan hampir lengkap, sedangkan skor klinis untuk XOF(Br)-TPPA , IR820 dan kelompok yang tidak diobati adalah 6,0 ± 1,4, 13,7 ± 1,2 dan 10,8 ± 2,6, masing-masing (Gambar 6c ). Skor area ulkus kornea menunjukkan tren yang sama, dengan skor 0,0 ± 0,0 ( IR820@XOF(Br)-TPPA ), 1,0 ± 0,0 ( XOF(Br)-TPPA ), 3,7 ± 0,6 (IR820), dan 3,0 ± 1,4 (kelompok yang tidak diobati), seperti yang ditunjukkan pada Gambar 6d yang konsisten dengan kedalaman lesi yang diamati dan neovaskularisasi kornea (Gambar S18 ). Skor kedalaman lesi untuk IR820@XOF(Br)-TPPA , XOF(Br)-TPPA , IR820, dan kelompok yang tidak diobati masing-masing adalah 0,8 ± 0,5, 2,3 ± 1,5, 4,0 ± 0,0 dan 3,5 ± 0,6. Skor neovaskularisasi kornea untuk IR820@XOF(Br)-TPPA , XOF(Br)-TPPA , IR820, dan kelompok yang tidak diobati masing-masing adalah 0,0 ± 0,0, 2,0 ± 0,0, 2,7 ± 0,6, dan 2,0 ± 1,2. Kelompok yang diobati dengan IR820@XOF(Br)-TPPA menunjukkan skor yang jauh lebih rendah di semua kategori jika dibandingkan dengan kelompok lain, termasuk pengobatan dengan XOF(Br)-TPPA . Temuan ini menunjukkan bahwa penambahan IR820 secara signifikan meningkatkan kemanjuran terapi XOF(Br)-TPPA , menjadikannya kandidat yang menjanjikan untuk pengobatan keratitis bakteri.
Setelah 7 hari perawatan, pewarnaan H&E dan pewarnaan CD31 dilakukan pada irisan kornea (Gambar S19 ). Pewarnaan H&E mengungkapkan bahwa perawatan IR820@XOF(Br)-TPPA secara signifikan mengurangi penebalan kornea dan infiltrasi sel inflamasi jika dibandingkan dengan kelompok yang tidak diobati. Kelompok iradiasi cahaya IR820@XOF(Br)-TPPA selama 5 menit menunjukkan pengurangan ketebalan kornea. Selain itu, pewarnaan CD31 menunjukkan penurunan neovaskularisasi yang signifikan pada kelompok yang diobati IR820@XOF(Br)-TPPA dibandingkan dengan kelompok yang tidak diobati (Gambar S20 ). Analisis histologis lebih lanjut mendukung kemanjuran terapeutik IR820@XOF(Br)-TPPA dalam menghambat peradangan dan neovaskularisasi kornea.
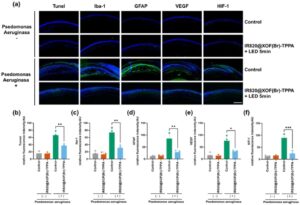
Bahasa Indonesia: Setelah invasi bakteri, keratitis pun terjadi, memperburuk peradangan kornea melalui sekresi berbagai faktor virulensi dan aktivasi reseptor pengenalan pola. Mitigasi respons peradangan kornea sangat penting untuk pengobatan keratitis yang efektif. Jaringan kornea dikumpulkan setelah satu hari pengobatan IR820@XOF(Br)-TPPA . Penggunaan pewarnaan TUNEL telah mengungkapkan penurunan yang signifikan dalam apoptosis sel epitel kornea. Penurunan ekspresi faktor inflamasi (GFAP dan IBA-1) menunjukkan bahwa IR820@XOF(Br)-TPPA dapat mengurangi apoptosis sel epitel kornea dengan mengurangi respons peradangan (Gambar 7a,d ). Selain peradangan, neovaskularisasi kornea juga berkontribusi terhadap gangguan penglihatan pada keratitis bakteri. Penurunan signifikan dalam ekspresi CD31 diamati pada kornea setelah tujuh hari pengobatan. Untuk mengeksplorasi mekanisme yang mendasarinya, ekspresi HIF-1, faktor kunci dalam neovaskularisasi, diperiksa. Penurunan substansial dalam ekspresi HIF-1 diamati pada kelompok yang diobati dibandingkan dengan kelompok yang tidak diobati (Gambar 7a,f ). Selain itu, penurunan ekspresi VEGF dicatat, yang menunjukkan bahwa pengobatan IR820@XOF(Br)-TPPA mengurangi ekspresi HIF-1, mencegah neovaskularisasi dengan transparansi kornea yang pada akhirnya membaik. Pengobatan IR820@XOF(Br)-TPPA secara signifikan mengurangi respons inflamasi dan mengurangi ekspresi faktor terkait neovaskularisasi pada kornea pascainfeksi, yang mengakibatkan penurunan apoptosis dan neovaskularisasi sel epitel kornea.
Biokompatibilitas IR820@XOF(Br)-TPPA untuk potensi translasi klinis dinilai dalam serangkaian uji toksisitas. Tikus kosong yang diobati dengan XOF(Br)-TPPA tidak menunjukkan efek buruk pada permukaan mata. Setelah 7 hari pengobatan, kornea tetap jernih, tanpa kemerahan konjungtiva, edema, peningkatan sekresi, atau pewarnaan natrium fluorescein (Gambar S21 ). Analisis histologis telah mengungkapkan struktur kornea normal tanpa bukti infiltrasi sel inflamasi. Pewarnaan TUNEL mengonfirmasi tidak adanya apoptosis yang signifikan (Gambar S22 dan S23 ). Lebih lanjut, tes fungsi hati dan ginjal (ALT, AST, BUN, dan CREA) tetap dalam batas normal selama periode pengobatan (Gambar S24 ). Tidak ada perubahan signifikan pada berat badan yang diamati (Gambar S25 ). Selain itu, pemeriksaan histologis organ-organ utama tidak menunjukkan tanda-tanda kerusakan jaringan (Gambar S26 ). Selain itu, kami menilai sitotoksisitas menggunakan uji CCK-8 (Gambar S27 ). Hasilnya menunjukkan bahwa XOF(Br)-TPPA dan IR820@XOF(Br)-TPPA tidak menyebabkan kematian sel setelah 24 jam pada konsentrasi obat di bawah 2,5 mg/mL. Namun, efek sitotoksik yang bergantung pada konsentrasi diamati, sebagaimana dibuktikan oleh sekitar 50% kematian sel ketika konsentrasi obat ditingkatkan menjadi 250 mg/mL (49,74 ± 11,84% untuk XOF(Br)-TPPA dan 39,87 ± 6,05% untuk IR820@XOF(Br)-TPPA ), yang menyiratkan bahwa XOF(Br)-TPPA dan IR820@XOF(Br)-TPPA dapat bersifat sitotoksik pada dosis tinggi. Temuan-temuan ini secara kolektif menetapkan biokompatibilitas IR820@XOF(Br)-TPPA , yang mendukung aplikasi yang layak.
3 Kesimpulan
Kesimpulannya, kami telah berhasil merancang dan membangun dua XOF 2D baru ( XOF(Br)-TPPE dan XOF(Br)-TPPA ) berdasarkan interaksi [N···Br + ···N]. XOF(Br) menunjukkan sifat antibakteri yang lebih unggul terhadap bakteri gram positif dan gram negatif daripada XOF(I) dengan sitotoksisitas rendah, karena sifat oksidasi yang lebih besar terkait dengan Br + . Sifat antibakteri XOF terkait erat dengan hidrofilisitas. XOF berbasis TPPA yang sangat hidrofilik memberikan respons antibakteri yang lebih unggul relatif terhadap XOF berbasis TPPE yang kurang hidrofilik . Lebih jauh lagi, penelitian ini telah berhasil mengintegrasikan kemoterapi dengan terapi fototermal (PTT) untuk mencapai efek antibakteri yang sinergis. Penggabungan IR820 sebagai fotosensitizer dengan XOF(Br)-TPPA meningkatkan kapasitas oksidatif Br + , yang secara signifikan meningkatkan kemanjuran terapeutik. Setelah pemuatan IR820 ke XOF(Br)-TPPA , biokompatibilitas yang sangat baik dan kinerja terapeutik fototermal dipertahankan. Pengembangan XOF (Br) yang diusulkan telah meningkatkan pemahaman kita tentang XOF, memperluas aplikasi potensial. Temuan penelitian ini telah menunjukkan pemanfaatan yang layak sebagai bahan antibakteri biomedis baru, yang memberikan peluang baru untuk mewujudkan agen antibakteri multifungsi yang sangat efektif.
4 Bagian Eksperimen
4.1 Persiapan XOF(Br)-TPPA
AgBF4 (29,0 mg, 0,15 mmol) dalam MeOH (1 mL) ditambahkan tetes demi tetes ke dalam larutan TPPA (47,6 mg, 0,1 mmol) dalam larutan MeOH (3 mL). Setelah larutan diaduk selama 1 jam pada suhu kamar, Br2 ( 23,6 mg, 0,15 mmol) dalam MeOH (68,2 µL) ditambahkan. Kemudian, larutan didegaskan di bawah pembekuan-pompa-pencairan selama tiga siklus, dan campuran diaduk selama 3 jam pada suhu 40°C. Kemudian, pelarut dihilangkan di bawah tekanan rendah tanpa pemanasan. Endapan dikeringkan di bawah vakum selama 5 jam.
4.2 Persiapan IR820@XOF(Br)-TPPA
XOF(Br)-TPPA (20,0 mg) ditambahkan ke dalam larutan IR820 (15,0 mg) dalam H 2 O (50 mL). Larutan campuran diaduk sepanjang malam. Kemudian, pelarut dikeluarkan dengan tekanan rendah tanpa pemanasan. Endapan dikeringkan dalam vakum selama 12 jam.
4.3 Aksi Antimikroba TPPE, TPPA, AgI, AgBr, dan XOF(I, Br)
E. coli dan S. aureus diperoleh dari Universitas Wuhan, Tiongkok; P. aeruginosa diperoleh dari Universitas Sains dan Teknologi Huazhong, Tiongkok, dan dikultur dengan media kultur Luria−Bertani (LB) (Sigma). Kaldu LB steril dan pelat agar LB disiapkan dalam air deionisasi sesuai dengan prosedur standar. Aktivitas antibakteri bahan dievaluasi secara kualitatif dengan metode difusi cakram agar yang dimodifikasi yang direkomendasikan oleh Institut Standar Klinis dan Laboratorium. Sekitar 106 CFU mL −1 diinokulasi pada pelat agar Sabouraud yang dimodifikasi. Bahan ditekan ke dalam cakram dengan diameter 1,3 cm dengan cetakan. Dan kemudian, cakram ditempatkan pada permukaan pelat agar yang telah disemai. Setelah 18 jam inkubasi pada 37°C, diameter zona penghambatan diukur, dan gambar optik pelat diambil.
4.4 Percobaan Hewan In Vivo
Semua percobaan hewan in vivo disetujui oleh Komite Etik Hewan Eksperimental dari Tongji Medical College, Huazhong University of Science and Technology. Tikus C57 (jantan, berusia 7–8 minggu) digunakan dalam percobaan ini. Semua hewan ditempatkan dengan siklus terang dan gelap standar (L:D = 12 jam:12 jam) pada suhu dan kelembapan yang sesuai. Makanan dan air segera diisi ulang dan tersedia secara bebas untuk tikus. Tikus biasanya dibius dengan 1% natrium pentobarbital secara intraperitoneal (40–50 mg/kg), dan setelah anestesi, seluruh epitel kornea tikus dikikis di bawah mikroskop. Kemudian luka kornea diinfeksi dengan suspensi P. aeruginosa (1,5 × 108 CFU/mL, 10 µL). Tikus diobati dengan XOF(I, Br)-TPPA , XOF(I, Br)-TPPE , IR820@XOF(Br)-TPPA , atau larutan garam 5 menit setelah infeksi. Tikus diobati setiap hari selama seluruh periode pengobatan, dan gambar mikroskopis permukaan mata masing-masing kelompok direkam, dan area defek epitel dievaluasi dengan pewarnaan fluorescein.