ABSTRAK
Infestasi sarang lebah madu oleh tungau ektoparasit, Varroa destructor , telah menjadi penyebab utama penurunan populasi. Mengobati infestasi tersebut penting untuk keberlanjutan. Pengetahuan tentang efek sub-mematikan dari akarisida yang umum digunakan pada kesehatan reproduksi drone, khususnya kualitas sperma, terbatas. Efek paparan akarisida (amitraz) in vitro dan in vivo dievaluasi menggunakan ukuran tubuh drone dan kualitas sperma lebah madu Cape ( Apis mellifera capensis ). Untuk studi in vitro, sampel semen terpapar pada tiga konsentrasi amitraz (125, 250, 500 μM). Studi in vivo memerlukan perawatan Apivar di dalam sarang sesuai dengan rekomendasi komersial. Drone dewasa dipanen setelah tiga minggu perawatan. Berat tubuh drone (ditentukan dalam studi in vivo saja) secara signifikan lebih tinggi pada drone yang terpapar amitraz. Tidak ditemukan korelasi antara berat drone, volume sperma atau konsentrasi. Dalam kedua penelitian tersebut, paparan amitraz memiliki efek yang tidak signifikan secara statistik pada motilitas dan struktur sperma, sementara vitalitas menurun secara signifikan pada kelompok yang terpapar amitraz 500 μM secara in vitro. Struktur sperma tetap tidak terpengaruh dalam kedua penelitian tersebut. Penelitian ini menyoroti tidak adanya efek sub-mematikan dari dosis tinggi amitraz pada fungsi sperma. Jika digunakan sesuai anjuran, paparan amitraz tidak memiliki efek merugikan pada kualitas sperma jantan.
1 Pendahuluan
Tungau ektoparasit, Varroa destructor , dikenal karena dampaknya yang menghancurkan pada koloni lebah madu (Rinderer et al. 2001 ; Semkiw et al. 2013 ). Oleh karena itu, pengelolaan (pengobatan) infestasi Varroa destructor merupakan praktik di banyak negara untuk mencegah hilangnya koloni (Semkiw et al. 2013 ; de Mattos et al. 2017 ; Dai et al. 2018 ). Meskipun efektif dalam pengelolaan Varroa destructor , banyak akarisida telah terbukti berdampak negatif pada lebah madu, termasuk keberhasilan reproduksinya (Rinderer et al. 2001 ; Burley 2007 ; Shoukry et al. 2013 ; Fisher and Rangel 2018 ), komponen penting dalam penggantian hilangnya koloni dan vitalitas populasi (Jaffé et al. 2010 ).
Dalam reproduksi lebah madu, lebah jantan memainkan peran penting dengan cara kawin dengan ratu perawan untuk memulai kawanan yang bereproduksi. Akan tetapi, lebah jantan sangat rentan terhadap efek akarisida selama perkembangan larva atau pupa (Johnson et al. 2013 ), yang menjadikan kualitasnya sebagai indikator utama kesehatan koloni (Retschnig et al. 2014 ). Perlakuan akarisida dapat memengaruhi potensi reproduksi lebah jantan dengan memengaruhi kelangsungan hidup, berat, dan kualitas sperma, termasuk berkurangnya jumlah dan viabilitas sperma (Rinderer et al. 2001 ; Burley 2007 ; Burley et al. 2008 ; Shoukry et al. 2013 ; Fisher and Rangel 2018 ). Namun, beberapa akarisida tidak menunjukkan efek pada kualitas sperma (Burley et al. 2008 ; Johnson et al. 2013 ; Shoukry et al. 2013 ; Chaimanee et al. 2019 ; McAfee et al. 2021 ). Variasi dalam temuan terkait dengan waktu paparan drone, metode dan dosis perawatan, dan tingkat infestasi Varroa destructor (Rinderer et al. 2001 ). Kualitas sperma terutama terpengaruh selama perkembangan drone (Shoukry et al. 2013 ; Fisher and Rangel 2018 ; Burley 2007 ), tetapi perawatan yang diterapkan pada drone dewasa atau ratu yang kawin tidak menunjukkan dampak apa pun (Johnson et al. 2013 ; Chaimanee et al. 2019 ). Metode aplikasi akarisida, seperti strip atau semprotan, memengaruhi kadar residu dalam madu dan lilin lebah (Abd El-Wahab et al. 2021 ), dengan kontaminasi lilin lebah yang berkepanjangan menyebabkan paparan kronis dan ancaman sub-mematikan bagi lebah madu (Dai et al. 2018 ; Sabová et al. 2022 ; Hernández-Rodríguez et al. 2022 ).
Kualitas sperma drone paling banyak terpengaruh selama tahap larva dan pupa, saat spermatogenesis dan spermiogenesis terjadi di testis, masing-masing (Lago et al. 2020 ). Meskipun perkembangan organ reproduksi drone dan migrasi sperma lebih lanjut terjadi selama beberapa hari pertama setelah kemunculannya (Johnson et al. 2013 ; Klein et al. 2021 ), proses ini tampaknya tidak memengaruhi kualitas sperma sedemikian rupa (Rinderer et al. 2001 ).
Amitraz, akarisida formamidine yang banyak digunakan, efektif terhadap Varroa destructor dan terdegradasi dengan cepat, meminimalkan akumulasi dalam lilin lebah dan madu ketika diaplikasikan pada dosis yang dianjurkan (Chaimanee et al. 2019 ; Abd El-Wahab et al. 2021 ; Chaimanee et al. 2022 ). Namun, metabolitnya yang larut dalam lemak, 2,4-dimetilfenil-metilformamidin (DPMF), dapat terakumulasi dalam lilin lebah, terutama pada dosis yang lebih tinggi dari yang dianjurkan (Mullin et al. 2010 ; Semkiw dan Skubida 2021 ; Weisbrod 2020 ). Paparan amitraz selama perkembangan telah dikaitkan dengan peningkatan kematian lebah, yang berdampak negatif pada reproduksi koloni (Toth et al. 2009 ). Penelitian tentang dampak amitraz pada kualitas sperma drone terbatas. Sepengetahuan kami, hanya dua penelitian yang menyelidiki efek amitraz pada perkembangan drone, yang mana salah satunya menunjukkan penurunan jumlah sperma (Shoukry et al. 2013 ), sementara yang lain menunjukkan penurunan viabilitas sperma (Fisher dan Rangel 2018 ). Penelitian tambahan yang mengekspos ratu yang sudah kawin (Chaimanee et al. 2019 ; McAfee et al. 2021 ) atau drone dewasa ke amitraz (Johnson et al. 2013 ) tidak menemukan efek pada viabilitas sperma.
Dalam hal keberhasilan reproduksi atau pembuahan, kualitas sperma mencakup lebih dari sekadar konsentrasi dan viabilitas sperma; kualitas sperma juga mengacu pada parameter fungsionalitas seperti motilitas, yang diperlukan sperma untuk bermigrasi ke spermatheca ratu setelah kopulasi dan untuk dapat mencapai dan menembus sel telur selama pembuahan (Yániz et al. 2020 ). Kualitas sperma juga mencakup karakteristik struktural sperma (misalnya, dimensi komponen sperma), yang pada gilirannya berhubungan dengan fungsionalitasnya (Fitzpatrick dan Lüpold 2014 ; Pearcy 2014 ). Namun, sejauh mana parameter ini dipengaruhi oleh paparan acaracides langsung atau tidak langsung (di dalam sarang) dan akut atau kronis sebagian besar masih belum diketahui.
Meskipun kebugaran dan kesuburan drone merupakan indikator penting kesehatan koloni, kualitas sperma drone juga dapat memberikan informasi tentang efek sub-mematikan yang mungkin ditimbulkan akarisida seperti amitraz terhadap kesehatan koloni. Oleh karena itu, tujuan dari penelitian ini adalah untuk menyelidiki efek amitraz terhadap kualitas sperma drone secara in vitro (paparan akut dengan respons dosis) dan secara in vivo (paparan kronis di dalam sarang) dengan menilai beberapa indikator kualitas sperma, yaitu parameter fungsional dan struktural.
2 Bahan dan Metode
2.1 Pernyataan Etika
Persetujuan etis diperoleh dari Komite Etika Penelitian Hewan di Universitas Western Cape, Afrika Selatan (Nomor Referensi Etika: AR 20/6/1).
2.2 Drone Lebah Madu dan Koleksi Sperma
2.2.1 Studi In Vitro
Pemanenan drone Apis mellifera ( Am .) capensis yang matang secara seksual (Couvillon et al. 2010 ) dilakukan selama musim panas (Oktober–Desember) tahun 2020. Sampel semen dari 51 drone yang matang secara seksual, yaitu, yang mampu ejakulasi lengkap setelah stimulasi manual, dikumpulkan dari sepuluh koloni yang dipilih secara acak di dua lokasi peternakan lebah terpisah yang terletak di lokasi kampus Vredenburg Agricultural Research Council (ARC) di wilayah Stellenbosch, Afrika Selatan. Koloni-koloni ini belum pernah diobati dengan akarisida apa pun (Gambar S1 ).
Untuk penelitian in vitro, drone dikumpulkan, dan semen diekstraksi di laboratorium lapangan ARC dalam jarak 100 m dari sarang.
2.2.2 Studi In Vivo
Lima belas drone dewasa secara seksual dikumpulkan dari koloni yang tidak diobati (kelompok kontrol), dan 15 drone dari koloni yang diobati dengan Apivar (kelompok eksperimen, diobati sesuai rekomendasi komersial) pada bulan Agustus 2021. Ukuran sampel yang relatif kecil digunakan karena kendala praktis dan biologis. Ketersediaan drone sebagian besar dipengaruhi oleh faktor musiman, yang secara signifikan membatasi jangka waktu untuk pengumpulan dan analisis semen. Meskipun ada keterbatasan ini, ukuran sampel cukup memadai untuk mendeteksi tren yang berarti dan memberikan wawasan awal tentang pertanyaan penelitian. Studi ini berfungsi sebagai landasan penting untuk penyelidikan di masa mendatang dengan ukuran sampel yang lebih besar untuk memvalidasi dan memperluas temuan ini. Koloni kontrol dan eksperimen terletak di dua lokasi peternakan lebah terpisah di daerah Stellenbosch. Lokasi peternakan lebah ini secara khusus ditempatkan terpisah sejauh dua kilometer untuk menghindari infestasi ulang koloni yang diobati dan untuk mencegah lebah berpindah-pindah di antara koloni, sehingga memaparkan akarisida ke koloni yang tidak diobati. Tidak ada peternak lebah lain di dekat lokasi peternakan lebah ini, karena lahan pertanian tersebut mencakup 880 ha, dan kedua lokasi peternakan lebah ini terletak di tengah lahan pertanian. Meskipun petani memelihara beberapa sarang lebah lain di tempat tersebut, tidak satu pun dari sarang tersebut berada dalam radius dua kilometer. Vegetasi di semua lokasi peternakan lebah sebagian besar terdiri dari fynbos dan konsisten di semua lokasi. Semua koloni yang digunakan dalam penelitian ini dipelihara sesuai dengan praktik pemeliharaan lebah standar (Swart 2001 ).
2.3 Ekstraksi dan Transportasi Semen untuk Kedua Penelitian
Dalam kasus penelitian in vivo, drone hidup yang dikumpulkan dari kedua lokasi diangkut terlebih dahulu ke laboratorium lapangan ARC di dekatnya di Stellenbosch untuk pengumpulan semen dalam waktu 10–15 menit setelah pengumpulan.
Di laboratorium lapangan ARC (Stellenbosch) semen diperoleh setelah ejakulasi manual, dikumpulkan dari ujung endophallus drone dan ditempatkan ke dalam tabung mikro-Eppendorf yang berisi larutan buffer Kiev (Collins 2005 ).
Semua sampel yang dikumpulkan untuk analisis semen lebih lanjut diinkubasi pada suhu 37°C dan diangkut ke laboratorium institusi dalam waktu 30 menit setelah ekstraksi semen. Setelah tiba, analisis laboratorium dilakukan segera dan selalu dalam waktu 1 jam setelah pengumpulan semen (Yániz et al. 2019 ).
2.4 Paparan Sperma terhadap Amitraz
2.4.1 Studi In Vitro
Meskipun volume semen sampel tidak diukur untuk penelitian ini, diketahui dari hasil sebelumnya bahwa lebah madu Cape drone menghasilkan volume semen < 1 μL (Murray 2021 ). Oleh karena itu, untuk mencegah pengenceran berlebih dari penambahan amitraz dan pewarnaan fluoresensi berikutnya, diputuskan untuk menggunakan 3 μL larutan Kiev untuk pengenceran setiap sampel semen (Murray 2021 ). Untuk menilai efek amitraz secara in vitro pada kesuburan lebah madu drone dan fungsi sperma, sampel semen terpapar pada tiga konsentrasi amitraz yang berbeda (125, 250, 500 μM). Konsentrasi amitraz dipilih berdasarkan percobaan sebelumnya dengan konsentrasi akhir yang berbeda mulai dari 125 hingga 1000 μM, di mana motilitas tinggi diamati pada 125 μM dan motilitas terendah pada 500 μM (tidak ada motilitas yang diamati pada 1000 μM). Setiap sampel air mani dibagi rata menjadi dua bagian dan secara acak dimasukkan ke dalam kelompok kontrol atau kelompok yang terpapar amitraz. Dosis amitraz kemudian diberikan secara acak ke sampel kelompok yang terpapar untuk menghindari prasangka.
Larutan kerja amitraz dari tiga dosis berbeda dibuat dengan mengencerkan larutan stok amitraz 0,25 M (0,07335 g bubuk amitraz yang dilarutkan dalam 1000 μL DMSO) (Sigma-Aldrich, Merck, Afrika Selatan) dalam berbagai volume larutan buffer Kiev. Satu mikro liter larutan stok amitraz diencerkan dalam 1000 μL Kiev untuk memperoleh konsentrasi amitraz 250 μM, diencerkan dalam 500 μL untuk memperoleh konsentrasi amitraz 250 μM, dan diencerkan dalam 250 μL untuk memperoleh konsentrasi amitraz 1000 μM. Pengenceran lebih lanjut dengan sampel dalam rasio 1:1 menghasilkan konsentrasi amitraz akhir sebesar 125, 250, dan 500 μM.
2.4.2 Studi In Vivo
Untuk percobaan ini, koloni diperlakukan dengan strip Apivar (Véto-pharma, Prancis) (dua strip per koloni (sarang)) selama enam minggu sesuai petunjuk kemasan. Amitraz adalah bahan aktif Apivar, dan konsentrasi amitraz di setiap koloni dengan dua strip (satu strip mengandung 3,33%/11.349 μMol amitraz) (Chaimanee et al. 2022 ) adalah 6,66%/22.699 μMol. Untuk menilai efek paparan akarisida terutama pada drone dewasa, pengobatan dimulai seminggu sebelum kemunculan (7 hari terakhir tahap pupa), dan drone kemudian dipanen tiga minggu setelah dimulainya pengobatan, yang memungkinkan drone yang baru muncul mencapai kematangan seksual pada usia sekitar dua minggu (12–14 hari), saat terpapar Apivar. Sampel semen diencerkan dalam 10 μL larutan buffer Kiev untuk memungkinkan analisis beberapa karakteristik sperma sambil mempertahankan tingkat pengenceran yang sesuai.
2.5 Analisis Karakteristik Dasar Drone dan Semen untuk Penelitian In Vivo
Karakteristik sperma drone dan sperma dasar hanya ditentukan dalam studi in vivo. Sebanyak 30 sampel sperma drone yang sudah matang secara seksual (berusia sekitar dua minggu) dianalisis dalam studi in vivo.
Untuk mengukur ukuran tubuh drone ini, berat tubuh ditentukan dengan menimbang drone setelah ejakulasi manual dengan menggunakan timbangan analitik Nimbus VR (Adam Equipment SA (Pty) Ltd., Kempton Park, Johannesburg, Afrika Selatan).
Karakteristik dasar semen yang ditentukan meliputi volume semen dan konsentrasi sperma. Volume semen dari masing-masing sampel ditentukan dengan menimbang tabung Micro-Eppendorf sebelum dan setelah semen ditambahkan (Organisasi Kesehatan Dunia 2010 ). Konsentrasi sperma lebah madu ditentukan menggunakan metode analisis motilitas Murray et al. ( 2022 ) dan modul motilitas perangkat lunak Sperm Class Analyzer (SCA) (Versi 6.5.0.44, Microptic SL, Barcelona, Spanyol). Kamar ukur Makler digital, yang diperoleh dari pengaturan kotak peralatan di SCA, dicetak pada sampel yang dianalisis dan kemudian digunakan untuk menghitung jumlah sperma yang ada secara manual. Persamaan yang digunakan untuk menghitung konsentrasi sperma akhir (juta sperma/μL) dalam sampel semen ditunjukkan dalam persamaan di bawah ini.
![]()
2.6 Analisis Fungsi Sperma pada Penelitian In Vitro dan In Vivo
2.6.1 Motilitas Sperma dan Analisis Parameter Kinematika
Untuk menganalisis motilitas sperma lebah madu dan parameter kinematik yang menggambarkan pergerakan sperma, teknik pewarnaan dan mikroskopi fluoresensi Murray et al. ( 2022 ) digunakan. Singkatnya, sampel semen lebah madu diwarnai menggunakan pewarna fluoresensi SYBR14 (L-7011, LTC Tech, Fairland, Afrika Selatan), dilihat pada slide yang ditutupi penutup kaca menggunakan mikroskopi fluoresensi pada perbesaran 28x, dan dianalisis dengan analisis sperma berbantuan komputer (CASA) dan modul motilitas di SCA. Parameter motilitas sperma yang dianalisis meliputi persentase motilitas total, progresivitas, dan parameter kinematik yang mengukur kecepatan dan lintasan (VCL, kecepatan lengkung; VSL, kecepatan garis lurus; VAP, kecepatan lintasan rata-rata), direksionalitas (STR, kelurusan; LIN, linearitas), progresivitas (WOB, goyangan) dan dinamika gerakan ekor (BCF, frekuensi persilangan ketukan; ALH, amplitudo perpindahan kepala lateral; DNC, tarian).
2.6.2 Analisis Vitalitas Sperma
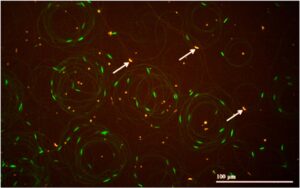
Untuk studi in vitro, vitalitas sampel semen dalam kelompok kontrol dan kelompok perlakuan ditentukan pada sampel semen terpisah karena volume sampel yang digunakan kecil. Sebanyak 51 sampel semen dianalisis dalam studi in vitro. Dalam kasus studi in vivo, vitalitas ditentukan pada sampel yang sama yang digunakan untuk analisis motilitas. Vitalitas sperma ditentukan menggunakan kit pewarnaan mati/hidup (SYBR14 dan propidium iodida) (L-7011, LTC Tech, Fairland, Afrika Selatan). Sampel pertama-tama diwarnai selama 10 menit pada suhu 37°C menggunakan SYBR14, diikuti oleh periode inkubasi tambahan selama 5 menit dengan pewarna tandingan, propidium iodida (PI). Sel sperma yang hidup diwarnai hijau (SYBR14), sementara PI menembus membran sperma yang mati, mewarnai sel yang tidak hidup menjadi merah (Gambar 1 ).
2.7 Analisis Struktur Sperma untuk Penelitian In Vitro dan In Vivo
Pewarna nigrosin-eosin, yaitu BrightVit (Delfran, Johannesburg, Afrika Selatan), digunakan untuk menilai struktur sperma lebah madu. Pengujian ini umumnya digunakan untuk vitalitas; namun, pada sperma lebah madu, pengujian ini membedakan antara komponen sperma yang berbeda, yaitu kepala dan ekor. Eosin menembus membran sel sperma yang rusak, sehingga sel menjadi berwarna merah muda sementara sperma yang hidup dan layak tetap berwarna putih (Gambar 2 ). Nigrosin memberikan kontras yang jelas antara sel sperma dan latar belakangnya dengan mewarnai area di sekitarnya menjadi ungu.
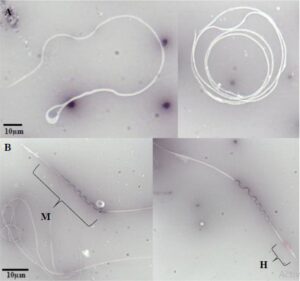
Untuk studi in vitro dan in vivo, 50 sel sperma per sampel air mani dinilai. Sampel air mani yang diperoleh untuk analisis struktural dalam studi in vivo dibatasi hingga enam ekor ayam karena sebagian besar air mani ayam mengering sebelum pewarnaan dapat dilakukan.
2.8 Analisis Statistik
Perangkat lunak MedCalc (Versi 19.5.3, Mariakerke, Belgia) digunakan untuk analisis statistik data. Untuk membandingkan data yang diperoleh dari kelompok kontrol dengan konsentrasi amitraz yang berbeda dalam studi in vitro, uji ANOVA satu arah dilakukan pada data yang terdistribusi normal, dan uji Kruskal–Wallis digunakan untuk data nonparametrik. Normalitas ditentukan menggunakan uji Levene ( p > 0,05). Untuk perbandingan sampel drone yang diobati dengan Apivar versus yang tidak diobati dalam studi in vivo, uji- t independen untuk data parametrik atau uji- U Mann–Whitney untuk data nonparametrik digunakan. Nilai p yang lebih kecil dari 0,05 ( p < 0,05) dianggap signifikan secara statistik. Korelasi antara variabel dilakukan dengan menggunakan uji korelasi parsial Pearson. Blok menyajikan nilai r dan warna menunjukkan kekuatan korelasi; misalnya, warna biru yang lebih gelap menunjukkan hubungan negatif yang lebih kuat ( r lebih dekat ke -1), sedangkan warna merah yang semakin intens menunjukkan hubungan positif yang kuat ( r lebih dekat ke +1). Perbedaan dan korelasi yang halus antara kelompok kontrol dan kelompok yang diberi perlakuan pada kedua penelitian tersebut diilustrasikan lebih lanjut dengan menggunakan glif bintang dan plot sinar matahari. Ini adalah grafik multivariat yang dibuat menggunakan perangkat lunak Statgraphics Centurion (Versi 19, The Plains, Virginia) untuk mengilustrasikan persamaan dan perbedaan antara variabel dengan beberapa dimensi. Glif bintang adalah representasi visual di mana setiap variabel ditetapkan ke sumbu yang memancar dari titik pusat. Panjang setiap sumbu sesuai dengan nilai variabel. Bentuk bintang akhirnya dibuat saat menghubungkan semua titik akhir variabel ini. Variasi lain dari glif bintang adalah plot sinar matahari, yang juga menyajikan variabel pada sumbu yang berasal dari titik pusat. Namun, segmen garis, warna, dan bayangan digunakan untuk membuat pengaturan sudut yang ditingkatkan. Kedua plot tersebut secara khusus digunakan untuk mengidentifikasi variabel dominan dan outlier. Glif kunci digunakan sebagai legenda untuk menginterpretasikan grafik multivariat seperti glif bintang dan plot sinar matahari, yang memberikan penjelasan yang jelas tentang bagaimana elemen dalam grafik (yaitu, garis, bentuk, dan warna) berhubungan dengan variabel atau nilai tertentu. Khususnya dalam glif bintang dan plot sinar matahari, glif kunci menunjukkan rentang nilai di sepanjang sumbu, sumbu mana yang berhubungan dengan variabel mana, dan terakhir, menjelaskan arti warna, garis, bentuk, atau bayangan yang digunakan Statgraphics StatPoint, Statgraphics (StartPoint Technologies Inc. 2013 ).
3 Hasil
3.1 Karakteristik Dasar Drone dan Semen
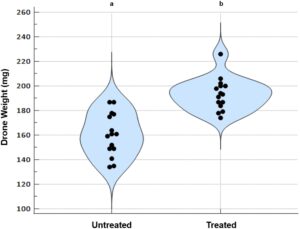
Untuk studi in vivo, berat rata-rata drone yang tidak diobati (161 ± 17,5 mg) secara signifikan lebih rendah ( p < 0,001) dibandingkan dengan drone yang terpapar Apivar (193 ± 13,1 mg), seperti yang diilustrasikan pada Gambar 3 .
3.2 Parameter Motilitas Sperma pada Penelitian In Vitro dan In Vivo
3.2.1 Motilitas dan Parameter Kinematika
Dalam kedua studi in vitro dan in vivo, tidak ada perbedaan signifikan yang diamati antara motilitas dan parameter kinematik dari kelompok yang tidak diobati dan diobati. Sebaliknya, studi in vitro menunjukkan bahwa konsentrasi amitraz akhir terendah 125 μM meningkatkan motilitas sperma dan parameter kecepatan kinematik jika dibandingkan dengan kelompok yang tidak diobati (kontrol), seperti yang diilustrasikan dalam Gambar 4a . Glif bintang dan plot sinar matahari pada Gambar 4a membedakan kasus-kasus yang memiliki nilai serupa dari enam variabel input yang digunakan, yaitu, motilitas total (TM) (kontrol = 71,9 ± 26,9%; 125 μM = 75,0 ± 19,8%) ( p = 0,11); progresivitas total (TP) (kontrol = 35,9 ± 27,5%, 125 μM = 45,7 ± 27,9%) ( p = 0,16); persentase sperma perenang cepat (cepat%) (kontrol = 23,4 ± 25,3%, 125 μM = 31,0 ± 28,3%) ( p = 0,28) serta parameter kecepatan kinematik termasuk kecepatan lengkung (VCL) (kontrol = 63,4 ± 21,9 μm/s; 125 μM = 68,1 ± 19,2 μm/s) ( p = 0,26); kecepatan garis lurus (VSL) (kontrol = 37,3 ± 12,9 μm/s; 125 μM = 41,4 ± 10,0 μm/s) ( p = 0,26) dan kecepatan lintasan rata-rata (VAP) (kontrol = 49,9 ± 17,9 μm/s; 125 μM = 55,3 ± 15,7 μm/s) ( p = 0,24). Lebih jauh dicatat bahwa, meskipun tidak signifikan, ketika konsentrasi amitraz meningkat (yaitu, dari 250 menjadi 500 μM) motilitas dan parameter kinematik secara bertahap menurun (Tabel S1 . Pengaruh perlakuan amitraz in vitro dan in vivo pada motilitas sperma lebah madu Cape dan parameter kinematik [rata-rata ± SD]).

3.3 Vitalitas Sperma pada Penelitian In Vitro dan In Vivo
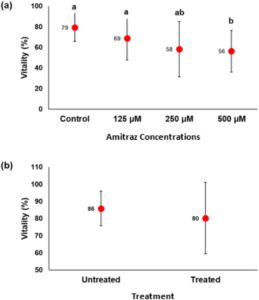
Dalam studi in vitro persentase vitalitas rata-rata secara signifikan lebih tinggi ( p = 0,01) pada kelompok yang tidak diobati (kontrol) (79,4% ± 13,7%) dibandingkan dengan kelompok yang terpapar amitraz (125 μM = 68,8 ± 21,2; 250 μM = 58,3 ± 26,7; 500 μM = 56,3% ± 20,4%). Persentase vitalitas tidak berbeda secara signifikan di antara dosis tetapi menurun saat dosis meningkat (Gambar 5a ). Dalam studi in vivo, persentase vitalitas pada kelompok yang diobati (80,2% ± 20,8%) lebih rendah dibandingkan dengan kelompok yang tidak diobati (kontrol) (85,9% ± 10,1%), meskipun tidak signifikan ( p = 0,62). Namun, vitalitas tinggi di kedua kelompok, yaitu di atas 80% (Gambar 5b ).
Amitraz tidak memiliki efek signifikan pada komponen struktur sperma, yaitu kepala, ekor dan panjang sperma total, dalam studi in vitro. Namun, dalam studi in vivo, drone kontrol memiliki panjang kepala lebih panjang dibandingkan dengan drone yang terpapar pengobatan ( p = 0,059) (Tabel S2 . Efek pengobatan amitraz in vitro dan in vivo pada struktur sperma lebah madu Cape [rata-rata ± SD]). Meskipun hampir signifikan, perbedaan ini hanya 2%. Namun, ini tidak dapat secara meyakinkan dikaitkan dengan paparan akarisida, karena mungkin terjadi akibat variasi genetik di antara koloni. Sayangnya, kami belum memperhitungkan atau menguji potensi perbedaan koloni.
4 Diskusi
Dua studi dalam investigasi ini memberikan wawasan tambahan tentang kemungkinan efek sub-mematikan yang mungkin dimiliki akarisida, amitraz, terhadap ukuran dan kualitas sperma drone. Drone telah dideskripsikan sebagai jenis kelamin yang rapuh dalam koloni, karakteristik umum dalam sistem haploid (berasal dari telur yang tidak dibuahi), sehingga mengandung lokus detoksifikasi hemizigot dibandingkan dengan pekerja diploid, yang mengakibatkan berkurangnya resistensi terhadap stresor lingkungan seperti paparan pestisida (Friedli et al. 2020 ; McAfee et al. 2022 ). Selain itu, total kapasitas antioksidan plasma mani drone juga telah terbukti lebih rendah dibandingkan dengan hemolimfa lebah pekerja setelah paparan imidakloprid selama perkembangan (Słowińska et al. 2019 ), yang juga menyoroti kerentanan drone terhadap efek pestisida. Drone dari koloni yang menerima perlakuan amitraz in vivo dalam studi ini memiliki berat lebih dari 19,8% lebih banyak daripada drone dari koloni yang tidak menerima perlakuan tersebut. Penting untuk dicatat bahwa tingkat infestasi Varroa destructor di koloni telah terbukti mempengaruhi ukuran drone. Misalnya, di Am carnica , drone dewasa yang tidak terinfeksi beratnya sekitar 24% lebih banyak daripada drone dewasa yang terinfestasi sedang (Duay et al. 2003 ). Infestasi Varroa destructor juga telah terbukti mengurangi berat drone lebah madu Carniolan sekitar 33%–80% dengan peningkatan tingkat infestasi, serta pengurangan ukuran organ reproduksi (Omar 2017 ). Lebih jauh lagi, meskipun pada tingkat yang lebih rendah, infestasi Varroa destructor di subspesies lebah madu Afrika Selatan, Am . scutellata , telah mengakibatkan penurunan berat drone, dengan berat drone berkurang rata-rata 2,8 mg untuk setiap tungau Varroa destructor tambahan (Strauss et al. 2015 ). Kami mengamati peningkatan berat badan drone di koloni yang terpapar amitraz dibandingkan dengan yang berasal dari kelompok kontrol yang tidak diobati. Hal ini berpotensi dikaitkan dengan tingkat infestasi Varroa destructor yang lebih rendah , dengan asumsi bahwa pengobatan mengurangi infestasi pada koloni yang terpapar dibandingkan dengan kontrol. Parasitisme yang berkurang selama perkembangan drone memungkinkan alokasi sumber daya yang lebih baik untuk pertumbuhan, yang pada akhirnya menghasilkan bobot tubuh yang lebih tinggi (Erban et al. 2019 ). Hipotesis ini menjamin penyelidikan lebih lanjut untuk mengonfirmasi efek tingkat infestasi Varroa destructor pada berat tubuh drone. Namun, tingkat infestasi tidak dinilai dalam penelitian ini, yang membatasi kemampuan kami untuk mengevaluasi dampak parasitisme Varroa destructor pada perkembangan drone.
Volume semen lebah madu dan konsentrasi sperma sangat bervariasi di antara subspesies, dan variasi telah dikaitkan dengan ukuran drone (ditentukan oleh panjang sayap) dan usia (Schlüns et al. 2003 ; Czekońska et al. 2013 ). Schlüns et al. ( 2003 ) melaporkan bahwa drone yang lebih besar dikaitkan dengan konsentrasi sperma yang lebih tinggi. Czekońska et al. ( 2013 ) lebih lanjut melaporkan bahwa volume semen menurun seiring bertambahnya usia drone. Diketahui bahwa drone lebah madu Afrika memiliki ukuran tubuh yang lebih kecil dibandingkan dengan spesies Eropa (Buys 1990 ). Namun, meskipun terjadi pengurangan berat badan yang diamati pada drone dari koloni yang terpapar pengobatan amitraz, baik ukuran drone yang lebih kecil maupun paparan amitraz tidak memengaruhi volume semen atau konsentrasi sperma secara signifikan. Hasil yang diperoleh dalam penelitian ini sesuai dengan volume semen dan konsentrasi sperma yang dilaporkan sebelumnya untuk Am . capensis drones, yaitu 0,5–0,7 μL dan 1,10 × 10 6 –16,5 × 10 6 mill/μL, masing-masing (Murray et al. 2022 ).
Berbeda dengan hasil kami, Shoukry et al. ( 2013 ) menemukan bahwa drone yang diobati dengan amitraz memiliki berat badan yang signifikan lebih rendah (kelompok kontrol = 211 mg vs. kelompok yang diobati dengan amitraz = 186 mg) dan jumlah sperma per vesikula seminalis (kelompok kontrol = 5,39 ± 1,37 × 106 vs. kelompok yang diobati dengan amitraz = 3,55 ± 1,13 × 106 ) . Mereka juga melaporkan bahwa jumlah sperma dan berat badan drone berkorelasi positif. Dalam penelitian ini, tidak ditemukan hubungan antara konsentrasi sperma, volume semen, dan berat badan drone. Perlu dicatat bahwa cara pengobatan mungkin berkontribusi terhadap variasi hasil. Dalam penyelidikan mereka, Shoukry et al. ( 2013 ) menggunakan bola kapas untuk memaparkan lebah madu pada amitraz; dalam pekerjaan kami, mitisida secara progresif dimasukkan ke dalam sarang melalui strip pengobatan.
Studi-studi ini menyediakan, untuk pertama kalinya, hasil tentang efek pengobatan tungau Varroa destructor , amitraz, (diberikan secara in vitro dan in vivo), pada motilitas sperma drone dan kinematika. Hasil telah menunjukkan bahwa paparan amitraz tidak secara signifikan mempengaruhi motilitas sperma drone lebah madu dan kinematika. Persentase TM dari sampel sperma dalam percobaan in vivo dan in vitro serupa dengan TM yang ditemukan dalam studi dasar sebelumnya pada Am capensis oleh Murray et al. ( 2022 ) (TM = 85,5%), serta studi oleh Inouri-Iskounen et al. ( 2020 ) pada subspesies Afrika, Am intermissa , (TM = 80%). Pada awalnya, ketika dosis rendah (125 μM) amitraz diberikan secara in vitro, nilai parameter motilitas dan kinematik tampak membaik, menghasilkan nilai yang sedikit meningkat tetapi tidak signifikan. Pengamatan serupa terlihat pada TM kelompok kontrol versus kelompok yang diberi perlakuan dalam percobaan in vivo.
Persentase vitalitas sperma adalah satu-satunya parameter yang terpengaruh secara signifikan ketika peningkatan dosis amitraz diberikan secara in vitro, yang sesuai dengan penelitian oleh Fisher dan Rangel ( 2018 ), yang menunjukkan bahwa lebah madu jantan yang dipelihara dalam sarang dengan lilin lebah yang terkontaminasi amitraz menunjukkan persentase vitalitas sperma yang secara signifikan lebih rendah (kelompok kontrol = 99,2% vs. kelompok yang diobati dengan amitraz = 80,1%). Johnson dkk. ( 2013 ) tidak mendeteksi adanya efek amitraz pada vitalitas sperma. Namun, perlu dicatat bahwa pengobatan diberikan kepada lebah jantan dewasa berusia dua hingga empat hari, sedangkan dalam penelitian in vivo kami, amitraz diberikan kepada lebah jantan yang sedang berkembang sebelum selesainya spermatogenesis selama tahap kepompong akhir. Lebih jauh lagi, persentase vitalitas yang secara signifikan lebih rendah yang diamati dalam penelitian in vitro kami dapat menjadi hasil dari dosis amitraz yang luar biasa tinggi yang digunakan.
Struktur sperma, sesuai dengan fungsinya, merupakan indikator penting kualitas sperma dan potensi kesuburan (Maree 2011 ). Dalam kedua percobaan, mayoritas komponen sperma tidak terpengaruh, kecuali perbedaan kecil yang diamati antara panjang kepala kelompok dalam studi in vivo. Fakta bahwa variasi panjang kepala sperma tidak memiliki efek nyata pada fungsionalitas sperma dapat menunjukkan bahwa perbedaan kecil tersebut mungkin tidak mengganggu fungsionalitas sperma. Namun, diperlukan studi yang lebih substansial untuk mengonfirmasi hubungan tersebut.
Bahasa Indonesia: Meskipun ada laporan tentang resistensi amitraz, persentase efikasi pengobatan tungau Varroa destructor dengan Apivar tetap tinggi. Rinkevich ( 2020 ) melaporkan penurunan 3% dalam jumlah Varroa destructor setelah periode pemberian tiga jam ketika diobati di laboratorium dengan Apivar. Selain itu, bahkan ketika diberikan di sarang, pengobatan dengan amitraz tetap sangat efektif, berkisar antara > 70% dan > 97%. Temuan ini sesuai dengan temuan Al Naggar et al. ( 2016 ), dengan koloni lebah madu Kanada yang diobati memiliki 1,5 versus 6,3 tungau Varroa destructor per 100 lebah jika dibandingkan dengan koloni kontrol. Rinkevich ( 2020 ) lebih lanjut mengaitkan resistensi amitraz dengan frekuensi pengobatan, dosis yang diberikan, dan periode pengobatan. Oleh karena itu kami berasumsi bahwa karena kami telah memberikan Apivar sesuai resep, dan karena pengobatan pada gatal-gatal ini diberikan untuk pertama kalinya, populasi Varroa destructor tidak berhasil mengembangkan bentuk resistensi apa pun.
Oleh karena itu, meskipun infestasi Varroa destructor tidak ditentukan dalam penelitian ini, kami menduga bahwa jumlah Varroa destructor dalam koloni yang diobati mungkin lebih sedikit secara signifikan setelah 22 hari pengobatan dibandingkan dengan koloni kontrol, yang menyebabkan lebih sedikit parasitisme dan berpotensi mengakibatkan bobot drone yang lebih tinggi yang terpapar pengobatan. Paparan amitraz secara in vitro dan in vivo dalam penelitian ini bersifat akut, dan oleh karena itu temuan di atas tidak menggambarkan kemungkinan efek paparan kronis.
5 Kesimpulan
Meskipun penelitian ini membuktikan bahwa paparan amitraz tidak memiliki dampak signifikan pada struktur dan motilitas sperma, dosis amitraz yang sangat tinggi berdampak buruk pada vitalitas. Vitalitas dalam sperma lebah madu merupakan parameter fungsional penting dan indikator potensi kesuburan dan keberhasilan reproduksi mengingat sperma disimpan selama beberapa tahun dalam spermatheca ratu sebelum digunakan untuk pembuahan sel telur. Vitalitas sperma penting untuk memastikan keberhasilan pembuahan yang berkelanjutan, terutama setelah penyimpanan yang lama dalam spermatheca, yang dapat diperpanjang hingga beberapa tahun (Baer et al. 2009 ; Tarpy dan Olivarez 2014 ). Namun, penelitian lebih lanjut diperlukan untuk menentukan apakah vitalitas sperma yang berkurang dalam penelitian ini hanya disebabkan oleh paparan akut dan langsung terhadap dosis amitraz yang sangat tinggi. Penelitian di masa mendatang juga diperlukan untuk menentukan efek pengobatan amitraz kronis di dalam sarang, seperti yang umumnya diberikan oleh peternak lebah saat mengobati infestasi tungau Varroa destructor .
Spermatogenesis terutama terjadi selama tahap larva, sementara spermiogenesis meluas melampaui fase pupa dan berakhir pada fase pharate-dewasa (Lago et al. 2020 ; Klein et al. 2021 ). Memahami dampak pengobatan selama fase perkembangan ini, termasuk tahap larva dan pupa, akan memberikan wawasan berharga tentang kemampuan reproduksi drone saat mereka mencapai kedewasaan. Dalam penelitian ini, pengobatan dimulai selama tujuh hari terakhir tahap pupa; oleh karena itu, ada kemungkinan bahwa paparan amitraz mungkin secara langsung memengaruhi perkembangan drone. Selain itu, dampak pengobatan pada lebah pekerja harus diperhitungkan, karena paparan dapat mengganggu perawatan induk drone dan kemampuan termoregulasi mereka di koloni, secara tidak langsung menghambat perkembangan drone. Jalur tidak langsung yang potensial ini layak diselidiki lebih lanjut untuk sepenuhnya memahami efek amitraz yang lebih luas pada dinamika koloni dan perkembangan drone.
Paparan Amitraz pada lebah jantan dewasa kurang merugikan dibandingkan ketika perawatan diberikan selama fase perkembangan (Fisher dan Rangel 2018 ). Produksi lebah jantan dalam koloni lebah madu terjadi dalam jangka waktu yang panjang dan dengan demikian dapat tumpang tindih dengan waktu ketika peternak lebah menerapkan perawatan, terutama karena perawatan biasanya dihindari selama produksi madu tetapi tidak harus selama periode pemeliharaan lebah jantan. Oleh karena itu, lebah jantan yang sedang berkembang dapat terpapar pada perawatan, yang berpotensi memengaruhi perkembangan mereka dan dinamika reproduksi koloni. Temuan ini menggarisbawahi dampak kritis dari stresor lingkungan pada kesuburan lebah madu, memberikan penjelasan mekanistik yang potensial untuk tantangan yang dihadapi oleh populasi lebah madu secara global. Penurunan kualitas ratu dan masalah terkait, seperti penggantian ratu yang sering dan kematian ratu prematur telah dilaporkan oleh peternak lebah di Amerika Serikat (Chapman et al. 2024 ). Paparan terhadap polutan lingkungan, patogen, dan stresor lainnya selama perkembangan ratu atau lebah jantan dapat mengganggu kesehatan reproduksi, mengurangi kebugaran dan produktivitas koloni. Mengatasi pemicu stres ini penting untuk mendukung populasi lebah madu, yang sangat penting untuk penyerbukan dan keberlanjutan ekosistem.
Temuan penelitian ini tidak memperhitungkan perbedaan kerentanan di tingkat koloni, meskipun telah disorot dalam literatur sebagai faktor penting dalam memahami respons terhadap stres xenobiotik. Oleh karena itu, penelitian mendatang sebaiknya menyertakan faktor tingkat koloni dalam desain eksperimen untuk menilai efek variabilitas genetik dalam populasi yang sama, serta di antara koloni yang berbeda. Meskipun ada keterbatasan ini, temuan ini tetap berharga, memberikan rekomendasi yang mendalam bagi peternak lebah, yang selanjutnya menawarkan panduan berbasis bukti tentang pemberian perawatan di dalam sarang yang aman dan efektif. Hasilnya menekankan pentingnya pengaturan waktu perawatan yang cermat untuk meminimalkan potensi dampak negatif pada perkembangan drone dan kesehatan reproduksi. Dengan mengoptimalkan jadwal perawatan, peternak lebah dapat mengelola kesehatan koloni dengan lebih baik sambil memastikan keberlanjutan dan produktivitas sarang mereka dalam jangka panjang. Akhirnya, kami menyimpulkan bahwa di Afrika, tidak disarankan untuk melakukan perawatan terhadap Varroa destructor mengingat ketahanan subspesies terhadap serangan tersebut. Namun, berdasarkan literatur saat ini, disarankan untuk melakukan perawatan terhadap spesies dari belahan dunia lain. Oleh karena itu, rekomendasi yang dibuat dalam studi ini menyediakan panduan berharga tentang pengobatan terhadap tungau Varroa destructor , yang memungkinkan peternak lebah untuk mengelola serangan tungau sambil menjaga kesehatan koloni dan perkembangan drone yang optimal, yang penting untuk keberhasilan reproduksi.
