ABSTRAK
Nanopartikel fluoresensi inframerah dekat II (NIR-II) (NP) berdasarkan emisi yang diinduksi agregasi (AIE) telah menarik perhatian signifikan karena kemampuan pencitraan multimoda serta efek terapi fototermal dan fotodinamik gabungan dalam terapi kanker. Dilaporkan di sini adalah molekul AIE yang dirancang secara rasional (BPT), melalui penggabungan unit fenotiazin dengan kemampuan donor elektron dan pembentukan spesies oksigen reaktif (ROS) yang kuat ke dalam perancah AIE klasik tetrafeniletilena, yang selanjutnya digabungkan dengan akseptor elektron kuat bernama benzo[1,2-c:4,5-c’]bis[1,2,5]thiadiazole. NP BPT menunjukkan emisi fluoresensi NIR-II maksimum pada 1083 nm, hasil kuantum fluoresensi 1,53%, efisiensi konversi fototermal 63%, dan kemampuan pencitraan fotoakustik, di samping kemampuan pembentukan ROS tipe I yang cukup besar. Selain itu, ketika sejenis donor oksida nitrat (NO) bernama O 2 -(2,4-dinitrofenil) 1-[(4-etoksikarbonil) piperazin-1-il]diazen-1-ium-1,2-diolat (JSK) dimasukkan, JSK-BPT NP yang sesuai dapat menghasilkan O 2 − , NO, dan peroksinitrit untuk menginduksi fototoksisitas. Dengan menerapkannya pada model tumor payudara 4T1, JSK-BPT NP mencapai pencitraan multimoda berkualitas tinggi dari daerah pembuluh darah dan tumor pada tikus. Di bawah panduan pencitraan multimoda, tumor 4T1 dapat dihilangkan sepenuhnya setelah satu dosis JSK-BPT NP dan di bawah penyinaran laser 808 nm.
1 Pendahuluan
Terapi fototermal (PTT) adalah modalitas pengobatan kanker yang memanfaatkan fotosensitizer untuk menyerap cahaya inframerah dekat (NIR) dan mengubahnya menjadi panas, yang menginduksi hipertermia lokal di dalam jaringan tumor, sehingga menyebabkan kematian sel kanker sambil menyelamatkan jaringan sehat di sekitarnya dari kerusakan yang nyata [ 1 , 2 ]. Sejalan dengan itu, berbagai molekul kecil organik dan fotosensitizer berbasis nanopartikel telah dikembangkan [ 3 , 4 ]. Namun, hanya sebagian kecil dari bahan-bahan ini yang memiliki kemampuan pencitraan dan pelacakan obat yang jelas, apalagi kapasitas untuk pencitraan multimoda, seperti pencitraan fluoresensi (FLI) jendela kedua NIR (NIR-II), pencitraan fotoakustik (PAI), dan pencitraan fototermal (PTI) [ 5 – 8 ]. Dibandingkan dengan metode pencitraan tradisional, pencitraan multimoda memungkinkan deteksi tumor beresolusi tinggi, waktu nyata, dan bebas radiasi, menggambarkan batas tumor dengan jelas dan secara signifikan meningkatkan presisi pengobatan tumor [ 9 , 10 ]. Baru-baru ini, beberapa molekul kecil organik fluoresensi NIR-II dengan sifat emisi yang diinduksi agregasi (AIE) telah dikembangkan untuk terapi FLI dan tumor in vivo [ 11 – 13 ]. Kombinasi karakteristik yang melibatkan emisi fluoresensi panjang gelombang panjang lebih dari 1050 nm, kecerahan yang sesuai dengan hasil kuantum >1%, efisiensi konversi fototermal (PCE) tinggi yang melebihi 50%, dan kemampuan menghasilkan spesies oksigen reaktif (ROS) yang kuat sangat diinginkan untuk bahan AIE yang ideal [ 14 – 16 ].
Berasal dari PTT mode tunggal tradisional, terapi fotodinamik (PDT) dan terapi gas telah menunjukkan kemanjuran pengobatan tumor yang luar biasa [ 17 – 19 ]. Terapi PDT mengacu pada penggunaan fotosensitizer untuk menghasilkan ROS di area tumor. Dibandingkan dengan proses PDT tipe II yang diwakili oleh pembentukan oksigen singlet ( 1 O 2 ), proses PDT Tipe I menghasilkan radikal superoksida (O 2 − ) melalui transfer elektron dari fotosensitizer yang tereksitasi triplet [ 20 – 22 ], yang kurang bergantung pada oksigen dan menawarkan janji yang lebih besar untuk mengobati tumor hipoksia. Sementara itu, oksida nitrat (NO) adalah molekul terapi gas khas yang dapat menghambat pertumbuhan tumor pada konsentrasi tinggi [ 23 , 24 ]. O 2 -(2,4-dinitrofenil) 1-[(4-etoksikarbonil) piperazin-1-il]diazen-1-ium-1,2-diolat (dikenal sebagai JSK) adalah agen penekan tumor yang mampu menghabiskan glutathione reduktif (GSH) dalam sel tumor dan melepaskan NO, yang dapat bereaksi dengan radikal superoksida untuk membentuk peroksinitrit (ONOO − ), menginduksi apoptosis dan ferroptosis melalui kerusakan langsung pada membran sel, protein, dan DNA [ 25 ]. Namun, pengiriman yang ditargetkan pada tumor secara tepat dan pelepasan JSK yang terkendali masih menjadi tantangan [ 26 ]. Oleh karena itu, tetap penting untuk mengembangkan pendekatan yang memungkinkan pembangkitan panas, O 2 − , NO, dan ONOO − yang terkendali di wilayah tumor, sehingga meningkatkan kemanjuran terapi.
Dalam studi ini, molekul AIE yang dirancang secara rasional telah dikembangkan. Fenotiazin, struktur trisiklik non-planar dengan sifat donor elektron yang kuat, memiliki turunan seperti metilen biru yang menunjukkan kemampuan generasi ROS yang signifikan. Namun panjang gelombang serapan yang pendek (sekitar 660 nm) membatasi aplikasinya dalam pengobatan tumor yang terkubur dalam jaringan dalam [ 27 – 29 ]. Di sini, unit fenotiazin diperkenalkan untuk menggantikan satu cincin fenil dari tetrafeniletilena (TPE) perancah AIE klasik. Bagian AIE yang dimodifikasi selanjutnya dikaitkan dengan akseptor elektron yang kuat benzo[1,2-c:4,5-c’]bis[1,2,5]thiadiazole (perancah BBTD) [ 30 ], menghasilkan molekul AIE fluoresen NIR-II baru (dinamai BPT). Molekul BPT dienkapsulasi ke dalam 1,2-distearoyl-sn-glycero-3-phospho-ethanolamine-methoxy poly-ethylene glycol2000 (DSPE-PEG2000), membentuk nanopartikel fluoresensi AIE yang seragam dan stabil (BPT NPs) dengan ukuran rata-rata sekitar 70 nm. BPT NPs menunjukkan emisi fluoresensi NIR-II maksimum pada 1083 nm dengan hasil kuantum fluoresensi 1,53% dan 63% PCE, serta kemampuan PAI dan kemampuan pembangkitan ROS Tipe I yang cukup besar, yang memungkinkan terapi sinergis fototermal-fotodinamik presisi yang dipandu pencitraan multimodal. Berdasarkan hal ini, JSK dienkapsulasi bersama ke dalam NPs, membentuk NP JSK-BPT. Dimasukkannya kadar GSH intraseluler yang terkuras JSK dan konversi fototermal BPT yang efisien memfasilitasi pelepasan JSK. NO yang diproduksi oleh JSK dan radikal superoksida (O 2 − ) yang dihasilkan oleh BPT selanjutnya membentuk ONOO − di lingkungan mikro tumor untuk meningkatkan efek terapeutik. Studi in-vitro menunjukkan bahwa mayoritas sel tumor dimusnahkan pada konsentrasi rendah NP JSK-BPT (sesuai dengan 20 µM BPT dan 4 µM JSK) di bawah iradiasi laser 808 nm (0,7 W/cm 2 ). Dengan menerapkan NP BPT ke model tumor payudara 4T1, pencitraan multimoda berkualitas tinggi dari daerah pembuluh darah dan tumor pada tikus tercapai. Di bawah panduan pencitraan multimoda, tumor 4T1 dapat dihilangkan sepenuhnya setelah dosis tunggal NP JSK-BPT dan di bawah iradiasi laser 808 nm (Gambar 1 ).
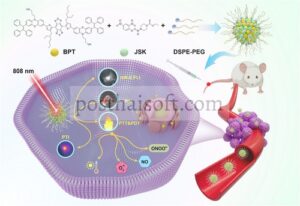
2 Hasil dan Pembahasan
2.1 Sintesis dan Karakterisasi NP BPT
Dalam penelitian terbaru, kombinasi bagian BBTD dan TPE telah divalidasi untuk membangun AIEgen fluoresensi NIR-II [ 31 ]. Fenotiazin, donor elektron kuat dengan struktur trisiklik, telah menunjukkan kemampuan PCE dan pembangkitan ROS yang luar biasa melalui konjugasi yang ditingkatkan dan efek kaya elektron dari atom sulfur [ 32 , 33 ]. Melalui kombinasi modul-modul ini, kita dapat memanfaatkan keunggulannya. Selain itu, bagian tiofena yang dimodifikasi dengan rantai alkil diperkenalkan sebagai jembatan π dan donor elektron sekunder, menghasilkan konstruksi senyawa bernama BPT, seperti yang diilustrasikan dalam Gambar 2A . BBTD dan fenotiazin membentuk pasangan donor-akseptor elektron yang kuat, yang memfasilitasi pergeseran merah dalam panjang gelombang emisi dan meningkatkan kemampuan pembangkitan ROS. Sementara itu, bagian trifeniletilena mengurangi gangguan molekul air dan memberikan sifat AIE pada molekul [ 34 , 35 ]. Lebih jauh lagi, gugus hidroksil pada rantai samping fenotiazin menyediakan pegangan untuk fungsionalisasi molekul lebih lanjut.
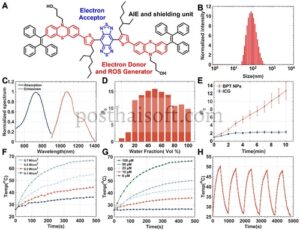
Molekul ini dienkapsulasi ke dalam NP menggunakan polimer amfifilik DSPE-mPEG2000 yang disetujui Food and Drug Administration melalui metode nanopresipitasi [ 36 ]. Karakterisasi hamburan cahaya dinamis (DLS) dan mikroskop elektron transmisi (TEM) mengungkapkan bahwa NP BPT memiliki diameter partikel terhidrasi sekitar 70 nm (Gambar 2B dan Gambar S1 ). Ukuran ini menguntungkan untuk akumulasi nanopartikel di lokasi tumor melalui efek permeabilitas dan retensi yang ditingkatkan (EPR) [ 37 ]. Kapasitas pemuatan obat dan efisiensi enkapsulasi NP BPT masing-masing adalah 7,6% dan 83% (Gambar S2 ). Puncak penyerapan dan emisi maksimum NP BPT diukur pada 780 dan 1083 nm, dan pergeseran Stokes adalah 303 nm (Gambar 2C ). Koefisien kepunahan molar BPT NP pada 808 nm adalah 1,08 × 10 4 M −1 cm −1 , memfasilitasi terapi fototermal saat dieksitasi oleh laser 808 nm. Mayoritas spektrum emisi BPT NP berada di wilayah NIR-II, dengan ekor emisi memanjang melampaui 1350 nm, yang menguntungkan untuk FLI NIR-II berkualitas tinggi. Perhitungan teori fungsi kerapatan mengungkapkan celah energi minimal (Eg) sebesar 1,32 eV antara orbital molekuler terisi tertinggi dan orbital molekuler kosong terendah dari BPT, konsisten dengan posisi puncak emisi fluoresensi yang diamati (Gambar S3 ). Selanjutnya, sifat AIE BPT divalidasi dalam campuran air dan dimetil sulfoksida (DMSO) pada rasio yang bervariasi (Gambar 2D ). Hasilnya menunjukkan bahwa BPT menunjukkan fluoresensi lemah dalam pelarut DMSO murni, sedangkan intensitas fluoresensinya meningkat secara bertahap dengan kadar air yang meningkat dan mencapai peningkatan 15 kali lipat pada larutan berair DMSO 50%. Saat kadar air meningkat lebih lanjut, intensitas fluoresensi BPT sedikit menurun, sementara masih menunjukkan peningkatan AIE sekitar 9 kali lipat dalam larutan berair DMSO 1%. Fenomena ini kemungkinan besar disebabkan oleh sedimentasi agregat BPT dalam proporsi pelarut yang buruk yang lebih tinggi. Khususnya, NP BPT menunjukkan hasil kuantum fluoresensi sekitar 1,53% dalam larutan berair (dihitung menggunakan IR-26 dengan hasil kuantum 0,5%), yang menguntungkan untuk mencapai pencitraan jaringan dalam dengan rasio sinyal terhadap derau yang tinggi (Gambar S4 ).
Kemampuan pembentukan ROS dari BPT NP dievaluasi menggunakan diklorodihidrofluorescein (DCFH), yang dapat diaktifkan oleh ROS dan memancarkan fluoresensi hijau di bawah iradiasi laser 488 nm. Seperti yang diilustrasikan dalam Gambar 2E , di bawah iradiasi laser berkelanjutan, sinyal fotoluminesensi larutan DCFH pada 525 nm secara bertahap meningkat hingga sekitar 13 kali lipat dengan adanya BPT NP, sedangkan intensitas fluoresensi larutan DCFH dengan Indocyanine Green (ICG) menunjukkan perubahan yang dapat diabaikan. Untuk mengonfirmasi lebih lanjut jenis-jenis ROS, kami menggunakan asam 9,10-anthracenediyl-bis(methylene)dimalonic untuk probe oksigen singlet (¹O₂, ROS Tipe II), 3′-(p-aminophenyl) fluorescein untuk probe radikal hidroksil (·OH), dan dihydrorhodamine 123 (DHR123) untuk probe radikal superoksida (O₂⁻, ROS Tipe I) dan hasilnya menunjukkan bahwa NP BPT terutama menjalani reaksi fotodinamik Tipe I untuk menghasilkan radikal superoksida di bawah pencahayaan (Gambar S5 ). Lebih jauh lagi, 5,5-dimetil-1-pirolina N-oksida menangkap ROS untuk analisis EPR, yang mengonfirmasi kemampuan BPT untuk menghasilkan ROS Tipe I (Gambar S6 ). Peningkatan suhu larutan BPT NP ditemukan bergantung pada konsentrasi BPT NP dan kerapatan daya laser, yang menunjukkan bahwa pembangkitan panas BPT NP dapat diatur (Gambar 2F,G ). Di bawah iradiasi laser 808 nm (0,7 W/cm2 ) selama 8 menit, suhu larutan berair yang mengandung BPT NP (BPT 100 µM) mencapai plateau 63°C. PCE BPT NP dihitung sebesar 63%, yang memenuhi persyaratan untuk PTT tumor yang efektif (Gambar S7 ). Setelah lima siklus pemanasan di bawah iradiasi laser 808 nm dan pendinginan, BPT NP mempertahankan kemampuan pembangkitan fototermal (Gambar 2H ). Sebaliknya, di bawah kondisi yang sama, suhu puncak larutan ICG menurun drastis (Gambar S8 ). BPT NP juga menunjukkan fotostabilitas yang superior dibandingkan dengan ICG di bawah iradiasi laser 808 nm kontinyu (Gambar S9 ). Selain itu, dalam jangka waktu 14 hari, BPT NP menunjukkan stabilitas jangka panjang yang ideal baik dalam larutan penyangga fosfat salin (PBS) maupun PBS yang ditambah dengan 10% serum janin sapi (Gambar S10 dan S11 ) dan spektrum penyerapan dan emisi BPT NP tidak menunjukkan perubahan signifikan dalam rentang pH fisiologis (Gambar S12 ).
2.2 Sintesis dan Karakterisasi NP JSK-BPT
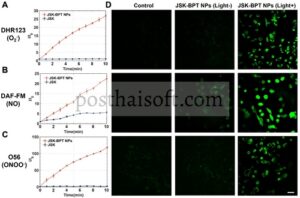
Berdasarkan sifat fototermal dan fotodinamik yang menjanjikan yang ditunjukkan oleh BPT NP, pengenalan terapi gas NO dilakukan untuk lebih meningkatkan kemanjuran terapeutik terhadap tumor. Selama persiapan NP fluoresen, dengan rasio molar 1:5, JSK dan BPT dienkapsulasi bersama dalam DSPE-PEG2000, membentuk NP JSK-BPT @DSPE-PEG2000, selanjutnya disebut sebagai NP JSK-BPT. NP JSK-BPT menunjukkan diameter rata-rata 80 nm seperti yang diukur dengan DLS dan TEM (Gambar S1 dan S13 ), mempertahankan ukuran yang sesuai untuk akumulasi tumor yang didorong oleh efek EPR. Kemampuan generasi ROS dari NP JSK-BPT dinilai baik dalam larutan maupun dalam sel menggunakan tiga probe ROS yang berbeda. Pertama, probe ROS Tipe I DHR123 digunakan untuk mengukur kemampuan produksi O 2 − dari NP JSK-BPT. Dengan diperkenalkannya JSK-BPT NP, intensitas fluoresensi larutan DHR123 meningkat 26 kali lipat dalam waktu 10 menit di bawah iradiasi laser 808 nm pada 0,7 W/cm 2 , sedangkan pengenalan JSK saja menunjukkan perubahan fluoresensi yang dapat diabaikan dalam kondisi yang sama (Gambar 3A ), yang menunjukkan kapasitas pembangkitan ROS Tipe I JSK-BPT NP terutama dikaitkan dengan komponen BPT. Selanjutnya, probe NO 4-amino-5-methylamino-2′,7’—difluorofluorescein (DAF-FM) digunakan untuk mengevaluasi kemampuan produksi NO dari JSK-BPT NP. Dengan iradiasi laser 808 nm pada 0,7 W/cm 2 dan konsentrasi GSH 1 mM, pengenalan JSK-BPT NP ke larutan DAF-FM menyebabkan peningkatan fluoresensi 23 kali lipat dalam 10 menit, sementara penambahan JSK saja hanya menghasilkan peningkatan fluoresensi 4 kali lipat dalam waktu yang sama (Gambar 3B ). Hasil ini menunjukkan bahwa kemampuan fototermal pewarna BPT dalam JSK-BPT NP mempercepat reaksi antara JSK dan GSH, yang mengarah pada peningkatan laju pelepasan NO. Akhirnya, probe ONOO − komersial O56 digunakan untuk secara khusus mendeteksi pembentukan ONOO − . Di bawah iradiasi laser 808 nm pada 0,7 W/cm 2 selama 10 menit, sinyal fluoresensi larutan O56 yang dimuat dengan JSK-BPT NP meningkat hingga 120 kali lipat, sedangkan kelompok kontrol yang dimuat dengan JSK hanya menunjukkan hampir tidak ada peningkatan fluoresensi (Gambar 3C ), yang menunjukkan bahwa kombinasi BPT dan JSK dalam NP secara efektif menghasilkan ONOO − . Ketiga jenis hasil deteksi ROS yang dijelaskan di atas selanjutnya divalidasi dalam percobaan seluler in vitro (Gambar 3D ). Setelah 10 menit iradiasi laser 808 nm pada 0,7 W/cm 2Sel yang diobati dengan NP JSK-BPT menunjukkan fluoresensi hijau yang intens saat diuji dengan DHR123, DAF-FM, atau O56, sementara hanya sinyal fluoresensi lemah yang diamati tanpa adanya NP JSK-BPT atau penyinaran laser. Secara keseluruhan, hasil ini menunjukkan kemampuan pembangkitan ROS yang efisien dari NP JSK-BPT.
2.3 Percobaan Sel In Vitro
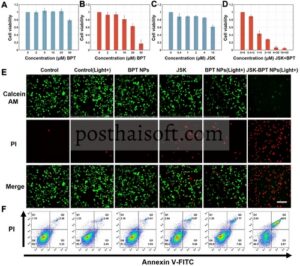
Didorong oleh kemampuan fluoresensi, fototermal, dan pembangkitan ROS dari NP JSK-BPT, kami melanjutkan untuk mengevaluasi kemanjurannya dalam menghambat sel kanker secara in vitro. Untuk meneliti internalisasi seluler, NP BPT berlabel fluorescein isothiocyanate (FITC) (disingkat NP FITC-BPT) disiapkan, dan hasilnya menunjukkan bahwa NP FITC-BPT diinternalisasi oleh sel dalam waktu sekitar 2 jam (Gambar S14 ). Pencitraan ko-lokalisasi dengan lysotracker menunjukkan bahwa NP FITC-BPT memasuki sel melalui jalur endositosis lisosomal (Gambar S15 ). Menggunakan kit penghitungan sel-8 (CCK-8), viabilitas sel 4T1 dalam kondisi pengobatan yang berbeda dinilai. Tanpa iradiasi laser, BPT NP menunjukkan sitotoksisitas minimal, dengan viabilitas sel dipertahankan lebih dari 80% pada konsentrasi BPT 50 µM (dalam bentuk BPT NP) (Gambar 4A ). Ketika dikenai iradiasi laser pada 0,7 W/cm2 selama 10 menit, sel menunjukkan penurunan viabilitas yang bergantung pada konsentrasi, dengan hanya ∼15% viabilitas sel yang tersisa pada konsentrasi BPT 50 µM (dalam bentuk BPT NP) (Gambar 4B ). Selanjutnya, fototoksisitas seluler JSK-BPT NP dievaluasi, dengan JSK sendiri berfungsi sebagai kontrol. Sementara JSK menunjukkan beberapa penghambatan sel tumor (Gambar 4C ), kelompok JSK-BPT NP di bawah iradiasi laser menunjukkan pengurangan yang nyata dalam viabilitas sel, dengan lebih dari 90% aktivitas sel dihambat pada konsentrasi rendah JSK-BPT NP (JSK 4 µM, BPT 20 µM), yang menunjukkan efek antitumor yang lebih kuat daripada BPT NP atau JSK sendiri (Gambar 4D ). Efek antitumor dari NP ini selanjutnya divisualisasikan menggunakan uji pewarnaan AM/PI (Gambar 4E ). Sel dibagi menjadi enam kelompok perlakuan: PBS, PBS + cahaya, BPT NP, BPT NP + cahaya, JSK, dan JSK-BPT NP + cahaya. Konsisten dengan hasil sitotoksisitas, tiga kelompok pertama menunjukkan kematian sel yang dapat diabaikan. Dalam kelompok BPT NP (BPT 20 µM) + cahaya dan JSK (4 µM), apoptosis sel parsial diamati. Dalam kelompok JSK-BPT NP (JSK 4 µM, BPT 20 µM) + cahaya, hampir semua sel terbunuh. Hasil ini dengan jelas menunjukkan sitotoksisitas PTT/PDT sinergis dari JSK-BPT NP, melampaui efek BPT NP atau JSK saja. Analisis apoptosis lebih lanjut dilakukan dengan menggunakan flow cytometry (Gambar 4F ). Dalam kelompok JSK-BPT NP (JSK 4 µM, BPT 20 µM) + cahaya, 49% sel 4T1 menunjukkan apoptosis, yang lebih tinggi daripada sel dalam kelompok yang diobati dengan BPT NP (BPT 20 µM) + cahaya atau JSK (4 µM) saja. Pada kelompok lain, apoptosis dan nekrosis sel minimal. Selanjutnya, asam 5,5′-dithiobis-2-nitrobenzoic digunakan untuk menganalisis perubahan kadar GSH dalam sel, dan hasilnya menunjukkan penurunan kadar GSH intraseluler yang bergantung pada konsentrasi setelah pengobatan NP JSK-BPT dalam kondisi pencahayaan (GambarS16 ).
2.4 Pencitraan Vaskular In Vivo
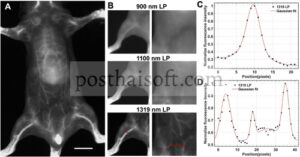
Berikutnya, kami menerapkan model hewan untuk mengevaluasi kemampuan pencitraan multimoda in vivo dan kemampuan pengobatan tumor dari BPT NP dan JSK-BPT NP. Pertama, untuk memverifikasi hemokompatibilitas BPT NP dan JSK-BPT NP, kami melakukan uji hemolisis. Hasilnya menunjukkan bahwa JSK-BPT NP tidak menyebabkan hemolisis pada konsentrasi yang diuji, yang selanjutnya mengonfirmasi biokompatibilitasnya (Gambar S17 ). Kemudian kami mengevaluasi kemampuan pencitraan vaskular NIR-II dari BPT NP. Seperti yang diilustrasikan dalam Gambar 5A , setelah injeksi intravena BPT NP, struktur vaskular di seluruh tubuh tikus dapat diamati dengan jelas di bawah filter long-pass (LP) 1319 nm. Untuk menyelidiki lebih lanjut kualitas pencitraan BPT NP, pembuluh darah di tungkai belakang dan perut tikus dicitrakan di bawah filter LP dengan panjang gelombang yang berbeda (Gambar 5B ). Saat panjang gelombang filter LP diperpanjang dari 900 ke 1319 nm, kejernihan gambar meningkat secara progresif. Gambar vaskular pembuluh darah tungkai belakang di bawah filter LP 1319 nm menunjukkan rasio sinyal-ke-latar belakang tertinggi sebesar 3,35 dan lebar penuh pada setengah maksimum sebesar 0,35 mm (Gambar 5C ), dan gambar pembuluh darah perut mengungkapkan detail yang lebih halus (Gambar 5D ). Hasil ini menunjukkan kemampuan pencitraan in vivo dari BPT NP. Lebih jauh, kami juga menggunakan JSK BPT NP untuk pencitraan pembuluh darah tungkai belakang tikus dan memperoleh rasio sinyal-ke-derau sebesar 2,95, yang menunjukkan bahwa penggabungan JSK tidak mengorbankan kemampuan pencitraan bawaan dari platform nanopartikel (Gambar S18 ).
2.5 Pencitraan dan Pengobatan Tumor InVivo
Kinerja BPT NP dalam NIR-II FLI tikus pembawa tumor 4T1 diperiksa menggunakan sistem pencitraan NIR-II in vivo komersial. Seperti yang ditunjukkan pada Gambar 6A , tidak ada sinyal fluoresensi yang terdeteksi pada tikus di bawah filter LP 1100 nm sebelum injeksi NP (0 jam), yang menunjukkan gangguan latar belakang minimal. Setelah injeksi intravena BPT NP pada ekor, sinyal fluoresensi meningkat secara bertahap di daerah tumor seiring waktu, yang menunjukkan akumulasi lokasi tumor karena efek EPR. Selama periode pengamatan 48 jam, kecerahan fluoresensi NIR-II tertinggi diamati pada 12 jam. NIR-II FLI ex vivo dari jaringan tumor dan berbagai organ selanjutnya mengonfirmasi bahwa meskipun ada sinyal fluoresensi terang di hati dan limpa—organ sistem fagosit mononuklear yang mau tidak mau menangkap sejumlah BPT NP [ 38 ]—NP ini terakumulasi di lokasi tumor (Gambar S19 ). Konsisten dengan hasil NIR-II FLI, sinyal fotoakustik (PA) di lokasi tumor juga menunjukkan peningkatan bergantung waktu, mencapai intensitas maksimum pada 12 jam pascainjeksi (Gambar 6B ). Mempertimbangkan akumulasi tumor maksimum BPT NP, titik waktu 12 jam pascainjeksi dipilih untuk fototerapi berikutnya. Seperti yang ditunjukkan dalam rekaman suhu waktu nyata kamera inframerah (Gambar 6C ), 12 jam setelah injeksi intravena BPT NP, suhu tumor meningkat cepat dari 36,7 menjadi 57,0°C dalam waktu 2 menit di bawah iradiasi laser 808 nm (0,7 W/cm2 ) . Ketika waktu iradiasi diperpanjang hingga 10 menit, suhu tumor mencapai 61,3°C, memenuhi suhu yang diperlukan untuk hipertermia tumor. Sebaliknya, tikus yang diobati dengan garam menunjukkan perubahan suhu yang dapat diabaikan dalam kondisi yang sama (Gambar S20 ).
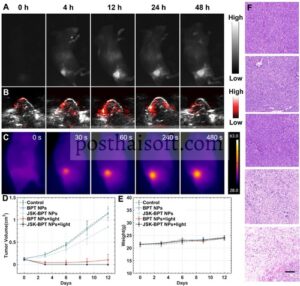
Secara kolektif, percobaan ini memberikan bukti bahwa BPT NP bekerja dengan baik dalam pencitraan tri-modal NIR-II FLI, PAI, dan PTI tumor, yang menjanjikan untuk meningkatkan akurasi fototerapi sinergis spesifik tumor berikutnya dan mengurangi kerusakan yang merugikan pada jaringan normal. Setelah ini, tikus pembawa tumor dibagi secara acak menjadi lima kelompok perlakuan ( n = 4 per kelompok): salin + iradiasi 808 nm, BPT NP, BPT NP + iradiasi 808 nm, JSK-BPT NP, dan JSK-BPT NP + iradiasi 808 nm. Di antara mereka, kelompok saline + iradiasi 808 nm dan BPT NP tidak menunjukkan penghambatan pertumbuhan tumor, sedangkan kelompok JSK-BPT NP menunjukkan sedikit penghambatan pertumbuhan tumor. Pada kelompok iradiasi BPT NPs + 808 nm, tumor diberantas, menunjukkan kemanjuran terapi fototermal dari BPT NPs. Kelompok iradiasi JSK-BPT NPs + 808 nm menunjukkan peningkatan kinerja supresi tumor, dengan eliminasi tumor terjadi lebih cepat daripada kelompok iradiasi BPT NPs + 808 nm dan ablasi tumor lengkap dalam waktu 12 hari, menyoroti kemanjuran JSK-BPT NPs dalam terapi tumor PTT/PDT yang sinergis (Gambar 6D dan Gambar S21 ). Tidak ada penurunan berat badan yang signifikan yang tercatat dalam kelompok perlakuan apa pun selama periode 12 hari (Gambar 6E ) yang secara kolektif menunjukkan biosafety JSK-BPT NPs. Pewarnaan H&E pada daerah tumor selanjutnya mengungkap kerusakan seluler pada kelompok BPT NPs + iradiasi 808 nm dan JSK-BPT NPs + iradiasi 808 nm dibandingkan dengan kelompok lain, yang memvalidasi efek tumorisidal poten dari NP ini (Gambar 6F ). Tidak ada kelainan patologis yang dapat diidentifikasi yang diamati pada organ-organ utama (jantung, hati, limpa, paru-paru, dan ginjal) yang dikumpulkan pada akhir periode pengobatan (Gambar S22 ). Setelah menyuntikkan BPT NPs atau JSK-BPT NPs secara intravena ke tikus sehat selama 14 hari, indeks darah rutin tidak menunjukkan perubahan signifikan dibandingkan dengan kelompok kontrol, yang mengonfirmasi biokompatibilitas NP ini (Tabel S1 ).
3 Kesimpulan
Sebagai kesimpulan, kami mengembangkan dan mengevaluasi BPT, BPT NP, dan JSK-BPT NP untuk pencitraan multimoda dan fototerapi sinergis tumor. BPT NP menunjukkan sifat optik yang memuaskan, termasuk emisi fluoresensi NIR-II maksimum pada 1083 nm, hasil kuantum fluoresensi 1,53%, PCE 63%, kemampuan PAI, dan kemampuan menghasilkan ROS reaktif Tipe I yang cukup besar. Penggabungan JSK selanjutnya meningkatkan efek sinergis PTT dan PDT terhadap tumor. Dibandingkan dengan JSK dan BPT NP individu, JSK-BPT NP menunjukkan kemanjuran membunuh tumor yang jauh lebih baik. Percobaan in vitro menunjukkan kemampuan JSK-BPT NP untuk menghasilkan berbagai ROS untuk menginduksi fototoksisitas. Dalam studi in vivo menggunakan model tumor payudara 4T1, nanoplatform mencapai pencitraan multimoda berkualitas tinggi dari pembuluh darah tikus dan daerah tumor. Sementara itu, di bawah bimbingan pencitraan multimoda, dosis tunggal NP JSK-BPT diikuti oleh penyinaran dengan laser 808 nm menghasilkan ablasi tumor lengkap. Temuan ini menyoroti potensi NP JSK-BPT sebagai platform untuk pencitraan multimoda spesifik tumor dan fototerapi sinergis, yang menawarkan alat yang menjanjikan untuk pengobatan kanker. Di masa mendatang, kami berencana untuk menggunakan rekayasa struktur molekuler untuk lebih meningkatkan intensitas fluoresensi dan efisiensi pembangkitan ROS dari NP BPT dengan menyempurnakan desain molekuler dan penggabungan gugus fungsi tertentu [ 39 , 40 ]. Lebih jauh lagi, kami akan menyempurnakan proses sintesis NP JSK-BPT untuk meningkatkan hasil produksi, memastikan kontrol kualitas yang ketat, dan mengoptimalkan efisiensi biaya. Selain itu, kami akan terus menyelidiki keamanan in vivo jangka panjang mereka dan mengeksplorasi aplikasi potensial mereka dalam model berdampak lainnya, seperti karsinoma hepatoseluler.
Ucapan Terima Kasih
Kami berterima kasih atas dukungan finansial dari Shenzhen Medical Research Fund (B2402042), National Natural Science Foundation of China (22274069 dan 22304070), proyek Shenzhen Science and Technology Program (JCYJ20240813094504007 dan JCYJ20210324104007020), dan Guangdong Provincial Key Laboratory of Advanced Biomaterials (2022B1212010003). Kami berterima kasih atas bantuan dari SUSTech Core Research Facilities. Kami berterima kasih kepada Dr. Yinhua Yang (SUSTech) untuk analisis NMR dan Dr. Hua Li (SUSTech) untuk analisis HPLC. Kami berterima kasih kepada Prof. Changfeng Wu (SUSTech), Prof. Lu Zhang (SUSTech), dan Prof. Kai Li (SUSTech) atas diskusi mereka yang bermanfaat.
