ABSTRAK
Setelah cedera sumsum tulang belakang (SCI) tingkat tinggi, mikroglia reaktif yang terus-menerus mendorong plastisitas yang meluas di seluruh neuraksis. Plastisitas di sumsum torakolumbalis, suatu wilayah yang berhubungan dengan sirkuit refleks simpatis tulang belakang (SSR), berkontribusi pada perkembangan disfungsi simpatis dan gangguan imun terkait. Faktor transkripsi NF-κB diaktifkan setelah SCI, mendorong siklus pro-inflamasi dengan mendorong ekspresi mediator inflamasi yang selanjutnya mengaktifkan sinyal NF-κB. Kami berhipotesis bahwa sinyal NF-κB mikroglia melalui IKKβ memodulasi aktivitas mikroglia, yang memengaruhi aktivitas imun sentral dan perifer yang terkait dengan sirkuit SSR pasca-SCI. Kami menilai efek penghapusan IKKβ kanonik pada mikroglia yang berada di SSP, dampaknya pada aktivasi mikroglia, polarisasi, aktivitas transkripsi sentral, dan aktivitas imun perifer pada 1 dan 4 minggu pasca-SCI (wpi). Analisis transkriptomik mengungkap bahwa IKKβ mikroglia memengaruhi jalur terkait imun di sumsum tulang belakang torakolumbalis pada 1 wpi. Kami menunjukkan bahwa penghambatan pensinyalan NF-κB mikroglia melalui penghapusan aktivator IKKβ mengurangi peningkatan yang disebabkan cedera pada mikroglia M1 “proinflamasi” di sumsum tulang belakang torakolumbalis pada 4 wpi dan meningkatkan jumlah splenosit pada 1 wpi. Studi ini memajukan pemahaman kita tentang bagaimana pensinyalan IKKβ mikroglia membentuk respons neuroimun dan organ imun perifer setelah SCI.
1 Pendahuluan
Neuroinflamasi persisten setelah cedera sumsum tulang belakang (SCI) berkontribusi pada plastisitas di seluruh neuraksis, yang pada akhirnya mengarah pada perkembangan efek sekunder yang menguntungkan dan merugikan (O’Reilly dan Tom 2020 ). Kemajuan dalam mengkarakterisasi efek faktor neuroimun dan inflamasi dari waktu ke waktu pasca cedera telah membantu dalam mengidentifikasi target yang menarik untuk intervensi terapeutik (O’Reilly dan Tom 2020 ; Hu et al. 2023 ). Hal ini sangat penting untuk menargetkan cabang simpatik dari sistem saraf otonom, yang menginervasi banyak sistem organ, termasuk organ imun perifer (misalnya, limpa, timus, sumsum tulang, dll.) (Wulf dan Tom 2023 ; Kenney dan Ganta 2014 ). Karena disfungsi organ yang dimediasi simpatik merupakan salah satu penyebab utama morbiditas dan mortalitas pasca SCI (Garshick et al. 2005 ), memahami mekanisme plastisitas yang dimediasi neuroimun yang memengaruhi sistem ini menjadi sangat penting.
Mikroglia dan makrofag turunan monosit yang menyusup mengeluarkan berbagai faktor inflamasi (misalnya, TNFα, IL-1β, IL-6) yang secara langsung dan tidak langsung mengatur beberapa aspek plastisitas yang diinduksi cedera yang memengaruhi aktivitas sirkuit sentral dan tulang belakang (O’Reilly dan Tom 2020 ; Donnelly dan Popovich 2008 ; Liu et al. 2013 ; Rizzo et al. 2018 ). Setelah SCI, mikroglia/makrofag sangat penting untuk membersihkan serpihan dan mengoordinasikan aktivasi sel imun dan glia, serta pembentukan dan/atau pemangkasan sinapsis neuronal dan duri dendritik (O’Reilly dan Tom 2020 ; Brennan et al. 2022 ; Blinzinger dan Kreutzberg 1968 ; Ziebell et al. 2015 ). Melalui fungsi-fungsi ini, mikroglia/makrofag memengaruhi pemulihan setelah SCI. Namun, manipulasi eksperimental mikroglia telah menghasilkan temuan yang saling bertentangan, dengan beberapa menunjukkan penipisan mikroglia/makrofag memperburuk cedera sekunder dan pemulihan fungsional (Brennan et al. 2018 ; Fu et al. 2020 ; Bellver-Landete et al. 2019 ), sementara yang lain menunjukkan hasil yang lebih baik (Zhu et al. 2015 ; Popovich et al. 1999 ; Ma et al. 2016 ). Dikotomi ini dapat dikaitkan dengan perubahan subpopulasi mikroglia/makrofag dan menyoroti pentingnya menargetkan subkelas mikroglia tertentu dalam konteks peradangan kronis. Secara khusus, mikroglia M1 “pro-inflamasi” memberikan efek neurotoksik pada kelangsungan hidup dan pertumbuhan neuronal dan melepaskan sitokin/kemokin yang merangsang infiltrasi sel imun lebih lanjut (Kigerl et al. 2009 ; David dan Kroner 2011 ). Hal ini diimbangi oleh mikroglia M2 “anti-inflamasi”, yang memandu lingkungan menuju neuroproteksi dan perbaikan melalui peningkatan fagositosis dan promosi neuro- dan angiogenesis setelah SCI (David dan Kroner 2011 ; Jurga et al. 2020 ; Akhmetzyanova et al. 2019 ). Namun, mikroglia/makrofag M1 sebagian besar diamati setelah SCI dibandingkan dengan sel M2 dan menunjukkan ekspresi yang berkepanjangan dan terus-menerus yang berkontribusi terhadap konsekuensi sekunder yang merugikan dari waktu ke waktu pasca-SCI (Kigerl et al. 2009 ; David dan Kroner 2011 ; Bradbury dan Burnside 2019 ). Berdasarkan peran yang berbeda dari mikroglia M1 versus M2 dalam kondisi inflamasi kronis, mengganggu sinyal pro-inflamasi dari mikroglia M1 dapat meningkatkan ekspresi mikroglia M2 dan memengaruhi plastisitas yang dimediasi imun setelah SCI.
Menariknya, setelah SCI, banyak sitokin membentuk loop autokrin proinflamasi yang secara terus-menerus mengaktifkan kompleks faktor transkripsi NF-κB (Donnelly dan Popovich 2008 ; Liu et al. 2013 ; Rizzo et al. 2018 ), termasuk dalam jaringan jauh di bawah SCI (Mironets et al. 2018 ). Dalam kondisi inflamasi kronis, seperti setelah SCI, aktivasi NF-κB yang berkelanjutan terbukti meningkatkan mikroglia M1 dan memengaruhi pensinyalan neuronal, apoptosis, dan neurodegenerasi (Guo et al. 2022 ; Liu et al. 2017 ; Shim et al. 2011 ; Yu et al. 2002 ; Mihalas et al. 2013 ; Frakes et al. 2014 ). Selain itu, sebagai respons terhadap rangsangan yang meluas, aktivasi sinyal NF-κB kanonik melalui fosforilasi IKKβ menginduksi translokasi nuklir subunit p65/p50, yang menekan fenotipe “anti-inflamasi” M2 (Zhang et al. 2013a ; Sun 2017 ). Manipulasi NF-κB kanonik melalui IKKβ dalam mikroglia/makrofag juga memengaruhi peradangan, kematian sel, dan perubahan transkriptomik yang terkait dengan penyakit neurodegeneratif (Frakes et al. 2014 ; Wang et al. 2022 ; Dresselhaus and Meffert 2019 ).
Bahasa Indonesia: Semakin dipahami bahwa neuroinflamasi yang diinduksi cedera di SSP dapat memodulasi regulasi umpan balik simpatik ke organ imun perifer, yang selanjutnya memengaruhi imunitas sistemik versus sentral (Brommer et al. 2016 ; Pruss et al. 2017 ). Keluaran simpatik ke organ efektor dimediasi oleh sirkuit refleks simpatik spinal (SSR), yang mengintegrasikan sinyal serat aferen dari perifer, yang diteruskan melalui interneuron propriospinal, dan sinyal penghambatan menurun dari batang otak ke neuron preganglionik simpatik (SPN) di kolom sel intermediolateral (IML; segmen T1-L2) (Eldahan dan Rabchevsky 2018 ). Dari sini, SPN memodulasi aktivitas struktur organ perifer, termasuk yang terkait dengan fungsi imun. Setelah SCI, interupsi regulasi supraspinal sirkuit SSR menyebabkan munculnya aferen primer dan akson propriospinal, perubahan aktivitas interneuron glutamatergik, dan perubahan masukan ke SPN, sehingga meningkatkan plastisitas yang diinduksi cedera (Mironets et al. 2018 ; Mironets et al. 2020 ; Noble et al. 2022 ; Llewellyn-Smith dan Weaver 2001 ; Llewellyn-Smith et al. 1997 ; Krassioukov et al. 2002 ). Akibatnya, rangsangan sensorik di bawah cedera berkontribusi pada peningkatan aktivasi sirkuit SSR, yaitu hiperrefleksia simpatik. Peningkatan pelepasan simpatik yang dihasilkan berdampak pada organ perifer yang menerima persarafan simpatik. Misalnya, hiperrefleksia simpatik dikaitkan dengan atrofi limpa dan perubahan populasi splenosit setelah SCI pada tikus (Ueno et al. 2016 ; Ulndreaj et al. 2020 ; Zhang et al. 2013b ; Brennan et al. 2021 ; Noble et al. 2018 ). Melalui jalur ini, sirkuit SSR menjembatani pensinyalan imun sentral dan perifer. Karena peradangan yang dimediasi mikroglia diusulkan untuk memodulasi aktivitas saraf simpatik (Li et al. 2020 ), hal itu juga dapat memengaruhi fungsi imun perifer. Oleh karena itu, menyelidiki peran pensinyalan IKKβ mikroglia dapat menjelaskan mekanisme yang memengaruhi aktivitas imun sentral dan perifer setelah SCI.
Di sini, kami bertujuan untuk lebih jauh mengkarakterisasi dasar neurobiologis dan seluler dari peradangan persisten setelah SCI yang berkontribusi terhadap disfungsi otonom setelah cedera. Melalui penggunaan promotor Tmem119 khusus mikroglia (Bennett et al. 2016 ), kami menghapus secara kondisional aktivator NF-κB kanonik IKKβ secara khusus dalam mikroglia untuk memeriksa bagaimana pensinyalan IKKβ mikroglia setelah SCI tingkat tinggi membentuk polarisasi mikroglia dan lingkungan inflamasi pada 1 dan 4 minggu pasca-SCI.
2 Metode
2.1 Penggunaan Hewan dan Pemberian Tamoxifen
Semua prosedur perawatan hewan disetujui oleh Komite Perawatan dan Penggunaan Hewan Institusional Universitas Drexel (IACUC) dan dilakukan sesuai dengan pedoman Asosiasi Penilaian dan Akreditasi Perawatan Hewan Laboratorium (AAALAC)/Institut Kesehatan Nasional (NIH).
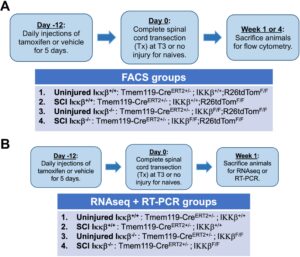
Untuk menghasilkan knockout bersyarat dari aktivator NF-κB IKKβ dalam mikroglia, kami menyilangkan garis Tmem119-Cre ERT2 (Jackson Labs, 031820) (Kaiser dan Feng 2019 ) dengan IKKβ-floxed (Li et al. 2003 ) (awalnya diberikan oleh Michael Karin ke Bethea Lab) dan/atau tikus R26tdTom-floxed-Stop. Hewan ditempatkan di kandang dengan maksimum 5 ekor per kandang pada siklus terang/gelap 12 jam dengan akses makanan dan air sepuasnya . Percobaan genotipe PCR dan RT-qPCR dilakukan menggunakan primer yang disediakan dalam Tabel S1 dan S2 . Untuk semua percobaan, tikus jantan dan betina yang digunakan adalah Tmem119-Cre +/− heterozigot dan IKKβ fl/fl dan/atau R26tdTom fl/fl (Data S1 ). Tikus Tmem119-Cre ERT2+/− ::R26tdTom fl/fl transgenik ganda atau tikus Tmem119-Cre ERT2+/− :: IKKβ fl/fl R26tdTom fl/fl transgenik rangkap tiga disapih pada P28. Tamoxifen (0,1 mg/g; Sigma, T5648) diberikan secara intraperitoneal (ip) sekali sehari selama 5 hari berturut-turut untuk menginduksi rekombinasi tidak lebih awal dari P42 (lihat Gambar S1 untuk validasi paradigma pemberian). Rekombinasi ini menghasilkan ekspresi TdTom-reporter pada mikroglia Tmem119 + pada tikus Tmem119-Cre ERT2+/− ::R26tdTom fl/fl transgenik ganda dan ekspresi tdTom serta delesi aktivator NF-κB IKKβ pada mikroglia Tmem119 + pada tikus Tmem119-Cre ERT2 +/− :: IKKβ fl/fl R26tdTom fl/fl transgenik rangkap tiga . Selain itu, tidak ada perbedaan jenis kelamin yang terlihat. Semua prosedur pembedahan dan/atau eksperimen dimulai 7 hari setelah pemberian tamoxifen terakhir. Penurunan jumlah didokumentasikan secara anekdot (sebagian besar karena masalah perawatan kandung kemih) dan tampaknya tidak lebih umum terjadi pada satu kelompok. Hanya hewan yang bertahan hidup hingga titik akhir terminal penelitian yang disertakan dalam analisis.
2.2 Prosedur Bedah
Seperti yang diuraikan dalam Gambar 1 , hewan dari setiap kelompok secara acak ditugaskan ke kelompok cedera atau tidak cedera. Semua prosedur pembedahan dilakukan dengan anestesi isoflurane (induksi 5%, pemeliharaan 2%, oksigen 100% pada 0,5 L/menit), menggunakan teknik aseptik, instrumen yang disterilkan, dan bantalan pemanas termal baik intra dan pasca operasi. Semua hewan diobati dengan ampisilin (AuroMedics Pharma; 200 mg/kg, sc) dan larutan Ringer laktat 1 mL (sc). Setidaknya 1 minggu setelah dosis terakhir tamoxifen, hewan menjalani cedera T3Tx-SCI semu atau lengkap. Badan vertebra T2 diisolasi dan transeksi lengkap kaudal ke badan vertebra T2 dilakukan dengan menggunakan gunting mikro diikuti oleh jarum ukuran 30 yang dijalankan di sepanjang tepi ventral dan lateral kanal tulang belakang di lokasi sayatan. Kelengkapan lokasi cedera diverifikasi secara visual, dan rongga diisi dengan busa gel. Lapisan otot dan kulit kemudian dijahit dengan jahitan Vicryl 5–0. Hewan menerima larutan Ringer pascaoperasi (1 mL, sc) 1 hari pasca-SCI, dan kandung kemih diperas 2 hingga 3 kali per hari selama durasi penelitian.
2.3 Histologi
Bahasa Indonesia: Untuk memvalidasi rekombinasi efisien yang diinduksi tamoxifen, kami membandingkan tingkat rekombinasi setelah menyuntikkan tamoxifen (ip; 0,1 mg/g) selama 3 atau 5 hari berturut-turut (Kaiser dan Feng 2019 ; Madisen et al. 2010 ; Jahn et al. 2018 ). Satu minggu setelah injeksi terakhir, hewan diperfusi dengan 0,9% saline dan 4% paraformaldehyde (PFA). Sumsum tulang belakang difiksasi pasca dalam 4% PFA semalaman diikuti oleh 30% sukrosa dan 0,02% thimerosal pada 4 ° C. Segmen sumsum tulang belakang T6-T8 dipotong dalam bidang transversal (ketebalan 30 μm) pada kriostat. Potongan diblokir dalam serum kambing 10% dan Triton X-100 0,3% (Sigma, #9036-19-5) dalam 1x PBS selama 1 jam, diikuti oleh inkubasi semalam pada suhu 4 ° C dalam IBA1 (Wako, 019-19741; 1:1000) yang diencerkan dalam serum kambing 1% dan Triton X-100 0,3% dalam PBS. Keesokan harinya, potongan dicuci dalam PBS 1x sebanyak 7 kali, 5 menit per pencucian, kemudian diinkubasi dalam antikelinci Alexa 488 (Invitrogen, A-11008, 1:500) selama 2 jam pada suhu ruangan dengan pengadukan lembut. Potongan kemudian dicuci dalam PBS 1x dan dipasang pada slide menggunakan FluorSave (EMD Millipore, #34789).
Untuk analisis histologi, minimal lima bagian per hewan digunakan untuk kuantifikasi dan diambil melalui mikroskop epifluoresensi Leica DM5500B menggunakan SlideBook 6. Semua gambar diambil menggunakan pengaturan yang sama. Analisis dilakukan menggunakan ImageJ. Menggunakan satu set wilayah minat di sekitar nukleus intermediolateral jaringan sumsum tulang belakang toraks (T6-T8), jumlah total sel IBA1 + dan tdTom + per bagian dikuantifikasi dan dianalisis untuk menentukan rasio mikroglia IBA1 + yang mengekspresikan tdTom secara bersamaan versus mikroglia IBA1 + tanpa ekspresi reporter.
2.4 Ekstraksi dan Kuantifikasi Protein
Segmen sumsum tulang belakang yang ditujukan untuk analisis western blot atau ELISA dibedah segar dan dibekukan dengan cepat dalam 2-metilbutana dan es kering. Sampel disimpan pada suhu -80 ° C hingga ekstraksi. Protein diekstraksi pada 10% berat/volume menggunakan buffer lisis non-deterjen [0,07 g NaCl, 500 μL 1 M Tris, 9,5 mL diH2O, 2 tablet penghambat protease (Roche, #11697498001) dan 1 tablet penghambat fosfatase (Roche, #4906845001)]. Sampel dipisahkan melalui sonikasi dan disentrifugasi (Eppendorf 5417R) pada 10.000 rcf selama 15 menit pada suhu 4 ° C. Supernatan yang dihasilkan dari setiap sampel kemudian dialiquot, dan protein diukur melalui Uji Protein Pierce BCA sesuai dengan petunjuk pabrik (Thermo Scientific, Cat. #23225). Uji protein dianalisis menggunakan Tecan Infinite M Nano + (Tecan Trading, Swiss) pada 570 nm.
2,5 Western Blot
Protein yang diekstraksi dari sumsum tulang belakang toraks (~T4–T13) diukur, dan 20 μg protein per sampel dimasukkan untuk setiap bercak. Protein dipisahkan pada gel Bolt 4%–12% Bis-Tris Plus (Invitrogen, #NW04127BOX) dan elektroforesis gel (Invitrogen, PowerEase 90 W Power Supply) dilakukan pada 100v selama ~1,5 jam dengan buffer Bolt MES (Invitrogen, B0002). Gel kemudian dipindahkan ke membran nitrocellulose (Invitrogen, #IB23001) melalui iBlot2 (ThermoFisher) yang diatur pada 15v selama 7 menit sesuai dengan petunjuk pabrik. Membran kemudian dicuci dalam TBS selama 5 menit, diulang tiga kali. Membran diblokir selama 1 jam pada suhu kamar dalam Intercept Blocking Buffer (LiCor, 927–60.001). Membran kemudian diuji semalaman pada suhu 4 ° C dengan anti-IBA1 kelinci (Wako Chemicals 019-19741; pengenceran 1:1000) dan anti-β-aktin tikus (Sigma A5316; pengenceran 1:15 k). Bercak dicuci dalam TBS-T 3 kali, 5 menit per pencucian, dan diinkubasi dalam antibodi sekunder (kambing anti-kelinci IRDye 800CW, diencerkan 1:50 k, #926–32.211; kambing anti-tikus IRDye 680RD, diencerkan 1:50 k, #926-68070; LI-COR Biosciences) selama 1 jam, tertutup, pada suhu kamar. Membran dicuci seperti yang dijelaskan dan divisualisasikan melalui Pemindai LI-COR Odyssey (Clx Model 9140).
Blot dijalankan secara duplikat dan pengaturan kecerahan/kontras dinormalkan di semua blot melalui Image Studio Lite (LI-COR). Blot diukur melalui ImageJ (NIH) menggunakan satu set wilayah minat untuk mengukur intensitas pita IBA1 dan aktin. Dalam setiap subjek, pengukuran latar belakang setiap protein dikumpulkan dan dikurangi dengan cara yang sama untuk mengontrol varians latar belakang. Pengukuran IBA1 kemudian dinormalkan dalam subjek terhadap ekspresi pengurus aktin. Nilai akhir ini (yaitu, [latar belakang IBA1]/[latar belakang aktin]) diekspresikan sebagai perubahan lipat atas kontrol, dengan rata-rata yang tidak terluka untuk setiap blot digunakan sebagai kontrol. Berdasarkan hal ini, rata-rata di seluruh blot duplikat dihitung dan dibuat grafiknya melalui Prism (Versi 9.5; GraphPad Software LLC).
2.6 Persiapan dan Flow Cytometry dari Splenosit
Pada 1 atau 4 wpi, hewan dieutanasia melalui injeksi intraperitoneal Euthasol (390 mg/kg pentobarbital; 50 mg/kg fenitoin natrium; Vedco Inc., St. Joseph, OH). Limpa dibedah segar dan dipisahkan secara mekanis melalui saringan sel 40 μm menggunakan gagang spuit 3 mL. Sel dicuci melalui saringan melalui medium RPMI-1640 hingga volume akhir 15 mL. Homogenat disentrifugasi pada 0,3 rcf selama 5 menit pada 4 ° C (Eppendorf 5702R). Supernatan dibuang, dan pelet dicuci dengan 10 mL buffer MACS (0,5% BSA, 2 mM EDTA, HBSS tanpa Ca 2+ /Mg 2+ ). Sampel disentrifugasi seperti di atas, supernatan dibuang, dan diinkubasi dalam 3 mL 1× RBC Lysis Buffer (Biolegend Cat #420302) selama 5 menit pada suhu ruangan. Kemudian, 10 mL buffer MACS ditambahkan dan sampel diinkubasi selama 2 menit lagi pada suhu ruangan. Sampel kemudian dituangkan ke atas saringan sel 40 μm dan disentrifugasi (seperti di atas). Supernatan dibuang, dan pelet disuspensikan kembali dalam 4 mL buffer MACS. Sel kemudian diukur seperti yang dijelaskan sebelumnya (Wu et al. 2020 ). Sel dibagi menjadi kelompok pewarnaan dan diinkubasi dalam larutan pemblokiran (TruStain FcX anti-mouse CD16/32; Biolegend Cat #101319; diencerkan hingga 0,5 mg/mL dalam pencucian FACS: 1% BSA, 0,2% NaN 3 dalam HBSS) selama 10 menit pada suhu 4 ° C. Setelah dicuci dalam buffer FACS, sel disuspensikan kembali dalam Zombie Aqua Viability Dye (1:100 dalam PBS; Biolegend Cat #423101) dan diinkubasi selama 15 menit pada suhu 4 ° C dalam gelap. Sel dicuci lagi, supernatan dibuang, dan disuspensikan kembali dalam koktail antibodi yang sesuai selama 30 menit pada suhu 4 ° C dalam gelap (Tabel S3 ). Bahasa Indonesia: Setelah dicuci dalam buffer FACS, sampel Stain 2 diinkubasi dalam buffer Fix/Perm (Milteny Biotec, Cat #130–093-142) selama 30 menit pada suhu 4 ° C, dicuci, diinkubasi dalam buffer permeabilisasi selama 15 menit pada suhu 4 ° C, dicuci, dan disuspensikan kembali dalam FoxP3 (eBioscience; Tabel S3 ) selama 30 menit pada suhu 4 ° C. Setelah inkubasi antibodi akhir, sampel dicuci dan disuspensikan kembali dalam PFA 2% (pH ~7,4) dan diinkubasi selama 10 menit pada suhu 4 ° C. Sampel kemudian dicuci tiga kali dalam buffer FACS dan disuspensikan kembali dalam buffer FACS 100 μL untuk transportasi di atas es.
Analisis populasi splenosit dilakukan melalui penganalisa FACSymphony di The Wistar Institute (Fasilitas Flow Cytometry di The Wistar Institute, Philadelphia PA). Kompensasi untuk setiap warna dilakukan melalui manik kompensasi (Invitrogen; UltraComp eBeads 01-2222-42 untuk antibodi, ArC Amine Compensation Beads untuk Zombie Dye A10628). Gating untuk sel hidup singlet dilakukan, dan sel CD45 + dianalisis untuk ekspresi neutrofil, makrofag/monosit, sel B, dan berbagai kelas sel T (pembunuh, pembantu, pengatur) (Gambar S8 ). Data mentah untuk sampel flow cytometry limpa dianalisis melalui FlowJo v10 (BD Bioscience).
2.7 Persiapan Mikroglia Sumsum Tulang Belakang untuk Flow Cytometry dan FACS Sorting
Setelah limpa diambil dari hewan pada 1 atau 4 wpi seperti dijelaskan di atas, hewan tersebut diperfusi transkardial dengan 10 mL PBS 1× dingin. Sekitar 2 cm jaringan tulang belakang segar dari ~T3-L1 diisolasi dan dibedah untuk FACS atau RT-qPCR.
Untuk mengisolasi mikroglia di sumsum tulang belakang, sampel sumsum tulang belakang torakolumbalis yang dibedah dihomogenkan secara mekanis melalui saringan sel 70 μm dengan HBSS dan dibilas dengan HBSS hingga volume akhir 15 mL. Sampel disentrifugasi pada 0,3 rcf selama 10 menit pada suhu 4 ° C, supernatan dituang, dan diinkubasi dalam Myelin Removal Beads II (pengenceran 1:10 dalam buffer MACS; Miltenyi Biotec, 130-096-731) (buffer MACS: 0,5% BSA dalam HBSS) selama 15 menit pada suhu 4 ° C. Sampel kemudian dicuci dalam buffer MACS selama 15 menit pada 0,3 rcf. Kolom LS (Miltenyi Biotec, 130-042-401) diseimbangkan dengan buffer MACS 3 mL. Debris mielin dari sampel kemudian dipisahkan secara magnetis dengan melewatkannya melalui kolom LS yang sesuai pada MACS Multistand (Miltenyi Biotec, 130-042-303). Kolom dicuci dua kali dengan buffer MACS hingga volume akhir 3 mL. Sampel kemudian diputar pada 0,3 rcf selama 10 menit pada suhu 4 ° C. Supernatan didekantir, dan pelet yang tersisa diinkubasi dalam larutan pemblokiran (dijelaskan di atas) selama 20 menit pada suhu 4 °C. Sampel dicuci dalam buffer FACS (1% BSA dalam HBSS) dan diinkubasi dalam Zombie Aqua Viability selama 15 menit pada suhu 4 ° C dalam gelap. Setelah pencucian lain, semua sampel diinkubasi dalam campuran koktail antibodi (Tabel S4 ) selama 45 menit pada suhu 4 ° C dalam gelap. Sampel dicuci lagi, diinkubasi dalam 2% PFA selama 20 menit pada suhu 4 ° C, kemudian dicuci tiga kali dalam buffer FACS. Setelah pencucian akhir, sampel disuspensikan kembali dalam 100μL buffer FACS dan disimpan di atas es untuk pengangkutan.
Penggerbangan dan penyortiran mikroglia spinal dilakukan melalui MoFlo Astrios di The Wistar Institute (The Wistar Institute, Beckman Coulter MoFlo Astrios EQ, S10 OD017998-01). Setelah kompensasi dan penggerbangan untuk sel singlet hidup, mikroglia pertama-tama digerbang sebagai subpopulasi sel CD45 lo CD11b + (Gambar S6A–D ). Mikroglia Tmem119 kemudian diidentifikasi melalui penggerbangan untuk reporter tdTomato dalam populasi ini (Gambar S6E ). Keadaan polarisasi sel CD45 lo CD11b + Tmem119 + dianalisis melalui kuadran untuk penanda CD206 dan/atau CD86. Berdasarkan penanda ini, mikroglia diidentifikasi sebagai terpolarisasi ke arah M1 (CD86 + CD206 − ), M2 (CD86 − CD206 + ), intermediet (CD86 + CD206 + ), atau double-negatif (CD86 − CD206 − ) (Gambar S6F ). Sel dari setiap populasi disortir untuk ekstraksi RNA hilir (dijelaskan di bawah). Data mentah untuk sampel sitometri aliran sumsum tulang belakang dianalisis melalui FlowJo v10 (BD Bioscience).
2.8 Isolasi dan Kuantifikasi RNA
Seperti yang dinyatakan di atas, jaringan torakolumbalis yang baru dibedah (~T3-L1) diisolasi untuk analisis terkait RNA. Untuk sampel toraks global pada 1 wpi, jaringan sumsum tulang belakang yang sesuai ditempatkan dalam Larutan Stabilisasi RNAlater (Invitrogen; AM7021) pada suhu 4°C. RNA diekstraksi dengan menghomogenkan jaringan dalam Trizol (Invitrogen; Cat #15596018; volume akhir 1 mL) dan dipisahkan dengan menambahkan kloroform (Thermo Scientific, Cat. #423550040) untuk pemisahan fasa setelah inkubasi 2 menit pada suhu ruangan. Sampel kemudian disentrifugasi pada 12.000 rcf selama 15 menit pada suhu 4°C (Eppendorf 5425R). Fase air bagian atas yang mengandung RNA diisolasi ke dalam 100% isopropanol (Sigma, #I9516) dan RNA diendapkan melalui inkubasi selama 10 menit pada suhu 4 ° C. Sampel kemudian diputar selama 10 menit pada 12.000 rcf pada suhu 4 ° C. Supernatan dituang dan dicuci dalam etanol 75% 200-proof (Decon Laboratories #2716, King of Prussia, PA) melalui sentrifugasi pada 7500 rcf selama 5 menit pada suhu 4 ° C. Pelet kemudian dikeringkan dengan udara sebentar selama ~7 menit. Pelet disuspensikan kembali dalam H 2 O bebas nuklease (Invitrogen, Cat #AM9932) diikuti oleh Perlakuan TURBO DNase (Invitrogen, AM1907), seperti yang dijelaskan oleh produsen. Sampel diinkubasi dalam Perlakuan DNase dalam penangas air selama 20 menit pada suhu 37 ° C. Reagen Inaktivasi DNase kemudian ditambahkan, dan sampel diinkubasi pada suhu ruangan selama 5 menit. Sampel kemudian disentrifugasi pada 10.000rcf selama 1,5 menit pada suhu 4 ° C. Natrium asetat 3 M volume 10x (Invitrogen, #R1181) dalam glikogen (Invitrogen, #R0551) dan etanol 100% ditambahkan ke setiap sampel dan diinkubasi semalam pada suhu −80 ° C untuk mengendapkan asam nukleat kecil. Keesokan harinya, sampel diputar pada 17.000rcf selama 15 menit pada suhu 4 ° C. Supernatan dituang, dan sampel dicuci melalui 1 mL etanol 75% dingin selama 5 menit pada 7500 rcf pada suhu 4 ° C. Pelet yang dihasilkan dikeringkan dengan udara selama ~5 menit dan disuspensikan kembali dalam 50 μL H 2 O bebas nuklease. Sampel kemudian disimpan pada suhu -80 ° C atau diukur melalui NanoDrop (Spektrofotometer ND-1000).
Berdasarkan kuantitas RNA per sampel, cDNA disiapkan menggunakan Kit Transkripsi Balik cDNA Berkapasitas Tinggi menggunakan petunjuk pabrik (AppliedBiosystems; Cat #4368814) dalam tabung PCR 0,2 mL (USA Scientific, #1402-4700). Pembuatan cDNA mencakup RT-negatif di mana transkriptase balik dikecualikan. cDNA kemudian disintesis melalui termosikler Eppendorf (MasterCycler Pro, model 6321) dan direkonstitusi pada 1:10 dalam Penyangga TE (Invitrogen, Ref. #AM9849). Sampel disimpan pada suhu -20 ° C.
2.9 Persiapan cDNA dan RT-qPCR
RT-qPCR dilakukan dengan menggunakan sampel cDNA yang dihasilkan seperti dijelaskan di atas. Primer dipesan dari Integrated DNA Technologies (IDT; Tabel S2 ) dan disiapkan sesuai dengan petunjuk pabrik. Campuran induk disiapkan yang mengandung primer maju dan mundur komplementer (10 μM) pada 1:10 dalam SYBR Green Master Mix (Applied Biosystems; #A25742) dengan 3 μL H 2 O bebas nuklease dan 5 μL cDNA per sumur (Applied Biosystems; #4366932). Plat disentrifugasi sebentar pada 1000 rpm selama ~2 menit (Sorvall RT7, DuPont) pada 20°C. Ekspresi gen di setiap plat kemudian dideteksi melalui QuantStudio 6 Flex Real-Time PCR System (Life Technologies) menggunakan QuantStudio v1.7 (ThermoFisher). Semua sampel dilakukan secara duplikat. Replikasi dengan akurasi ~50%–150%, ditentukan menggunakan rumus 2 CT1-CT2 , dirata-ratakan bersama. Tingkat ekspresi gen lipatan relatif terhadap ACTB dihitung menggunakan rumus delta–delta Ct dalam subjek. Nilai-nilai ini kemudian dianalisis untuk signifikansi menggunakan GraphPad Prism v.9.5.
2.10 Pengurutan dan Analisis RNA
RNA dimurnikan dari jaringan sumsum tulang belakang torakolumbalis pada 1 minggu pasca-SCI. Pengurutan RNA dilakukan oleh GENEWIZ (Azenta Life Sciences) dengan pustaka cDNA yang disiapkan menggunakan seleksi PolyA. Kuantitas dan kemurnian RNA dinilai melalui Nanodrop 2000. Skor RIN rata-rata adalah 8,13 dan DV200 adalah 78,19%. Pustaka diurutkan pada instrumen Illumina HiSeq dengan pembacaan 2 × 150bp. Pembacaan mentah dipetakan seperti yang dijelaskan sebelumnya (Bearoff et al. 2023 ), menggunakan GRCm39 sebagai genom referensi dalam Salmon (Patro et al. 2017 ). Ekspresi diferensial dinilai melalui DESeq2 di R Studio (v.2023.06.2 + 561) dengan koreksi untuk pengujian hipotesis ganda dengan mengendalikan tingkat penemuan palsu. Gen yang meningkat atau menurun secara signifikan didefinisikan sebagai DE: padj < 0,05, log2FC ≤ −1 (menurun) atau > 1 (meningkat), baseMean > 10. Set gen DE dikirimkan ke g:Profiler g:GOSt dengan ambang batas 0,05 untuk analisis pengayaan. Diagram Venn dibuat melalui Venny (v.2.1) ( http://bioinfogp.cnb.csic.es/tools/venny/index.html ). Jaringan interaksi dibuat di Cytoscape (Shannon et al. 2003 ) menggunakan basis data protein–protein STRING (Szklarczyk et al. 2015 ). Peta pengayaan dibuat seperti yang dijelaskan sebelumnya (Reimand et al. 2019 ).
3 Desain Eksperimen dan Analisis Statistik
Hewan-hewan secara acak dimasukkan ke dalam kelompok yang tidak terluka atau kelompok SCI. Ukuran sampel ditentukan melalui penelitian sebelumnya dari lab kami menggunakan teknik yang serupa. Perbedaan terkait jenis kelamin dianalisis untuk setiap percobaan sebelum dikelompokkan bersama. Untuk percobaan validasi IHC, tikus Tmem119-Cre ERT2+/− ::R26tdTom fl/fl transgenik ganda yang tidak terluka ( N = 4 atau 5 per kelompok) digunakan. Analisis IBA1 melalui IHC dan western blot menggunakan Tmem119-Cre ERT2+/− (IKKβ +/+ N = 5 atau 8 yang tidak terluka; SCI-IKKβ +/+ N = 4 atau 9) atau Tmem119-Cre ERT2+/− :: tikus IKKβ fl/fl (SCI-IKKβ −/− N = 5 atau 8) dan baik post hoc Kruskal-Wallis dan Dunn (IHC) atau One-Way ANOVA dan post hoc Tukey (western blot) digunakan. Untuk percobaan RT-qPCR dan RNAseq, digunakan tikus Tmem119-Cre ERT2+/− (IKKβ +/+ yang tidak terluka N = 3; SCI-IKKβ +/+ N = 4) atau tikus Tmem119-Cre ERT2+/− :: IKKβ fl/fl (IKKβ −/− yang tidak terluka N = 3; SCI-IKKβ −/− N = 3). Data RT-qPCR dianalisis dengan uji-t tidak berpasangan dan uji-t Welch. Untuk percobaan terkait FACS, digunakan tikus Tmem119-Cre ERT2+/− ::R26tdTom fl/fl (IKKβ +/+ N = 9–10 yang tidak terluka; SCI-IKKβ +/+ N = 4–11) atau tikus Tmem119-Cre ERT2+/− ::R26tdTom fl/fl IKKβ fl/fl (IKKβ −/− N = 11–13 yang tidak terluka; SCI-IKKβ −/− N = 5 atau 8). Data FACS dianalisis dengan ANOVA Brown-Forsythe dan Welch serta post hoc Welch yang tidak berpasangan atau uji-t yang tidak berpasangan. Semua percobaan dilakukan secara buta terhadap kelompok genotipe. Untuk menentukan perbedaan antar kelompok, uji statistik yang tepat diterapkan berdasarkan asumsi normalitas dan deviasi standar. Nilai p < 0,05 dianggap signifikan. Semua uji statistik dilakukan menggunakan GraphPad Prism v.9.5.
4 Hasil
4.1 Sinyal Mikroglia IKKβ Berkontribusi pada Jumlah Mikroglia yang Diekspresikan di Sumsum Tulang Belakang Toraks 1 Minggu Pasca-SCI
Kami dan yang lain telah mengamati bahwa NF-κB meningkat di sumsum tulang belakang setelah SCI (Kigerl et al. 2009 ; Mironets et al. 2018 ; Bethea et al. 1998 ). Selain itu, mikroglia adalah komponen penting yang terlibat dalam pensinyalan yang dimediasi neuroimun dalam SSP dan menunjukkan aktivitas persisten selama beberapa minggu pasca-SCI (Brennan et al. 2022 ; Mironets et al. 2018 ; Xu et al. 2021 ). Kami berusaha memahami bagaimana aktivasi NF-κB melalui IKKβ dalam mikroglia membentuk respons mereka terhadap SCI. Untuk melakukan ini, kami memanfaatkan ekspresi Cre-rekombinase yang digerakkan oleh promotor Tmem119. Tmem119 sering digunakan sebagai penanda untuk mikroglia yang berada di SSP (Bennett et al. 2016 ; Kaiser and Feng 2019 ; Bohnert et al. 2020 ; Fang et al. 2023 ). Kami pertama-tama memvalidasi laju rekombinasi dan spesifisitas rekombinasi yang dimediasi Cre yang diinduksi tamoxifen dalam paradigma kami. Kami menemukan bahwa pemberian tamoxifen selama 5 hari berhasil menginduksi rekombinasi dalam ~92% mikroglia Iba1 + dan ekspresi mRNA IKKβ-null (Gambar S1 ). Kami selanjutnya memverifikasi bahwa penanda heterogenitas mikroglia (yaitu, CD86 dan CD68 untuk mikroglia M1; CD206 dan CD163 untuk mikroglia M2) tidak diubah oleh penghapusan IKKβ dalam mikroglia yang beristirahat di sumsum tulang belakang toraks yang tidak cedera (Gambar S2 dan S7 ).
Berdasarkan validasi ini, kami berusaha untuk menyelidiki apakah aktivitas IKKβ mikroglia memengaruhi mikroglia IBA1 + pasca-SCI. Kami melakukan imunostaining jaringan sumsum tulang belakang toraks dari tikus IKKβ +/+ yang tidak cedera dan tikus IKKβ +/+ atau IKKβ −/− 1 minggu setelah SCI T3 untuk IBA1. Kami mengamati lebih banyak mikroglia IBA1 + di sumsum tulang belakang toraks pada SCI-IKKβ +/+ dan SCI-IKKβ −/− dibandingkan pada hewan IKKβ +/+ yang tidak terluka (Gambar 2A–C ; H (2) =12,86, p < 0,0001; post hoc, Tmem119-IKKβ +/+ yang tidak terluka vs. SCI Tmem119-IKKβ +/+ p = 0,0028; vs. SCI Tmem119-IKKβ −/− p = 0,0410). Jumlah rata-rata mikroglia IBA1 + pada hewan SCI-IKKβ +/+ dan SCI-IKKβ −/− serupa. Temuan imunohistokimia ini diperkuat oleh analisis western blot jaringan toraks pada 1 minggu pasca-SCI. Kami menemukan cedera menginduksi peningkatan ekspresi protein IBA1 + di sumsum tulang belakang toraks dibandingkan dengan kontrol yang tidak cedera (Gambar 2D ; F (2,19) = 6,949, p = 0,0054; post hoc Tmem119-IKKβ +/+ yang tidak cedera vs. SCI Tmem119-IKKβ +/+ p = 0,0256; vs. SCI Tmem119-IKKβ −/− p = 0,0005). Tidak ada perbedaan antara kelompok SCI ketika IKKβ dihapus dari mikroglia Tmem119 + (Gambar 2D ). Temuan ini mengindikasikan bahwa penghapusan IKKβ di mikroglia tidak memiliki efek pada ekspresi IBA1 dibandingkan dengan SCI-IKKβ +/+ pada 1 wpi; namun, apakah sel-sel IBA1 + ini diubah secara fenotip oleh pensinyalan IKKβ mikroglia masih belum diketahui.

4.2 Penghapusan IKKβ pada Mikroglia Tidak Mempengaruhi Ekspresi Penanda Mikroglia mRNA M1 maupun M2 di Sumsum Tulang Belakang Thoracolumbar 1 Minggu Pasca-SCI
Dalam kondisi neuroinflamasi yang meningkat, termasuk setelah SCI, mikroglia menunjukkan peningkatan ekspresi penanda pro-inflamasi (“M1”) dibandingkan penanda anti-inflamasi (“M2”) (Kigerl et al. 2009 ; David dan Kroner 2011 ). Sejumlah penelitian yang menilai inflamasi lokal pada lokasi lesi menunjukkan mikroglia dengan cepat dan terus-menerus meningkatkan penanda M1 pro-inflamasi setelah cedera SSP dan berkontribusi terhadap inflamasi berkelanjutan dan cedera neurotoksik (Bellver-Landete et al. 2019 ; Kigerl et al. 2009 ; Xu et al. 2021 ; Fu et al. 2022 ). Di sisi lain, relatif sedikit penelitian yang meneliti perubahan fenotipe mikroglia dan ekspresi gen yang jauh dari lokasi lesi, tempat inflamasi memengaruhi sirkuit sumsum tulang belakang, termasuk yang memediasi refleks simpatis tulang belakang. Sementara NF-κB diketahui diaktifkan dengan cepat di mikroglia setelah SCI (Bethea et al. 1998 ; Mattson dan Meffert 2006 ), NF-κB juga dianggap sebagai komponen kunci yang terlibat dalam mendorong neuroinflamasi kronis persisten di sumsum tulang belakang (Liu et al. 2017 ; Xu et al. 2018 ; Lee et al. 2016 ; Gaojian et al. 2020 ). Oleh karena itu, kami berusaha untuk menentukan bagaimana penghapusan aktivator NF-κB IKKβ di mikroglia Tmem119 + memengaruhi keadaan polarisasi mikroglia di sumsum torakolumbal pada titik waktu yang berbeda pasca-SCI.
Meskipun diferensiasi ketat dari keadaan polarisasi ini masih dalam perdebatan, telah ditetapkan dengan baik bahwa CD86 dan CD68 adalah penanda mikroglia pro-inflamasi M1, dan CD163 dan CD206 adalah penanda anti-inflamasi M2 (Kigerl et al. 2009 ; Hu et al. 2012 ; Zhou et al. 2017 ; Kobayashi et al. 2013 ). Karena itu, kami menggunakan penanda ini dalam eksperimen RT-qPCR dan FACS untuk membedakan antara fenotipe M1 dan M2. Dengan menggunakan mRNA terisolasi dari jaringan sumsum tulang belakang torakolumbal pada 1 wpi, kami melakukan RT-qPCR untuk setiap faktor yang digambarkan dalam Gambar S3 . Kami tidak mengamati adanya perbedaan pada tingkat mRNA untuk penanda M1 vs. M2 sebagai rata-rata geometrik (yaitu, akar kuadrat dari rata-rata untuk setiap kelompok) (Vandesompele et al. 2002 ) (Gambar S3A ; t (4) = 0,3989, p = 0,7104) antara SCI-IKKβ +/+ dan SCI-IKKβ −/− . Selain itu, penghapusan genetik IKKβ mikroglia tidak memiliki efek pada ekspresi mRNA Iba1 (t (3,28) = 0,8376, p = 0,4589), Cd86 (t (5) = 1,653, p = 0,1592), Cd68 (t (5) = 0,3119, p = 0,7677), Cd206 (t (5) = 0,6037, p = 0,5724), atau Cd163 (t (4) = 0,8229, p = 0,4568) pada 1 minggu pasca-SCI (Gambar S3B–F ). Temuan ini menunjukkan bahwa pensinyalan IKKβ mikroglia tidak mengubah ekspresi mRNA dari penanda tertentu yang terkait dengan mikroglia M1 dan M2 di sumsum tulang belakang torakolumbal pada 1 wpi.
4.3 Sinyal NF-κB Mikroglia melalui IKKβ Mempengaruhi Aktivitas Transkripsi Terkait Imun di Tali Torakolumbalis pada 1 minggu pasca infeksi
Mikroglia terlibat secara kritis dalam mengatur respons imun dini setelah cedera, termasuk aktivitas transkripsi di sumsum tulang belakang pada 1 wpi (Brennan et al. 2022 ). Ditambah dengan temuan bahwa pensinyalan NF-κB mikroglia memengaruhi aktivitas transkripsi terkait peradangan di otak (Rocha et al. 2023 ), kami berusaha untuk menentukan bagaimana pensinyalan IKKβ mikroglia memengaruhi ekspresi gen di sumsum tulang belakang setelah SCI. Untuk menilai hal ini, kami mengisolasi RNA dari sumsum tulang belakang torakolumbalis, wilayah yang sesuai dengan sirkuit refleks simpatis tulang belakang, dari tikus yang terluka (1 wpi) atau tidak terluka dengan IKKβ utuh atau tersingkir untuk RNAseq massal.
Kami pertama kali melakukan analisis komponen utama (PCA) untuk penilaian kualitas data dan pendeteksian outlier (Gambar S4 ). Komponen utama pertama (PC1) mencakup 43% varians dan kemungkinan mengindikasikan kondisi cedera versus kondisi tidak cedera; komponen utama kedua (PC2) mencakup 18% varians dan sesuai dengan genotipe IKKβ +/+ versus IKKβ −/− . Kami menganalisis gen yang diekspresikan secara berbeda (DEG) di berbagai kelompok. Tidak ada DEG yang teridentifikasi antara kedua kelompok yang tidak cedera. Kami menemukan bahwa 105 gen diubah pada tikus SCI-IKKβ +/+ dibandingkan dengan tikus yang tidak cedera, dengan 77 gen mengalami peningkatan regulasi (73,3%) dan 28 gen mengalami penurunan regulasi (26,6%) (Gambar 3A dan S5A ; Data S2 ). Sebaliknya, tikus SCI-IKKβ −/− menunjukkan 250 DEG dibandingkan dengan tikus IKKβ −/− yang tidak terluka , yang sebagian besar mengalami peningkatan regulasi (208; 83,2%) versus penurunan regulasi (42; 16,8%) (Gambar 3A dan S5B ). Menariknya, hanya 6 DEG yang diidentifikasi antara kelompok SCI, dengan 5 peningkatan regulasi ( Ptgfr, Foxq1, Fcrls, Tmem254, Notch4 ) dan 1 penurunan regulasi ( Fndc1 ) pada tikus SCI-IKKβ −/− dibandingkan dengan tikus SCI-IKKβ +/+ (Gambar 3A,B dan S5C ). Lipatan perubahan log2 (FC) dari 25 DEG teratas dari setiap perbandingan berpasangan (SCI vs. IKKβ +/+ yang tidak cedera ; SCI vs. IKKβ −/− yang tidak cedera ) diplot untuk memvisualisasikan apakah perubahan dalam ekspresi gen ini memiliki tren yang sama antara kelompok (Gambar 3C ). Peta panas berkelompok hierarkis selanjutnya memvisualisasikan 50 DEG teratas untuk setiap perbandingan berpasangan (Gambar 3D–F ).
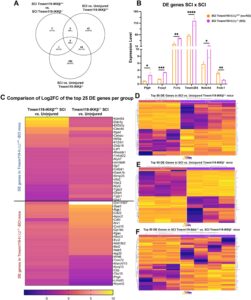
Untuk menggambarkan implikasi fungsional DEG dalam setiap kelompok, kami melakukan analisis pengayaan jalur biologis berdasarkan daftar DEG pada tikus SCI-IKKβ +/+ dan SCI-IKKβ −/− relatif terhadap kontrol yang tidak terluka (Gambar 4 , Data S3 ). Kami menentukan bahwa 12 jalur diperkaya pada kedua kelompok SCI dibandingkan dengan tikus yang tidak terluka. Hampir semua ini dikaitkan dengan aktivitas inflamasi yang berubah (Gambar 4A ; Tabel S5 ). Dibandingkan dengan kontrol yang tidak terluka, tikus SCI-IKKβ +/+ menunjukkan pengayaan untuk 8 jalur. Namun, 24 jalur yang diperkaya diidentifikasi pada tikus SCI-IKKβ −/− dibandingkan dengan kontrol yang tidak terluka (Gambar 4A ).
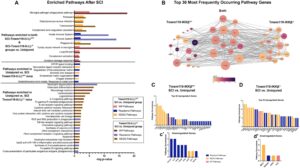
Selanjutnya kami menggunakan basis data interaksi protein STRING (Szklarczyk et al. 2015 ) untuk menghasilkan jaringan interaksi dari 30 gen yang paling sering muncul di jalur yang diperkaya per perbandingan. Dibandingkan dengan tikus SCI-IKKβ +/+ , gen yang diperkaya jalur pada tikus SCI-IKKβ −/− menunjukkan log2FC yang lebih rendah dan tingkat koneksi yang lebih tinggi antara DEG relatif terhadap kontrol yang tidak terluka (Gambar 4B ). Dalam jalur yang diperkaya ini, gen yang paling sering muncul dan teregulasi naik pada tikus SCI-IKKβ +/+ adalah gen C1q ( C1qa, C1qb, C1qc ), C3ar1 , dan Itgb2 —yang semuanya terkait dengan aktivitas makrofag/mikroglia (Gambar 4C ). Pada tikus SCI-IKKβ −/− , gen yang sering muncul dalam jalur yang diperkaya dikaitkan dengan makrofag/mikroglia ( Itgam, Itgb2, Fcgr1 ) dan neutrofil ( Rac2, Ncf1 ) (Gambar 4D ). Selain itu, tikus SCI-IKKβ −/− memiliki lebih sedikit gen yang mengalami penurunan regulasi yang dikaitkan dengan jalur yang diperkaya ( n = 4; Gambar 4d ‘ ) daripada tikus SCI-IKKβ +/+ ( n = 8; Gambar 4c ‘ ) relatif terhadap kontrol genotipe yang tidak cedera. Perbedaan dalam pengayaan jalur ini menyoroti potensi efek biologis dari perubahan dalam transkriptom sumsum tulang belakang pada 1 wpi sebagai respons terhadap pensinyalan IKKβ mikroglia.
4.4 Penghapusan IKKβ Mikroglia Mempengaruhi Pengayaan Aktivitas Transkripsi NF-κB Kanonik Dibandingkan Non-Kanonik di Tali Torakolumbalis pada 1 wpi
Bahasa Indonesia : Untuk lebih jauh memperluas temuan kami dengan set gen lengkap yang terkait dengan pengayaan jalur biologis (Gambar 4 ), kami selanjutnya berusaha untuk memeriksa bagaimana set gen yang diatur naik vs. yang diatur turun memperkaya proses biologis ketika IKKβ mikroglia dihapus setelah SCI (Gambar 5 ). Kami menemukan bahwa lebih banyak proses diperkaya pada tikus SCI-IKKβ +/+ dibandingkan dengan tikus SCI-IKKβ −/− (Gambar 5 dan 6 ), yang sesuai dengan kuantitas DEG yang lebih tinggi pada tikus SCI-IKKβ −/− (Gambar 3A ). Menariknya, kami menemukan bahwa salah satu perbedaan utama antara kelompok adalah pengayaan NF-κB kanonik vs. non-kanonik. Sementara kedua kelompok menunjukkan pengayaan untuk respons imun dan inflamasi berdasarkan set gen yang diatur ke atas (Gambar 6B ), ada pengayaan untuk pensinyalan NF-κB kanonik ketika pensinyalan IKKβ mikroglia utuh setelah SCI (yaitu, tikus SCI-IKKβ +/+ relatif terhadap kontrol yang tidak terluka; Gambar 5A dan 6B ; Data S4 ). Menariknya, tikus SCI-IKKβ −/− menunjukkan pengayaan untuk pensinyalan NF-κB non-kanonik, tetapi bukan NF-κB kanonik (Gambar 5B ; Data S4 ). Ini selaras dengan paradigma knockout kami, karena IKKβ dikaitkan dengan pensinyalan NF-κB kanonik. Selain itu, tikus SCI-IKKβ −/− menunjukkan pengayaan proses biologis yang meningkat terkait dengan pensinyalan imun adaptif (misalnya, aktivitas IL-1, sel B, dan sel mast, pertahanan terhadap agen asing; Gambar 5B dan 6B ) relatif terhadap kontrol yang tidak terluka. Berdasarkan set gen yang menurun regulasinya, kedua kelompok menunjukkan pengayaan untuk proses biologis yang menurun regulasinya terkait dengan organisasi ekstraseluler; namun, penurunan regulasi proses yang terkait dengan perkembangan otot secara khusus diperkaya pada tikus SCI-IKKβ −/− (Gambar 6C ). Penghapusan IKKβ mikroglia juga memengaruhi penurunan regulasi gen yang terkait dengan pertahanan imun, karena tikus SCI-IKKβ +/+ menunjukkan pengayaan spesifik untuk pertahanan yang menurun regulasinya terhadap protozoa (Gambar 6C ), berbeda dengan peningkatan regulasi gen terkait pertahanan yang diamati pada tikus SCI-IKKβ −/− (Gambar 5B dan 6B ). Secara keseluruhan, temuan ini menunjukkan bahwa penghapusan IKKβ pada mikroglia menggeser sinyal NF-κB ke arah keadaan non-kanonik, yang berkontribusi pada peningkatan regulasi gen yang terlibat dalam aktivitas respons imun adaptif dan penurunan regulasi perkembangan otot setelah SCI. Implikasi fisiologis dari temuan ini akan dinilai lebih lanjut dalam penelitian mendatang.


4.5 Penghapusan IKKβ pada Mikroglia Mengurangi Polarisasi Mikroglia M1 Tulang Belakang pada 4 Minggu, tetapi Tidak 1 Minggu Pasca-SCI
Bahasa Indonesia: Untuk menilai lebih jauh ekspresi penanda yang menunjukkan polarisasi mikroglia, kami mengisolasi sel dari sumsum tulang belakang torakolumbalis (~T2-L1) untuk analisis flow cytometry menggunakan strategi gating yang diuraikan dalam Gambar S6 . Sel CD45 + CD11b + singlet hidup yang mengekspresikan tdTom + di bawah promotor Tmem119 dianalisis untuk penanda CD86 untuk M1 dan CD206 untuk M2 (Jurga et al. 2020 ) untuk mendapatkan gambaran keadaan polarisasi (Gambar S6F ). Pada 1 wpi, kami tidak mengamati perbedaan dalam persentase mikroglia CD45 + CD11b + TdTom + yang juga CD86 + CD206 − (penanda M1; Gambar 7A ; t(9.586) = 0.9252, p = 0.3776); CD86 − CD206 + (penanda M2; Gambar 7B ; t (14) = 1,076, p = 0,3001); atau CD86 + CD206 + (intermediet; Gambar 7C ; t (14) = 0,9223, p = 0,3720) pada tikus SCI-IKKβ +/+ dibandingkan dengan tikus SCI-IKKβ −/− . Hal ini menunjukkan bahwa pensinyalan NF-κB mikroglia tidak memengaruhi polarisasi mikroglia pada 1 wpi.
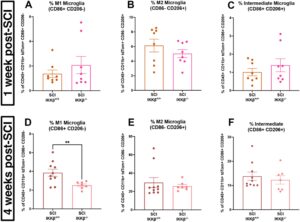
Sebaliknya, pada 4 wpi, persentase total mikroglia yang merupakan mikroglia CD86 + CD206 − M1 secara signifikan lebih rendah pada tikus SCI-IKKβ −/− dibandingkan dengan kontrol SCI-IKKβ +/+ (Gambar 7D ; t(11.55) = 3.302, p = 0.0066). Tidak ada perbedaan dalam proporsi mikroglia yang merupakan CD86 − CD206 + (M2; Gambar 7E ; U (82,71) = 27, p = 0.4598) maupun CD86 + CD206 + (intermediet; Gambar 7f ; U (96,57) = 29, p = 0.5834) antara kelompok SCI pada 4 wpi. Hal ini menunjukkan penghambatan sinyal IKKβ mikroglia mengurangi peningkatan yang disebabkan oleh cedera pada mikroglia M1 pro-inflamasi, tetapi tidak pada aktivitas mikroglia M2 anti-inflamasi maupun mikroglia intermediet, antara 1 dan 4 minggu pasca-SCI.
4.6 Deplesi Splenosit Akibat Cedera Ditemukan Setelah Cedera pada 1 dan 4 Minggu Pasca-SCI Dibandingkan dengan Kelompok Kontrol yang Tidak Cedera
Penelitian sebelumnya dari lab kami menunjukkan bahwa peningkatan kadar faktor neuroimun, seperti TNFα terlarut, dalam SSP setelah SCI memengaruhi regulasi simpatik untuk berkontribusi pada perubahan profil imun perifer dalam limpa dan disfungsi imun (Mironets et al. 2018 ; Mironets et al. 2020 ). Kami menilai apakah pensinyalan IKKβ mikroglia sentral setelah SCI memengaruhi sel imun perifer menggunakan flow cytometry splenosit (Gambar S8 ) dari hewan dengan IKKβ utuh atau tersingkir dalam mikroglia 1 atau 4 minggu setelah SCI. Kami juga mengkarakterisasi splenosit dari hewan yang tidak terluka dengan IKKβ utuh atau terhapus dalam mikroglia. Khususnya, tidak ada perbedaan signifikan antara kelompok hewan yang tidak terluka dalam pengukuran terkait limpa apa pun (Gambar S9 ); dengan demikian, penghapusan IKKβ mikroglia tidak mengubah berat limpa maupun populasi splenosit dalam kontrol yang tidak terluka. Menariknya, kami mengamati ekspresi reporter tdTomato di limpa pada sebagian kecil splenosit (< 10%; Gambar S11 ), termasuk sel-B CD45R + limpa dan makrofag CD68 + . Apakah penghapusan IKKβ juga terjadi pada sel-sel ini merupakan hal yang perlu dipertimbangkan dan berpotensi membingungkan temuan kami.
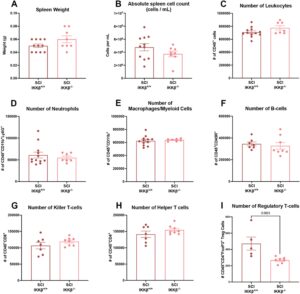
Sejumlah metrik untuk menilai atrofi limpa telah digunakan dalam paradigma SCI, termasuk menganalisis berat limpa, panjang, jumlah splenosit, dan rasio berat limpa terhadap massa tubuh (Guo et al. 2022 ; Brommer et al. 2016 ; Mironets et al. 2020 ; Ueno et al. 2016 ; Ulndreaj et al. 2020 ; Zhang et al. 2013b ). Untuk menilai atrofi limpa secara komprehensif dalam paradigma kami, kami menyertakan masing-masing ukuran ini untuk analisis. Mirip dengan penelitian ini, jumlah keseluruhan splenosit berkurang secara signifikan setelah SCI pada 1 wpi (Gambar 8A ; F (3,24.94) = 10.16, p < 0.0001; post hoc Tmem119-IKKβ +/+ yang tidak cedera vs. SCI Tmem119-IKKβ +/+ p = 0.003; Tmem119-IKKβ +/+ yang tidak cedera vs. SCI Tmem119-IKKβ −/− p = 0.0359; SCI Tmem119-IKKβ +/+ vs. Tmem119-IKKβ −/− p = 0.0002) dan 4 wpi dibandingkan dengan kontrol yang tidak cedera (Gambar 8F ; F (3,34.5) = 9.416, p < 0,0001; post hoc Tmem119-IKKβ +/+ yang tidak cedera vs. SCI Tmem119-IKKβ +/+ p = 0,0028; Tmem119-IKKβ +/+ yang tidak cedera vs. SCI Tmem119-IKKβ −/− p = 0,0002; SCI Tmem119-IKKβ +/+ vs. Tmem119-IKKβ −/− p = 0,0099; Tmem119-IKKβ −/− yang tidak cedera vs. SCI Tmem119-IKKβ −/− p = 0,0004). Menariknya, penghapusan IKKβ dalam mikroglia secara signifikan meningkatkan kuantitas splenosit dibandingkan dengan tikus SCI-IKKβ +/+ pada 1 wpi (Gambar 8B ; SCI Tmem119-IKKβ +/+ vs. SCI Tmem119-IKKβ −/− t (6)= 4,066, p = 0,0066) tetapi tidak pada 4 wpi (Gambar 8G ). Tidak ada perbedaan dalam berat limpa mentah, panjang, maupun berat normal dibandingkan dengan massa tubuh yang diamati antara kelompok pada kedua titik waktu pasca-SCI (Gambar 8C–E,H–J ).

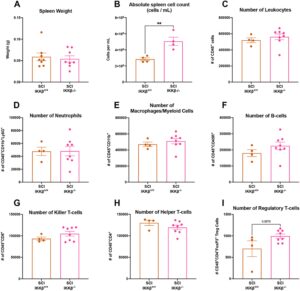
4.7 Penghapusan IKKβ pada Mikroglia Meningkatkan Jumlah Splenosit Tanpa Efek yang Terlihat pada Populasi Splenosit pada 1 dan 4 Minggu Pasca SCI
Pada 1 wpi, tidak ada perbedaan dalam berat limpa keseluruhan antara kelompok SCI (Gambar 9A ). Namun, penghapusan IKKβ pada mikroglia Tmem119 + mengakibatkan peningkatan yang signifikan dalam jumlah splenosit dibandingkan dengan tikus SCI-IKKβ +/+ (Gambar 9B ; t (6) = 4,066, p = 0,0066). Kami tidak mengamati perbedaan yang signifikan dalam jumlah total leukosit CD45 + , maupun jumlah leukosit yang merupakan neutrofil CD11b + Ly6G + , makrofag/sel myeloid CD11b + , sel B CD45R + , sel T pembunuh CD8 + , atau sel T pembantu CD4 + antara hewan dengan IKKβ mikroglia atau dengan IKKβ yang tersingkir (Gambar 9C–I ). Meskipun tidak berbeda secara signifikan, sel-T regulator CD4 + FoxP3 + cenderung lebih tinggi pada tikus SCI-IKKβ −/− dibandingkan dengan SCI-IKKβ +/+ pada 1 wpi (Gambar 9I ; t (10) = 2,047, p = 0,0679). Pada 4 wpi, tidak ada perbedaan signifikan antara kelompok SCI dalam semua ukuran limpa maupun populasi splenosit yang diprofilkan (Gambar 10A–I ). Menariknya, sel-T regulator CD4 + FoxP3 + cenderung lebih rendah pada tikus SCI-IKKβ −/− dibandingkan dengan SCI-IKKβ +/+ pada 4 wpi (Gambar 10I ; t(4,259) = 2,510, p = 0,0623).