ABSTRAK
Fotosimbiosis, hubungan simbiosis antara mikroalga dan eukariota non-fotosintetik, ditemukan secara sporadis di banyak garis keturunan eukariotik. Hanya beberapa taksa, seperti cnidaria dan ciliata yang menjadi inang endosimbion alga, telah dipelajari secara aktif, yang telah menghambat pemahaman mekanisme universal pembentukan fotosimbiosis. Pada Amoebozoa, beberapa spesies dilaporkan sebagai fotosimbiosis, dan bagaimana fotosimbiosis terbentuk masih belum jelas. Untuk menyelidiki sejauh mana salah satu amuba fotosimbiosis, Mayorella viridis , bergantung pada simbionnya, amuba tersebut diperlakukan dengan reagen yang diketahui dapat menginduksi runtuhnya fotosimbiosis pada spesies lain. Kami berhasil menghilangkan simbion alga dari inangnya dengan 2-amino-3-kloro-1,4-naftokuinon. Sementara ameba apo-simbiosis tumbuh pada tingkat yang sama dengan keadaan simbiosis ketika mereka memakan mangsa, tingkat kelangsungan hidup mereka lebih rendah daripada tingkat kelangsungan hidup ameba simbiosis selama kelaparan, yang menunjukkan bahwa dampak fotosimbiosis pada kebugaran bergantung pada kondisi. Lebih jauh, kami menunjukkan bahwa keadaan fotosimbiosis dapat dibalikkan dengan memberi makan dua galur alga hijau Chlorella kepada ameba apo-simbiosis. Efisiensi menelan sel alga berbeda secara signifikan antara galur alga. Hasil ini menunjukkan bahwa hubungan fotosimbiosis pada ameba bersifat fakultatif dan bahwa galur alga yang berbeda memiliki kemampuan simbiosis yang berbeda terhadap ameba.
1 Pendahuluan
Fotosintesis akuatik oleh alga dan prokariota fotosintetik bertanggung jawab atas sekitar setengah dari produksi bersih di bumi (Field et al. 1998 ). Beberapa mikroalga, sebagai endosimbion, dapat membentuk hubungan simbiosis dengan eukariota non-fotosintetik sebagai inangnya, yang di sini kita sebut fotosimbiosis. Fotosimbiosis telah dilaporkan dari berbagai lingkungan akuatik dan terestrial. Misalnya, karang, anemon laut, dan cnidaria lain yang termasuk dalam Opisthokonta diketahui memiliki hubungan fotosimbiosis dengan beberapa mikroalga, termasuk dinoflagellata dan alga hijau (Davy et al. 2012 ). Fotosimbiosis antara ciliata dan Chlorella juga telah dipelajari dengan baik (Fujishima dan Kodama 2012 ). Beberapa spesies foraminifera, yang merupakan anggota Rhizaria, memiliki hubungan fotosimbiosis dengan beberapa garis keturunan simbion alga, seperti dinoflagellata, alga merah, dan diatom (Johnson 2011 ; Dorrell dan Howe 2012 ).
Mekanisme fotosimbiosis dipelajari dari perspektif molekuler, fisiologis, dan ekologi, khususnya pada cnidaria dan ciliata (Davy et al. 2012 ; Fujishima dan Kodama 2012 ). Yang penting, para peneliti dapat secara artifisial “memutihkan” atau menginduksi keadaan apo-simbiosis, di mana semua simbion alga dikeluarkan dari tubuh inangnya. Mengembangkan metode pemutihan yang andal pada organisme tersebut merupakan prasyarat untuk studi inang-simbion yang komprehensif. Ada beberapa laporan tentang metode pemutihan buatan sejauh ini (Belda-Baillie et al. 2002 ; Mihirogi et al. 2023 ). Misalnya, model anemon laut Aiptasia ( Exaiptasia diaphana ) dapat diputihkan dengan paparan suhu tinggi 35°C selama 20 hari (Belda-Baillie et al. 2002 ) atau lebih mudah dengan mengobatinya menggunakan herbisida 2-amino-3-kloro-1,4-naftokuinon (ACN), yang juga dikenal sebagai quinoclamine (Mihirogi et al. 2023 ). Hydra hijau, juga termasuk Cnidaria dan memiliki endosimbion alga hijau, dapat diputihkan juga dengan mengobatinya menggunakan gliserol (Whitney 1907 ). Demikian pula, beberapa metode induksi pemutihan telah dikembangkan untuk ciliata. Paramecium bursaria , yang secara intraseluler memiliki endosimbion Chlorella , dapat diputihkan dengan pengobatan dengan paraquat selama 5 hari (Hosoya et al. 1995 ). Ada laporan bahwa sikloheksimid dan 3-(3,4-diklorofenil)-1,1-dimetilurea (DCMU) juga efektif dalam memutihkan P. bursaria (Kodama dan Fujishima 2008 ; Reisser 1976 ). Dengan menggunakan teknik pemutihan ini, kita dapat membandingkan dan menganalisis respons ketika inang dan simbion berada dalam keadaan simbiosis atau keadaan apo-simbiotik. Dalam kasus anemon laut E. diaphana , perubahan metabolisme inang sebagai respons terhadap simbion dapat dipelajari dengan membandingkan transkriptom keadaan simbiosis dengan keadaan apo-simbiotik (Lehnert et al. 2014 ; Ishii et al. 2019 ). Studi serupa telah dilakukan pada hydra hijau dan P. bursaria (Kodama et al. 2014 ; Ishikawa et al. 2016 ; He et al. 2019 ).
Spesies eukariotik yang memiliki fotosimbion telah ditemukan secara sporadis dalam taksa yang secara filogenetik jauh, seperti Opisthokonta dan Alveolata (Dorrell dan Howe 2012 ), dan sejumlah spesies model yang terbatas telah dipelajari. Dengan demikian, masih belum jelas apakah fitur seluler atau molekuler yang ditemukan pada beberapa organisme fotosimbiosis bersifat universal atau spesifik garis keturunan. Amoebozoa memiliki perilaku predator yang cocok untuk mengamati proses fagositosis, yang telah dikenal sebagai langkah pertama dan kunci dari pembentukan fotosimbiosis (Davy et al. 2012 ). Di antara mereka, hanya beberapa spesies ( Mayorella viridis , Parachaos zoochlorellae dan Hyalosphenia papilio ) yang ditemukan sebagai organisme fotosimbiosis, dan sedikit penelitian telah dilakukan pada pembentukan fotosimbiosis mereka pada tingkat molekuler dan seluler (Willumsen et al. 1987 ; Weiner et al. 2022 ). Hal ini menghambat pemahaman mengenai pentingnya proses fagositosis dalam fotosimbiosis, dan penting untuk membangun sistem ideal di mana kita dapat membandingkan proses predator dan proses simbiosis.
M. viridis merupakan anggota Amoebozoa di air tawar dan secara intraseluler memiliki endosimbion mikroalga dari alga hijau spesies Chlorella (Cann 1981 ). Karena sel amoeba bersifat adhesif dan pergerakannya lebih lambat daripada beberapa protista fotosimbiosis lainnya, seperti ciliata P. bursaria , maka relatif mudah untuk mengamati simbion alga di dalam sel inang amoeba di bawah mikroskop. Dengan memanfaatkan spesies ini, di sini kami menunjukkan bahwa kami telah mengembangkan metode pemutihan untuk amoeba dan membuat perbandingan kuantitatif antara berbagai galur Chlorella .
2 Bahan dan Metode
2.1 Pembudidayaan Sel
Galur M. viridis NS-1 dikumpulkan dari daerah rawa air tawar di prefektur Tochigi (37°06′42.2″ N 139°56′07.9″ E) dan kemudian satu sel diisolasi dan dikulturkan oleh Toshinobu Suzaki, Universitas Kobe. Kultur dipelihara dan dikembangkan dalam 8 mL air mineral steril “OISHIIMIZU ROKKO” (selanjutnya disebut RW; Asahi Soft Drinks Co. Ltd., Jepang) dalam Labu Kultivasi Sel (Tutup Ventilasi) 25 cm 2 (VTC-F25V, AS ONE CORPORATION, Jepang). Cahaya dan suhu kultur masing-masing adalah 8 μmol s −1 m −2 cahaya konstan dan 20°C. Media dalam labu diganti setiap 2 atau 3 minggu atau ketika dasar labu menjadi kotor. Pertama, medium dibuang dan 8 mL RW segar ditambahkan lagi. Labu dibilas perlahan dengan medium yang ditambahkan, medium dibuang lagi, dan 8 mL RW segar ditambahkan. Kemudian, dasar labu diketuk 20 kali untuk menangguhkan sel-sel ameba, dan segera medium kultur dipindahkan ke dalam labu kultur baru.
Cryptomonas paramaecium (nama galur NIES-715, disediakan oleh National Institute for Environmental Studies, Jepang) digunakan sebagai mangsa untuk M. viridis . C. paramaecium dipelihara dalam medium CYT 100 mL ( https://mcc.nies.go.jp/medium/ja/cyt.pdf ) dalam Cell Cultivation Flask (Vent Cap) 75 cm2 ( VTC-F75V, AS ONE CORPORATION, Jepang). Cahaya dan suhu kultur masing-masing sekitar 40 μmol s −1 m −2 12 L:12D dan 20°C. Untuk satu labu kultur M. viridis , 10 mL kultur C. paramaecium digunakan. Kultur disentrifugasi pada 1000 × g selama 10 menit dan supernatan dibuang. Sepuluh mililiter RW yang telah disterilkan ditambahkan ke dalam pelet dan pelet disuspensikan dengan pipet. Suspensi disentrifugasi pada 1000 × g selama 10 menit lagi dan supernatan dibuang. Terakhir, 1 mL RW yang telah disterilkan ditambahkan ke dalam pelet untuk disuspensikan kembali dengan pipet, dan ditambahkan ke setiap tabung kultur M. viridis .
Dua strain Chlorella (strain NIG-A dan NIG-B, di sini disebut “A” dan “B”, masing-masing) diisolasi dari kultur M. viridis asli dan ditumbuhkan dalam medium AF-6 20 mL dalam Labu Kultivasi Sel (Tutup Ventilasi) 25 cm 2 (VTC-F25V, AS ONE CORPORATION, Jepang) pada suhu 20°C di bawah sekitar 37 μmol s −1 m −2 12L:12D.
2.2 Penyaringan Reagen Pemutih
Labu kultur M. viridis disadap 20 kali untuk menangguhkan sel-sel amuba, dan 1 mL suspensi sel ditambahkan ke setiap lima sumur acak dari pelat 48 sumur (VTC-P48, AS ONE CORPORATION, Jepang). Untuk menguji reagen pemutihan, masing-masing 1 μL etanol 70%, RW yang disterilkan, larutan ACN 5 mM (FUJIFILM WAKO Pure Chemical Corporation, Jepang) dalam etanol 70% (konsentrasi akhir: 5 μM), dan larutan DCMU 5 atau 50 mM (FUJIFILM WAKO Pure Chemical Corporation, Jepang) dalam etanol 70% (akhir masing-masing 5 atau 50 μM) ditambahkan ke setiap sumur. Pelat dipertahankan pada suhu 20°C di bawah cahaya konstan 8 μmol s −1 m −2 selama 1 minggu. Percobaan diulang tiga kali.
Sel-sel ameba di bagian bawah pelat disuspensikan dengan pipet, dan suspensi sel 50 μL diambil dari sumur dan diteteskan ke slide kaca (S1214, Matsunami Glass Ind. Ltd., Jepang). Manipulasi ini diulang sampai sel ameba ditemukan di tetesan di bawah pengamatan mikroskopi brightfield 20x (OLYMPUS CKX53, LCAch N). Setelah mengonfirmasi ameba berada di tetesan, kaca penutup 18 × 18 mm (C218181, Matsunami Glass Ind. Ltd., Jepang) diterapkan. Media berlebih dihilangkan dengan Kimwipes (Nippon Paper Cresia, Jepang) sampai sel-sel ameba yang diinginkan menyentuh slide kaca dan kaca penutup dan berhenti bergerak. Kemudian, gambar brightfield dan autofluoresensi (CANON DS126761, unit cermin OLYMPUS CKX53 Blue Excitation) dari sel-sel tersebut diperoleh. Sampel sumur di mana sel amuba hilang selama operasi pengamatan tidak digunakan untuk analisis lebih lanjut.
2.3 Persiapan Kultur M. viridis yang Diputihkan
Delapan mililiter kultur M. viridis diperlakukan dengan 8 μL larutan ACN 1 mg/mL dalam etanol 70% dan diinkubasi pada suhu 20°C di bawah 8 μmol s −1 m −2 cahaya konstan selama 1 minggu. Setelah perlakuan, medium kultur dibuang, dan 8 mL RW steril segar ditambahkan ke kultur untuk mencuci sel. Manipulasi ini diulang dua kali. Sel M. viridis yang telah dicuci dan diputihkan disimpan pada suhu 20°C di bawah kegelapan konstan untuk membuatnya dalam keadaan apo-simbiosis. Metode pemberian makan dan penggantian medium sama dengan sel M. viridis dalam keadaan simbiosis.
2.4 Pengukuran Pertumbuhan M. viridis
Enam mililiter RW yang disterilkan dipindahkan ke dalam satu sumur dari pelat 6 sumur, dan kemudian 8 mL RW yang disterilkan ditambahkan ke masing-masing dari empat sumur pelat lainnya. Saringan sel 40 μm (VCS-40, AS ONE Corporation, Jepang) ditempatkan pada sumur pertama, yang berisi 6 mL RW yang disterilkan, dan kemudian 2 mL kultur M. viridis , yang mengandung M. viridis dalam keadaan simbiosis atau apo-simbiosis, ditambahkan ke saringan sel. Untuk mencuci sel-sel M. viridis , saringan sel yang berisi sel-sel M. viridis dipindahkan ke dalam empat sumur lainnya dengan RW segar secara berurutan. Setelah itu, saringan sel ditempatkan terbalik pada sumur yang kosong, dan kemudian 3 mL RW yang disterilkan ditambahkan ke saringan untuk menjatuhkan sel-sel M. viridis ke dalam sumur. Amuba yang telah dicuci (lima sel per sumur) dipindahkan ke dalam 100 μL RW yang disterilkan atau RW yang disterilkan yang berisi sel-sel C. paramaecium yang telah dicuci dengan kepadatan 2 × 106 sel/ml dalam pelat dasar kaca 96 sumur dengan dasar datar (GP96000, MATSUNAMI GLASS IND., LTD., Jepang). Pelat 96 sumur yang berisi sel-sel M. viridis dipertahankan pada suhu 20°C di bawah 8 μmol s −1 m −2 12L:12D. Setelah mengetuk pelat untuk menenggelamkan sel-sel amuba ke dasar pelat, jumlah amuba di setiap sumur dihitung di bawah mikroskopi medan terang 20x (OLYMPUS CKX53, LCAch N) pada setiap titik waktu. Amuba dalam keadaan simbiosis dan apo-simbiosis digunakan untuk pengukuran ini ( n = 5). Perbedaan jumlah sel M. viridis diuji dengan uji-t Welch dengan R (versi 4.3.1, Tim Inti R 2023 ).
2.5 Kuantifikasi Jumlah Sel Chlorella yang Dikonsumsi oleh M. viridis
Sel-sel M. viridis yang diputihkan dicuci dengan cara yang sama seperti pengukuran pertumbuhan M. viridis . Satu mililiter RW steril yang berisi sel-sel M. viridis yang telah dicuci dan diputihkan dipindahkan ke dalam sumur pelat 24 sumur. 0,6 mL kultur Chlorella yang dicuci dengan RW steril, baik strain A atau B, ditambahkan ke dalam sumur yang berisi kultur M. viridis yang telah dicuci pada kepadatan Chlorella akhir 1,0 × 107 sel/mL. Amuba dikultur bersama dengan Chlorella selama 24 jam pada suhu 20°C dalam kondisi gelap. Setelah dikultur bersama, sel-sel amuba diamati menggunakan metode yang sama seperti penyaringan untuk reagen pemutihan. Daerah yang diinginkan dibuat dengan mengelilingi sel-sel amuba dalam gambar medan terang dengan pilihan Poligon di Fiji (Schindelin et al. 2012 ). Citra fluoresensi dibinerisasi dengan alat thresholding di Fiji (ambang batas bawah 50, ambang batas atas 255) dan kemudian diproses dengan alat watershed di Fiji. Jumlah sel alga dalam citra yang diproses dihitung menggunakan alat analyze particle di Fiji (Ukuran partikel target 100-tak terhingga, sirkularitas 0,00–1,00). Perbedaan jumlah sel Chlorella dalam sel amoeba diuji dengan uji Steel-Dwass dengan R (versi 4.3.1, R Core Team 2023 ).
2.6 Evaluasi Kapasitas Retensi Sel Chlorella oleh M. viridis
Sel M. viridis yang telah diputihkan dikultur bersama dengan atau tanpa Chlorella selama 24 jam menggunakan metode yang sama seperti yang dijelaskan di atas. Setelah dikultur bersama, sel amuba dicuci dengan RW yang telah disterilkan dan dipindahkan ke dalam 3 mL RW steril segar di dalam sumur pelat 6 sumur. Kemudian, pelat 6 sumur dipertahankan selama 1 minggu pada suhu 20°C di bawah 8 μmol s −1 m −2 12 L:12D. Setelah 1 minggu dikultur, jumlah sel Chlorella di dalam sel M. viridis dihitung dengan mengikuti metode yang sama seperti yang dijelaskan di atas.
2.7 Analisis Filogenetik Strain NIG-A dan B
Urutan parsial subunit kecil (SSU) dan spacer transkripsi internal (ITS) DNA ribosom (rDNA) yang digunakan untuk analisis filogenetik Chlorellaceae diperoleh dari penelitian sebelumnya (Luo et al. 2010 ). Selain itu, amplifikasi PCR dari SSU dan ITS dari strain A dan B dilakukan dengan primer berikut: primer set1, SR1_inf 5′-AGGTCGACTCTAGAGTACCTGGTTGATCCTGCCAG-3 ′ dan SR12cF_inf_rev 5′-TTACGACTTCTCCTTCCTCTACTCTAGAGTCGACCT-3 ′ (dimodifikasi Nakayama et al. 1996 ), dan primer set2, SR12cF_inf 5′-AGGTCGACTCTAGAGTAGAGGAAGGAGAAGTCGTAA-3 dan 25F1R_inf 5′-CGGTACCCGGGGATCATATGCTTAAATTCAGCGG-3 ′ (dimodifikasi Takano dan Horiguchi 2006 ). Semua sekuens diselaraskan menggunakan MAFFT (ver. 7.487) dengan opsi -linsi dan -adjustdirection (Katoh dan Standley 2013 ). File keluaran penyelarasan dipangkas menggunakan TrimAl (ver. 1.4.1) dengan opsi -gt 0.8 (Capella-Gutiérrez et al. 2009 ). Pohon filogenetik dibuat dengan file penyelarasan yang dipangkas menggunakan IQ-TREE (ver. 1.6.12) dengan opsi -alrt 1000 dan -bb 1000, yang menentukan 1000 replikasi untuk uji rasio kemungkinan perkiraan mirip SH (SH-aLRT) dan analisis bootstrap sangat cepat (UFBoot) (Nguyen et al. 2015 ; Kalyaanamoorthy et al. 2017 ).
2.8 Analisis Filogenetik NS-1
Urutan parsial 18S rDNA diperoleh melalui amplifikasi PCR dengan primer berikut: Ami6F1 5′-CCAGTCCCAATAGCGTATATT-3′ dan Ami9R 5′-GTTGAGTCGAATTAAGCCGC-3′ (Thomas et al. 2006 ). Informasi mengenai unit taksonomi operasional (OTU) yang digunakan untuk analisis filogenetik diperoleh dengan merujuk pada penelitian sebelumnya (Lei et al. 2023 ). Pemrosesan urutan dan konstruksi pohon filogenetik dilakukan dengan menggunakan metode yang sama seperti analisis filogenetik alga. Urutan yang dilaporkan dalam penelitian ini telah disimpan dalam basis data ENA dengan nomor akses BioProject PRJEB86908.
3 Hasil
3.1 Analisis Filogenetik M. viridis Strain NS-1
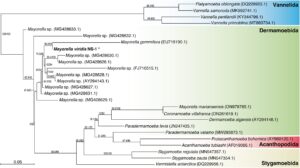
Kami melakukan analisis filogenetik strain M. viridis NS-1 menggunakan urutan parsial 18S rDNA dan mengonfirmasi bahwa NS-1 ditempatkan dalam genus Mayorella (Gambar 1 ). Posisi filogenetik dan karakteristik morfologi (Cann 1981 ) mendukung bahwa strain ini diidentifikasi sebagai M. viridis .
3.2 ACN Menyebabkan Pemutihan Sel M. viridis
Untuk menguji efek reagen pemutihan potensial, kami mengonfirmasi keberadaan atau ketiadaan sel simbion alga di dalam sel amuba (yaitu, keadaan simbiotik atau apo-simbiosis) dengan mengamati autofluoresensi klorofil simbion ketika mereka diperlakukan dengan penghambat fotosintesis DCMU dan herbisida, ACN (Gambar 2A ). Fluoresensi klorofil yang berasal dari alga simbiotik diamati pada inang amuba setelah 1 minggu pengobatan pada kelompok kontrol dengan air mineral RW dan etanol 70%, dan sel yang diobati dengan DCMU. Di sisi lain, tidak ada fluoresensi klorofil yang diamati pada sel M. viridis yang diobati dengan ACN selama 1 minggu (Gambar 2A ). Tidak ada kelainan pada bentuk sel yang diamati pada sel amuba yang diobati dengan ACN yang diputihkan yang telah diobati setelah pengobatan ACN dan pencucian dengan RW (Gambar 2B ). Hasil ini menunjukkan bahwa pengobatan ACN dapat menginduksi pemutihan sel M. viridis .
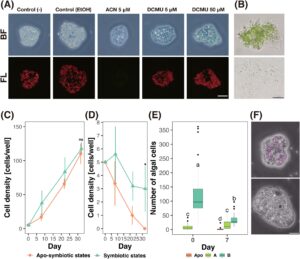
3.3 M. viridis Dapat Tumbuh dalam Keadaan Simbiotik dan Apo-Simbiosis
Untuk memverifikasi apakah dan bagaimana keadaan simbiosis dapat mempengaruhi pertumbuhan dan kelangsungan hidup sel M. viridis , kami memeriksa pertumbuhan amuba dalam keadaan simbiosis atau apo-simbiosis. Amuba dikulturkan dengan dan tanpa makanan dalam kondisi 12L:12D pada suhu 20°C. Ketika mangsa makanan diberikan pada kultur amuba, amuba dalam keadaan apo-simbiosis dapat tumbuh pada tingkat yang sama seperti dalam keadaan simbiosis (Gambar 2C ). Namun, ketika tidak ada makanan yang diberikan, amuba dalam keadaan non-simbiosis secara bertahap menurun dan akhirnya hilang, sedangkan amuba dalam keadaan simbiosis mempertahankan populasinya sampai batas tertentu (Gambar 2D ). Hasil ini menunjukkan bahwa simbion alga dapat meningkatkan kelangsungan hidup inang, khususnya dalam kondisi pasokan makanan terbatas.
3.4 Kuantifikasi Kemampuan Simbiotik Alga terhadap M. viridis
Untuk memastikan apakah M. viridis dapat menginternalisasi ulang simbion alga, yaitu, membuat transisi dari keadaan apo-simbiosis ke keadaan simbiosis, sel-sel Chlorella ditambahkan ke dalam kultur M. viridis apo-simbiosis . Awalnya, dua sel alga diisolasi dari sel-sel M. viridis strain NS-1 dan dibedakan dengan mobilitas elektroforesis amplikon PCR dari rDNA ITS, yang diberi nama strain A dan B. Sel-sel M. viridis yang memutih dikultur bersama dengan sel-sel Chlorella strain A dan B selama 1 jam. Setelah ko-kultur, jumlah sel Chlorella dalam sel-sel amuba dihitung. Kami menemukan bahwa jumlah sel Chlorella yang ditelan oleh M. viridis secara signifikan lebih tinggi pada strain B daripada pada strain A (Gambar S1 ). Kemudian, kami menguji apakah amuba dapat menyimpan sel-sel Chlorella di dalam sel-sel mereka untuk waktu yang lama. Setelah dikultur bersama dengan sel Chlorella selama 24 jam, sel M. viridis yang telah diputihkan dicuci untuk membuang sel Chlorella yang bebas lalu disimpan selama 1 minggu tanpa makanan. Meskipun jumlah strain B di dalam sel amuba menurun selama 1 minggu kultur, jumlah tersebut tetap lebih tinggi daripada strain A, sedangkan jumlah strain A di dalam sel amuba tetap rendah (Gambar 2E ). Hasil ini menunjukkan bahwa M. viridis dalam keadaan apo-simbiosis mampu membangun kembali simbiosis. Selain itu, hal ini menunjukkan bahwa kemampuan simbiosis kedua strain Chlorella berbeda, meskipun strain ini diisolasi dari spesies inang tunggal.
3.5 Analisis Filogenetik Strain Chlorella
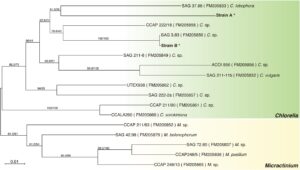
Kami melakukan analisis filogenetik dari dua galur Chlorella yang menunjukkan kemampuan simbiosis yang berbeda dengan menggunakan urutan daerah ITS dan SSU rDNA mereka. Pohon filogenetik menunjukkan bahwa kedua galur tersebut berada dalam genus Chlorella (Gambar 3 ). Galur A dan B secara genetik dekat dengan SAG 37.88 dan SAG 3.83. SAG 3.83 adalah endosimbion alga hijau (zoochlorella) dari Acanthochystis turfacea , anggota Heliozoa. Mempertimbangkan bahwa galur B menunjukkan kemampuan simbiosis yang tinggi terhadap M. viridis (Gambar 2E ), kemampuan fotosimbiosis Chlorella dapat dipertahankan di seluruh spesies inang yang secara filogenetik jauh.
4 Diskusi
4.1 Bagaimana Stabilitas Fotosimbiosis Dapat Mempengaruhi Inang Amoeba
Pembentukan fotosimbiosis antara M. viridis dan simbion alga tampaknya tidak berkorelasi dengan aktivitas fotosintesis simbion karena DCMU menekan aktivitas fotosintesis simbion yang hidup bebas (lihat Gambar S2 ) tetapi tidak mempengaruhi stabilitas fotosimbiosis (Gambar 2A ). Sebuah studi sebelumnya menunjukkan bahwa pembentukan simbiosis antara Aiptasia dan alga simbiotik tidak bergantung pada fotosintesis simbion (Jinkerson et al. 2022 ). Dengan demikian, pemutihan M. viridis yang disebabkan oleh ACN tampaknya disebabkan oleh faktor-faktor lain selain penghambatan fotosintesis simbion. Mempertimbangkan bahwa ACN juga menyebabkan pemutihan cnidaria (Mihirogi et al. 2023 ), mekanisme yang sama kemungkinan menyebabkan keruntuhan simbiosis pada M. viridis . Penelitian lebih lanjut tentang mekanisme molekuler yang mempengaruhi ACN pada simbion fotosintesis dan organisme inang akan menjelaskan lebih lanjut tentang bagaimana fotosimbiosis terbentuk.
Hasil kami menunjukkan bahwa simbion alga memengaruhi kebugaran inang amuba tergantung pada konteks lingkungan. Ketika ada cukup persediaan makanan untuk inang amuba, simbion mungkin bukan faktor utama untuk kelangsungan hidup inang; sedangkan, dalam kondisi dengan persediaan makanan yang tidak mencukupi, simbion mungkin memiliki efek yang lebih signifikan pada kebugaran inangnya. Sebuah studi sebelumnya pada P. bursaria menunjukkan bahwa simbion alga intraseluler dapat memengaruhi kebugaran inangnya secara negatif ketika biaya untuk mempertahankan simbion melebihi manfaat yang diberikan oleh fotosintesis simbion (Lowe et al. 2016 ). Keseimbangan antara biaya (beban simbion) dan manfaat yang diperoleh dari simbion dapat berfluktuasi, misalnya, tergantung pada kondisi cahaya dan makan, seperti yang ditunjukkan pada ciliata (Lowe et al. 2016 ), yang berpotensi menyebabkan perbedaan dalam kebugaran M. viridis antara keadaan simbiosis dan apo-simbiosis.
4.2 Kemampuan Simbiotik Simbion Alga dan Pengenalan Simbion oleh Sel Inang
Perbedaan kemampuan simbiosis antara dua galur Chlorella menunjukkan bahwa ada mekanisme pengenalan simbion di M. viridis . Spesifisitas pasangan dalam fotosimbiosis juga ditemukan pada cnidaria (LaJeunesse et al. 2018 ; Yorifuji et al. 2021 ). Studi sebelumnya tentang fotosimbiosis karang menunjukkan bahwa karang inang dapat mengenali simbionnya dan memodulasi sistem imunnya (Jacobovitz et al. 2021 ). Studi terbaru pada karang lain menunjukkan bahwa protein LePin (lectin dan domain penghambat protease kazal) pada inang mungkin terlibat dalam fagositosis dan pengenalan simbion alga (Hu et al. 2020 , 2023 ). Interaksi antara lektin dan residu gula pada dinding sel alga yang dikenali mungkin menjadi kunci bagi M. viridis untuk membedakan antara simbion dan organisme lain.
Ditunjukkan bahwa predator amoebozoa yang memakan mangsa fotosintetik mengubah frekuensi penyerapan fagositosis dan kecepatan pencernaan makanan tergantung pada kondisi cahaya (Uzuka et al. 2019 ). Mempertimbangkan bahwa jumlah strain A di dalam sel amoeba tetap pada tingkat yang rendah tetapi stabil setelah satu minggu pembudidayaan, populasi strain A, selain strain B, dapat dipertahankan pada tingkat tertentu dalam sel/populasi M. viridis di lingkungan alami. Pengaturan keseimbangan antara penyerapan, pencernaan, dan pengeluaran alga oleh inang mungkin telah memengaruhi perbedaan kemampuan simbiosis antara strain Chlorella yang digunakan dalam penelitian ini. Analisis komparatif pematangan fagosom sel M. viridis apo-simbiosis yang menelan mangsa dan simbion dapat memberikan wawasan tentang hal ini dan beberapa petunjuk untuk mengatasi masalah evolusi, misalnya, transisi dari gaya hidup heterotrofik ke gaya hidup miksotrofik dalam proses awal perolehan plastida melalui endosimbiosis.
Galur Chlorella B dengan kemampuan simbiosis tinggi terhadap M. viridis berkerabat dekat dengan simbion alga dari heliozoa A. turfacea , yang menunjukkan bahwa kemampuan fotosimbiosis spesies Chlorella mungkin universal di seluruh spesies inang yang berjauhan secara filogenetik. Kuantifikasi kemampuan simbiosis galur B terhadap spesies inang lain dapat menjelaskan masalah ini. Analisis genomik dan pengembangan metode rekayasa genetika akan berguna dalam menjelaskan mekanisme molekuler yang menyebabkan spesifisitas galur simbiosis alga. Metode RNAi telah ditetapkan untuk Acanthamoeba , dan metode serupa dapat diterapkan pada M. viridis (Lorenzo-Morales et al. 2005 ).
5. Kesimpulan
Kami telah membentuk sistem eksperimental untuk meruntuhkan dan membangun kembali hubungan fotosimbiosis antara M. viridis dan Chlorella . Data kami menunjukkan bahwa fotosimbiosis tidaklah mutlak tetapi dapat diabaikan dalam kondisi kaya nutrisi yang diuji dan memiliki efek positif pada kebugaran inang dalam keadaan kelaparan, yang menunjukkan bahwa dampak evolusi fotosimbiosis bergantung pada konteks lingkungan. Pemutihan M. viridis juga memungkinkan kuantifikasi kemampuan simbiosis setiap galur alga pada kriteria tertentu, yang mengungkapkan bahwa kemampuan simbiosis alga terhadap M. viridis bervariasi tergantung pada galur alga. Metode pemutihan ini akan memberikan alat model penting tidak hanya untuk analisis komparatif inang dalam keadaan simbiosis dan non-simbiosis tetapi juga untuk pengamatan proses pembentukan fotosimbiosis dalam pencitraan sel hidup.