ABSTRAK
Memahami spesialisasi pola makan khusus spesies atau populasi adalah kunci untuk menginformasikan kebutuhan konservasi habitat dan program pemulihan eks situ yang sukses bagi banyak spesies yang terancam punah. Salah satu populasi yang paling terancam punah di Kanada, ekotipe salju tebal yang berperilaku berbeda dari rusa gunung Southern Mountain, dicirikan oleh pola makan musim dingin berupa lumut pohon daripada lumut darat. Kami berhipotesis bahwa variasi pola makan ini akan menghasilkan mikrobioma usus yang berbeda pada rusa gunung bersalju tebal dibandingkan dengan rusa gunung bersalju dangkal. Kami juga berhipotesis bahwa perubahan sementara pola makan alami untuk program konservasi eks situ , termasuk penyediaan pakan pelet komersial dan lumut yang dikumpulkan oleh sukarelawan selama kandang bersalin sapi hamil, dapat mengubah mikrobioma khusus ini. Di sini, kami menggunakan metabarkode DNA feses untuk membandingkan pola makan dan komposisi mikrobioma usus di antara berbagai kawanan rusa gunung bersalju tebal dan dangkal, rusa gunung bersalju tebal yang ditawan dari kandang bersalin Revelstoke, dan rusa kutub semi-domestikasi. Hasil kami mengonfirmasi bahwa rusa kutub salju tebal yang hidup bebas mengkhususkan diri pada lumut rambut arboreal Bryoria dan Nodobryoria, dan kami menunjukkan bahwa ini berkorelasi dengan mikrobioma yang berbeda dari rusa kutub salju dangkal yang mengkhususkan diri pada lumut terestrial Cladonia dan Stereocaulon . Kami juga menunjukkan bahwa kandang bersalin rusa kutub salju tebal secara signifikan mengubah konsumsi hijauan dan komposisi mikrobioma: rusa kutub yang dikandangkan mengonsumsi lebih banyak lumut berdaun dan memiliki mikrobioma yang berbeda dibandingkan dengan rusa kutub yang hidup bebas. Hasil kami menunjukkan bahwa pengelola harus mempertimbangkan dengan cermat hijauan yang disukai populasi rusa kutub saat merancang intervensi yang memerlukan modifikasi pola makan. Kami selanjutnya menyarankan agar sampel feses rusa kutub dan spesialis pola makan lainnya dipantau secara rutin untuk mengetahui komposisi pola makan dan mikrobioma, terutama selama periode penangkaran atau modifikasi pola makan, sebagai komponen tambahan dari penilaian konservasi.
1 Pendahuluan
Semakin banyak spesies di seluruh dunia yang menghadapi kepunahan, kepunahan, atau kepunahan karena hilangnya habitat dan degradasi (Myers et al. 2000 ). Salah satu spesies Amerika Utara yang paling ikonik yang menderita tekanan ini adalah karibu ( Rangifer tarandus ), yang telah punah di Amerika Serikat yang bersebelahan tetapi tetap sebagai populasi yang sebagian besar menurun di Kanada, di mana mereka merupakan sumber daya yang penting secara budaya bagi masyarakat Adat (Hummel et al. 2008 ; Sharp dan Sharp 2015 ). Populasi karibu menurun di 11 dari 12 “Unit yang Dapat Ditunjuk (DU)” Kanada, unit konservasi yang telah ditetapkan untuk tujuan pengelolaan (COSEWIC 2011 ). Beberapa penurunan paling signifikan telah terjadi pada apa yang sebelumnya merupakan beberapa populasi terkecil: rusa kutub gunung bersalju tebal dan bersalju dangkal di British Columbia timur dan Alberta barat (Serrouya et al. 2012 ), yang masing-masing diklasifikasikan berdasarkan Species at Risk Act ke dalam “kelompok Selatan” (DU9) dan “kelompok Tengah” (DU8) dari populasi rusa kutub Gunung Selatan yang lebih luas (Environment Canada 2014 ). Kedua kelompok rusa kutub gunung ini telah menurun sebesar 64% dan 45% dalam beberapa dekade terakhir, hingga ke titik di mana mereka sekarang berjumlah kurang dari 1400 dan 500 individu, masing-masing (COSEWIC 2014 ). Meskipun penyebab utama penurunan di area ini telah dikaitkan dengan aktivitas manusia (Mitchell 2021 ), terutama hilangnya hutan dewasa akibat penebangan habis-habisan (Stevenson 2001 ), penyebab langsungnya secara umum diyakini adalah predasi karena perubahan habitat yang meningkatkan kelimpahan predator, akses, dan mobilitas (DeMars dan Boutin 2018 ; Dickie et al. 2017 ; Mumma et al. 2018 ). Seperti halnya banyak populasi satwa liar Amerika Utara, ancaman yang dihadapi rusa kutub gunung semakin diperburuk oleh perubahan iklim dan perubahan terkait pada lapisan salju, rezim kebakaran, ketersediaan makanan (Greuel et al. 2021 ; Sullender et al. 2023 ; Venier et al. 2022 ), dan pesaing yang tampak (Dickie et al. 2024 ; Holt 1977 ). Mengingat tekanan yang berkelanjutan ini, konservasi semua rusa kutub gunung semakin mendesak, dan tindakan pemulihan harus mencakup semua alat yang tersedia.
Berbagai pendorong penurunan populasi karibu diperburuk oleh tingkat spesialisasi makanan yang tinggi, yang merupakan kontributor yang sering menyebabkan kepunahan spesies pada berbagai spesies (Purvis et al. 2000 ) dan dapat menimbulkan tantangan bagi upaya konservasi berbasis penangkaran atau eks situ (Slatyer et al. 2013 ). Tantangan-tantangan ini diperbesar oleh variasi makanan musiman antara karibu bersalju tebal dan dangkal, yang dikaitkan dengan habitat yang berbeda dan perilaku migrasi yang berevolusi dari dua ekotipe karibu (Webber et al. 2022 ). Di musim panas, kedua ekotipe karibu mencari makan pada tanaman vaskular yang berasal dari habitatnya masing-masing, tetapi di akhir musim dingin, karibu gunung bersalju tebal di sebelah barat pemisah benua bermigrasi ke hutan tua yang tinggi. Lapisan salju yang tebal (hingga 3–4 m) di habitat ini membatasi pertumbuhan dan aksesibilitas hijauan darat yang khas dari karibu Kanada lainnya; Sebaliknya, karibu salju tebal berdiri di atas lapisan salju untuk mencapai sumber makanan musim dingin utama mereka berupa lumut pohon di konifer dewasa, lebih menyukai lumut rambut dari genus Bryoria daripada taksa pohon lainnya (Antifeau 1987 ; Edwards dan Ritcey 1960 ; Edwards et al. 1960 ). Beberapa subpopulasi salju tebal melakukan migrasi ketinggian dua tahunan, perilaku yang mungkin unik secara global di antara ungulata (Apps et al. 2001 ). Setelah menghabiskan musim dingin di habitat dataran tinggi, karibu ini berpindah menuruni lereng ke daerah bebas salju di musim semi, di mana mereka terus mengonsumsi lumut tetapi juga mencari makan pada pertumbuhan tanaman segar. Sepanjang akhir musim semi dan musim panas, mereka perlahan bermigrasi kembali ke lereng atas untuk mengikuti “garis hijau-atas,” kembali ke habitat dataran rendah untuk mempertahankan makanan utamanya yang berbasis tanaman di musim gugur sebelum naik lagi ke makanan musim dingin mereka berupa lumut pohon (Seip 1990 ). Sebaliknya, karibu salju dangkal di sebelah timur pemisah benua menghabiskan musim dingin di hutan konifer atau di lereng pegunungan Alpen yang tersapu angin, tempat mereka mengais-ngais salju untuk mencari lumut terestrial seperti Cladonia dan Stereocaulon serta sejumlah kecil bahan tanaman (Cichowski 1993 ; Denryter et al. 2017 ).
Studi tentang beragam taksa hewan telah menekankan hubungan erat antara pola makan hewan dan komposisi mikrobioma ususnya, terutama di antara spesialis pola makan yang untuk memperoleh nutrisi yang cukup sering kali memerlukan komunitas mikroba usus yang sama-sama terspesialisasi (de Jonge et al. 2022 ; Liu et al. 2021 ; Youngblut et al. 2019 ). Namun, mikrobioma usus belum pernah dinilai sebelumnya pada rusa kutub gunung, hanya ada satu studi sebelumnya tentang populasi rusa kutub hutan di Kanada bagian tengah (Nagati et al. 2024 ). Pada ruminansia lain, mikroorganisme usus mencerna polisakarida kompleks yang ditemukan dalam pola makan berbasis tumbuhan atau lumut, menghasilkan asam lemak rantai pendek yang menyediakan sumber energi yang tersedia secara luas (Mizrahi et al. 2021 ; Moraïs dan Mizrahi 2019 ). Karena taksa mikroba yang berbeda mencerna substrat yang berbeda, komposisi mikrobioma ruminansia terkait erat dengan jenis, kualitas, dan fermentasi serat dalam makanan hewan (Glendinning et al. 2021 ; Parnian-Khajehdizaj et al. 2023 ; Terry et al. 2019 ), meskipun jenis kelamin inang, usia, dan identitas spesies juga dapat menyusun mikrobiota usus (Härer dan Rennison 2023 ; Macke et al. 2017 ). Bahasa Indonesia: Untuk karibu, lumut pohon dan lumut darat terdiri dari polisakarida struktural yang berbeda—glukan terkait-β pada lumut pohon seperti Bryoria vs. glukan terkait-α pada lumut darat seperti Cladonia (Common 1991 ; Olafsdottir dan Ingólfsdottir 2001 ; Spribille et al. 2020 ; Svihus dan Holand 2000 )—yang didegradasi oleh jalur metabolisme mikroba yang berbeda (Suyotha et al. 2016 ). Perbedaan kimia yang halus ini, dikombinasikan dengan rentang yang lebih sempit dari hijauan musim dingin yang dikonsumsi oleh karibu salju tebal, diharapkan menghasilkan diferensiasi mikrobioma musim dingin antara karibu salju tebal dan dangkal. Oleh karena itu, mengkarakterisasi mikrobioma karibu dapat lebih jauh mengungkapkan sifat variasi musim dingin di antara populasi-populasi ini, menyediakan data ekologi tambahan untuk menginformasikan perencanaan konservasi, pemantauan, dan tindakan pengelolaan.
Salah satu tindakan manajemen yang digunakan untuk meningkatkan populasi rusa kutub kecil, tetapi dengan efek yang belum dieksplorasi pada mikrobioma usus mereka, adalah tindakan manajemen eks-situ , penangkaran sementara yang disebut kandang bersalin. Dalam program ini, rusa kutub betina yang sudah dewasa dan bunting ditangkap sebelum melahirkan dan ditahan di kandang penangkaran di habitat asli selama periode melahirkan, dilindungi oleh pagar dan penjaga untuk mengurangi pemangsaan pada anak rusa yang baru lahir (Adams et al. 2019 ; Serrouya et al. 2019 ; Smith and Pittaway 2011 ). Karena ketidakmampuan untuk menyediakan 100% makanan alami dari kandang itu sendiri, penangkaran sementara di kandang induk mengharuskan rusa kutub yang berkeliaran bebas dialihkan dari makanan lumut mereka ke makanan yang terdiri dari pakan pelet komersial yang dirancang untuk rusa kutub (Serrouya, Bollefer, et al. 2021 ), dan transisi ini dapat mengubah komposisi mikrobioma alami mereka. Perubahan potensial ini penting karena kurangnya komunitas mikroba asli yang kuat pada hewan yang dikandangkan dapat membahayakan kesehatan hewan dan keberhasilan reintroduksi (Trevelline et al. 2019 ; West et al. 2019 ). Untuk karibu, protokol kandang bersalin saat ini mencakup periode transisi saat tiba di kandang dari diet alami yang digembalakan bebas ke diet lumut yang dipetik dengan tangan, ke diet 100% pakan pelet dengan tingkat penambahan pelet 10% per hari selama setidaknya 2 minggu. Periode transisi kedua kembali ke diet lumut yang dipetik dengan tangan terjadi sebelum pelepasan. Pasangan induk-anak sapi biasanya dilepaskan dari kandang pada pertengahan musim panas setelah anak sapi berusia setidaknya 1 bulan (Legebokow 2016 ).
Hingga saat ini, tiga program kandang bersalin telah ditetapkan di British Columbia. Proyek kandang bersalin Klinse-Za yang sedang berlangsung untuk rusa gunung bersalju dangkal disertai dengan upaya pengendalian serigala yang signifikan di area wilayah jelajah kawanan dan telah mengurangi kematian anak rusa dan meningkatkan ukuran populasi efektif (Lamb et al. 2022 ; McNay et al. 2022 ). Di antara rusa salju tebal, program Central Selkirk/Arrow Lakes dimulai pada tahun 2022 untuk subpopulasi Central Selkirks, tetapi sedikit analisis yang telah dilakukan hingga saat ini (Arrow Lakes Caribou Society 2023 ). Program Revelstoke Caribou Rearing in the Wild (2013–2018) untuk subpopulasi Columbia North memiliki tahun-tahun dengan kematian rusa betina dewasa dan anak rusa yang tinggi, dibandingkan dengan program kandang lainnya; Analisis data pasca-program menunjukkan bahwa karibu mengalami suhu hangat yang melebihi batas termal mereka karena kombinasi lokasi kandang, ketinggian, dan pola cuaca, di antara faktor-faktor lainnya (Serrouya, Bollefer, et al. 2021 ). Semua proyek kandang ini mencakup habitat alami dengan berbagai ukuran meskipun tidak ada yang memiliki informasi yang diperlukan untuk mencocokkan lumut tertentu yang dipilih sendiri atau tersedia di kandang dengan diet dan mikrobioma khusus populasi.
Mengingat konteks ekologi ini, kami berhipotesis bahwa (i) diet musim dingin lumut arboreal untuk rusa gunung bersalju tebal memerlukan mikrobioma yang berbeda dengan rusa gunung bersalju dangkal dan (ii) perubahan diet selama kandang bersalin dan pemberian makanan tambahan akan mengubah mikrobioma alami rusa. Hipotesis terakhir berasal dari beberapa penelitian yang menunjukkan bahwa mikrobioma hewan yang ditawan dan/atau diberi makan pelet berbeda dari hewan liar dan/atau diberi makan hijauan (Alberdi et al. 2021 ; McKenzie et al. 2017 ). Misalnya, rusa kutub Eropa yang ditawan yang diberi pakan pelet memiliki mikrobioma yang berubah relatif terhadap rusa kutub yang diberi makan lumut (Salgado-Flores et al. 2016 ) dan ekstrak rumen mereka kurang efisien dalam mencerna lumut (Storeheier et al. 2002 ). Lebih jauh lagi, efek pemberian makanan tambahan atau buatan kemungkinan lebih besar pada spesialis diet yang dipelihara di penangkaran karena mereka kehilangan proporsi mikrobiota usus asli yang lebih besar daripada generalis diet (Kohl et al. 2014 ). Karena manajemen ex situ adalah metode pemulihan spesies yang terancam punah yang diakui dan telah mendapatkan dukungan untuk upaya pemulihan karibu, mengeksplorasi mikrobioma karibu gunung dapat memberikan informasi penting untuk tindakan konservasi di masa mendatang. Secara khusus, informasi tersebut dapat menyediakan alat untuk memantau adaptasi diet baik pada hewan yang menerima pakan tambahan in situ, seperti yang ada di subpopulasi Kennedy Siding dari karibu salju dangkal (Heard dan Zimmerman 2021 ) dan pada hewan yang keluar masuk penangkaran, termasuk program pemulihan ex situ yang sedang berlangsung dan masa mendatang di Klinse-Za, Central Selkirk (Arrow Lakes Caribou Society 2023 ), Taman Nasional Jasper (Parks Canada Agency 2022 ), dan di tempat lain. Informasi ini tidak hanya berlaku untuk karibu tetapi juga untuk spesies yang terancam punah di seluruh dunia yang tindakan konservasinya memerlukan modifikasi diet jangka pendek atau jangka panjang.
Oleh karena itu, kami bertujuan untuk menguji efek spesialisasi diet musim dingin dan manajemen ex situ pada mikrobioma usus dari berbagai ekotipe rusa gunung dan Rangifer . Meskipun kami menduga bahwa mikrobioma usus rusa gunung dapat bervariasi secara musiman dengan diet mereka, kami memfokuskan pengambilan sampel kami pada musim dingin karena pada saat itulah perbedaan antarpopulasi dalam diet dan penggunaan habitat paling menonjol dan rusa betina hamil dipindahkan ke kandang bersalin. Tujuan khusus kami adalah untuk (a) mengkarakterisasi diet lumut musim dingin dari beberapa subpopulasi rusa kutub liar di salju tebal dan dangkal untuk memverifikasi perbedaan sebelumnya antara kedua jenis ini, (b) menentukan apakah diet musim dingin yang sangat terspesialisasi dari rusa kutub salju tebal tercermin dalam mikrobioma yang sama berbedanya, dan (c) mengukur perubahan dalam mikrobioma yang terkait dengan kandang induk dalam setidaknya satu proyek kandang. Kami melakukannya dengan menggunakan metabarkode DNA dari sampel feses untuk membandingkan diet dan komposisi mikrobioma untuk rusa kutub liar dan yang dikandang. Sebagai referensi untuk efek diet pelet, kami membandingkan data kami dengan mikrobioma populasi rusa kutub semi-domestikasi, yang jarang menerima lumut kerak. Upaya pengurutan kami menargetkan amplikon gen ITS2 jamur dan tumbuhan, amplikon gen 16S rRNA bakteri/arkea, dan amplikon gen 18S rRNA eukariotik untuk mendeteksi tanda-tanda diet alami (lumut kerak, alga, dan tumbuhan) dan komposisi mikrobioma usus (bakteri dan protista). Berdasarkan hipotesis kami bahwa diet khusus populasi memerlukan mikrobioma yang terspesialisasi, kami memperkirakan bahwa rusa kutub bersalju tebal yang mengonsumsi beberapa genus lumut kerak arboreal tertentu akan memiliki mikrobioma usus yang berbeda dan kurang kaya spesies dibandingkan dengan rusa kutub bersalju dangkal yang mengonsumsi berbagai lumut kerak terestrial dan bahan tumbuhan. Berdasarkan hipotesis kami bahwa penangkaran dan pakan pelet membentuk kembali mikrobioma tipe liar dari spesialis makanan seperti karibu, kami meramalkan bahwa karibu yang diberi pelet akan memiliki mikrobioma yang berubah dengan berkurangnya kelimpahan relatif taksa perusak karbohidrat utama yang ada dalam populasi liar.
2 Bahan dan Metode
2.1 Pengambilan Sampel
Kami memperoleh sampel feses dari dua kelompok rusa kutub yang hidup bebas, satu yang ditawan sementara, dan satu yang ditawan secara permanen, yang meliputi dua ekotipe pegunungan yang terancam punah serta individu yang menerima pakan pelet. Untuk rusa kutub pegunungan bersalju tebal, kami memperoleh sampel dari enam subpopulasi yang hidup bebas: kawanan Barkerville, Wells Gray North, North Cariboo, Central Selkirk, Hart Ranges, dan Columbia North, semuanya di sisi barat pemisah benua (Gambar 1 ). Sampel feses dari salju tebal dikumpulkan pada bulan Januari–Februari 2021 dan diberikan kepada kami oleh Program Kesehatan Satwa Liar British Columbia. Untuk rusa kutub bersalju dangkal di sisi timur pemisah benua, kami memperoleh sampel dari subpopulasi Brazeau dan Tonquin di Taman Nasional Jasper (Gambar 1 ). Sampel feses rusa kutub pegunungan bersalju dangkal dikumpulkan pada bulan November 2020 dan diberikan kepada kami oleh Parks Canada. Untuk semua rusa kutub yang hidup bebas, sampel dikumpulkan dalam waktu tidak lebih dari 24 jam setelah buang air besar selama survei rutin dan proyek pemasangan kalung.
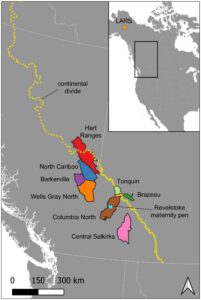
Untuk menguji efek penangkaran dan pakan pelet pada mikrobioma usus, kami juga memperoleh sampel feses dari satu kelompok rusa kutub yang dikandangkan di kandang bersalin dan satu populasi rusa kutub semi-domestikasi. Pertama, sampel dikumpulkan dari rusa kutub gunung bersalju tebal yang dipelihara di Revelstoke Caribou Rearing in the Wild Maternity Pen (selanjutnya disebut “Revelstoke Pen”), area berpagar seluas 9,3 ha yang terletak di ketinggian 580 m di tempat penebangan habis yang jarang ditebar di dekat Danau Revelstoke (Gambar 1 ; Serrouya, Bollefer, dkk. 2021 ). Sampel feses dikumpulkan pada tahun 2017, musim keempat (dari lima) kandang bersalin tersebut beroperasi. Semua sampel dikumpulkan pada bulan Mei; periode pengumpulan ini lebih lambat daripada rusa kutub yang hidup bebas tetapi diperlukan untuk memastikan bahwa rusa kutub di kandang telah sepenuhnya beralih ke pola makan pakan pelet. Caribou diberi 3,2 kg pelet per hewan per hari (Serrouya, Bollefer, et al. 2021 ). Makanan berupa lumut kerak yang terdapat secara alami dalam jumlah terbatas terdapat di dalam kandang, tetapi makanan ini sebagian besar telah habis selama tahun-tahun awal pengoperasian kandang (R. Serrouya, pengamatan pribadi). Kami juga memperoleh sampel dari rusa kutub yang dipelihara sepanjang tahun di Large Animal Research Station (LARS) di Alaska. Rusa kutub yang dipelihara di kandang seluas 54 ha ini diberi pakan berupa pelet sepanjang tahun, dengan lumut kerak hanya diberikan sebagai makanan sesekali (J. Blake, komunikasi pribadi). Semua sampel dikumpulkan dalam waktu 1–3 jam setelah buang air besar.
2.2 Pengurutan Amplikon Multipleks
Semua sampel feses disimpan dan diangkut pada suhu -20°C dan tetap beku hingga ekstraksi DNA. Untuk ekstraksi DNA, sampel dihomogenkan secara manual menggunakan lumpang dan alu, dan 100 mg bahan feses diproses menggunakan kit ekstraksi DNA Qiagen DNeasy PowerSoil Pro. Kami menyaring sampel DNA untuk kemurnian dan hasil dan mengirim DNA yang diekstraksi ke Genome Quebec (Montreal, QC) untuk amplifikasi PCR, persiapan pustaka, dan pengurutan. Singkatnya, setiap sampel DNA diamplifikasi PCR dalam empat reaksi terpisah, dengan satu reaksi untuk masing-masing dari empat pasangan primer yang berbeda: 515F/926R untuk menargetkan gen 16S rRNA, 565F/948R untuk menargetkan gen 18S rRNA, ITS9F/ITS4R untuk menargetkan wilayah ITS2 jamur, dan ITS2F/ITS3R untuk menargetkan wilayah ITS2 tanaman (lihat Tabel S1 ). Kami memilih pasangan primer ini karena mereka memberikan informasi tentang diet karibu (lumut kerak dan tanaman) dan komposisi mikrobioma usus (bakteri dan eukariota) (Nagati et al. 2024 ). Primer PCR maju dan mundur dimodifikasi untuk menyertakan adaptor dan indeks sekuensing Illumina sehingga amplifikasi dan pengindeksan ganda terjadi dalam reaksi PCR yang sama. Setelah amplifikasi, sampel dikumpulkan pada konsentrasi ekuimolar dan diurutkan pada Illumina MiSeq menggunakan kimia v3 dan pembacaan ujung berpasangan 300 bp. Sampel diurutkan bersama kontrol negatif dan komunitas tiruan dengan komposisi yang diketahui (Standar DNA Komunitas Mikroba ZymoBiomics).
Urutan amplikon disaring kualitasnya dan dikoreksi kesalahannya menggunakan algoritma DADA2 yang diimplementasikan dalam R 4.2.3 (Tim Inti R 2019 ) dan kemudian dikelompokkan menjadi unit taksonomi operasional (OTU) pada identitas urutan 97%. Kami menghapus OTU dengan kelimpahan relatif keseluruhan kurang dari 0,001%, OTU yang panjangnya tidak diharapkan untuk setiap amplikon dan sampel yang menghasilkan kurang dari 5000 bacaan yang disaring kualitasnya. OTU bakteri, eukariotik, dan jamur diberi penugasan taksonomi berdasarkan database RDP v18 (Cole et al. 2014 ), SILVA v138 (Quast et al. 2013 ), dan UNITE v9.0 (Abarenkov et al. 2022 ), dan OTU tanaman diberi penugasan taksonomi berdasarkan hasil pencarian BLAST nukleotida. Lihat Data S1 untuk deskripsi terperinci tentang alur kerja pemrosesan sekuens kami. Keempat tabel fitur amplikon diimpor ke dalam paket R phyloseq (McMurdie dan Holmes 2013 ) untuk analisis hilir.
2.3 Analisis Statistik
Bahasa Indonesia: Untuk mengisolasi tanda-tanda berbasis diet dari data metabarcoding kami, kami membuat subset tambahan dari data kami yang mencakup (i) hanya jamur yang diketahui membentuk simbiosis lichen (selanjutnya disebut “simbiosis jamur lichen”) dan (ii) hanya alga, yang merupakan komponen penting lain dari simbiosis lichen. Untuk penelitian ini, kami mengidentifikasi simbion jamur lichen sebagai genera jamur apa pun yang didefinisikan demikian oleh Lücking et al. ( 2016 ) atau FUNGuild (Nguyen et al. 2016 ). Kami kemudian secara manual meninjau daftar taksa yang tersisa untuk menghapus yang keliru diklasifikasikan sebagai lichen (lihat Data S1 ). OTU alga diidentifikasi berdasarkan klasifikasi taksonomisnya dalam basis data SILVA. Dengan membuat tabel fitur terpisah untuk simbion jamur lumut dan alga, kami memastikan bahwa kelimpahan relatif dari masing-masing item diet (misalnya, genus jamur lumut) disajikan sebagai proporsi dari semua item diet (misalnya, semua lumut) yang kami deteksi. Dengan kata lain, estimasi komposisi diet tidak dipengaruhi oleh keberadaan item non-diet (misalnya, jamur koprofilik) yang juga terdeteksi menggunakan primer PCR kami. Terakhir, kami membuat subset ketiga dari data kami yang memisahkan protista dari amplikon gen 18S rRNA lainnya, yang memungkinkan kami untuk mengevaluasi anggota eukariotik mikrobioma usus secara terpisah dari setiap urutan jamur dan tanaman yang ditangkap lebih baik oleh dua pasang primer ITS. Kami tidak menilai komponen jamur dari mikrobioma karena kesulitan dalam membedakan jamur lingkungan atau tangkapan sampingan mencari makan dari penghuni usus yang sebenarnya.
Untuk setiap sampel dan amplikon atau subset amplikon (simbion jamur lumut, alga, dan protista), kami menghitung total kekayaan OTU dan keanekaragaman Shannon dari hitungan bacaan mentah menggunakan iNext , yang menghasilkan estimasi asimtotik untuk nilai-nilai ini berdasarkan kurva rarefaksi dan dengan demikian mengurangi efek pengganggu dari kedalaman bacaan (Hsieh et al. 2016 ). Kami kemudian menggunakan ANOVA diikuti oleh uji post hoc Tukey untuk menyaring perbedaan yang signifikan dalam keanekaragaman alfa di antara kelompok studi dan subpopulasi. Kami memvisualisasikan keanekaragaman beta di antara kelompok studi dan subpopulasi menggunakan analisis koordinat utama berdasarkan jarak Aitchison, yang melibatkan transformasi rasio-log yang berpusat pada hitungan sekuens mentah untuk memperhitungkan sifat komposisi data sekuensing. Perbedaan yang signifikan dalam komposisi komunitas kemudian diidentifikasi menggunakan analisis varians multivariat permutasi (PERMANOVA) dan uji homogenitas dispersi multivariat. Taksa yang jumlahnya berbeda di antara kelompok studi dan subpopulasi diidentifikasi menggunakan ALDEx2 (Fernandes et al. 2013 ) dan model hutan acak (Liaw dan Wiener 2002 ). Jika sesuai, nilai- p disesuaikan untuk beberapa perbandingan menggunakan koreksi tingkat penemuan palsu, dan signifikansi ditetapkan pada p < 0,05. Kami kemudian menguji apakah komposisi mikrobioma usus dapat dijelaskan oleh komposisi makanan dan, jika demikian, kelompok mikroba mana yang paling erat kaitannya dengan item makanan tertentu. Pertama, kami menggunakan analisis redundansi (RDA) untuk menilai sejauh mana komposisi mikrobioma keseluruhan dapat dijelaskan oleh komposisi makanan keseluruhan, dengan model RDA terpisah untuk setiap perbandingan berpasangan antara mikrobioma (bakteri atau protista) dan set data makanan (lumut kerak atau alga) (lihat Data S1 ). Kedua, kami menguji pola ko-kemunculan antara kelimpahan relatif anggota spesifik mikrobiota usus (bakteri atau protista) dan kelimpahan relatif item makanan spesifik (lumut kerak atau alga) menggunakan korelasi Spearman. Untuk setiap amplikon atau set amplikon, kelimpahan relatif setiap genus berkorelasi dengan kelimpahan relatif (i) setiap genus lain dalam set amplikon yang sama dan (ii) kelimpahan relatif setiap genus di setiap set amplikon lainnya. Kami mengoreksi nilai- p untuk beberapa perbandingan, seperti sebelumnya, dan kemudian mempertahankan 179 korelasi yang mana Spearman’s r > 0,6 dan FDR-adjusted p < 0,01. Statistik jaringan, termasuk sentralitas perantara, sentralitas kedekatan, dan derajat untuk setiap takson dalam jaringan, kemudian dihitung menggunakan CytoScape v3.10.0 (Shannon et al. 2003 ). Taksa hub didefinisikan sebagai genera yang paling interaktif dalam jaringan sebagai fungsi dari derajat, sentralitas perantara, dan sentralitas kedekatannya (lihat Data S1 ).
3 Hasil
Secara keseluruhan, kami mengumpulkan total 67 sampel feses rusa kutub di keempat kelompok studi kami, dan upaya pengurutan kami menghasilkan 7.305.679 bacaan berkualitas tinggi yang didistribusikan di keempat amplikon target kami (Tabel 1 ). Dua puluh empat sampel dari rusa kutub salju tebal gagal menghasilkan bacaan apa pun untuk amplikon ITS2 tanaman, tetapi sebaliknya, hanya satu sampel rusa kutub salju tebal yang hilang karena kedalaman pengurutan yang rendah di amplikon 16S dan 18S (Tabel 1 ). Kontrol pengurutan dilakukan seperti yang diharapkan (lihat Gambar S1 dan S2 ).
| Ekoregion & kawanan | Jumlah N | Jumlah pembacaan (jumlah sampel) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 16 detik | 18 tahun | Jamur ITS2 | Pabrik ITS2 | ||||||
| Gunung Selatan | 29 | ||||||||
| Kota Barkerville | 5 | 79.308 | (5) | 103.633 orang | (5) | 176.277 orang | (5) | 31.345 orang | (1) |
| Selkirk Tengah | 3 | 31.226 orang | (3) | 59.840 | (3) | 116.478 orang | (3) | 72.681 juta | (3) |
| Pegunungan Hart | 7 | 119.023 orang | (7) | 119.906 orang | (7) | 223.142 orang | (7) | 30.257 orang | (1) |
| Cariboo Utara | 4 | 45.478 orang | (4) | 80.218 | (4) | 117.792 orang | (4) | angka 0 | (0) |
| Kolombia Utara | 5 | 57.216 orang | (4) | 90.258 | (4) | 197.148 orang | (5) | angka 0 | (0) |
| Wells Gray Utara | 5 | 69.932 orang | (5) | 98.389 | (5) | 158.951 | (5) | angka 0 | (0) |
| Gunung Tengah | 10 | ||||||||
| Brazeau | 3 | 143.575 orang | (3) | 98.459 | (3) | 113.199 orang | (3) | 95.158 | (3) |
| Bahasa Tonquin | 7 | 293.478 | (7) | 211.785 orang | (7) | 200.531 | (7) | 190.379 orang | (7) |
| Pena Revelstoke | 15 | 630.707 orang | (15) | 399.437 | (15) | 506.730 orang | (15) | 377.867 orang | (15) |
| Stasiun Penelitian Hewan Besar | 13 | 570.698 | (13) | 465.988 | (13) | 470.644 orang | (13) | 458.742 juta | (13) |
Catatan: Tabel menunjukkan jumlah sampel feses yang dikumpulkan dari setiap populasi atau kawanan (“Total N”) serta jumlah pembacaan sekuensing berkualitas tinggi yang dihasilkan untuk setiap amplikon. Karena beberapa sampel gagal mengamplifikasi atau menghasilkan pembacaan yang cukup untuk analisis, angka dalam tanda kurung menunjukkan jumlah individu yang digunakan untuk analisis untuk setiap amplikon.
3.1 Bukti Diet Unik
3.1.1 Simbion Jamur Lichen
Kami pertama-tama mempertimbangkan perbedaan berbasis diet dalam data sekuensing, yang kami interogasi melalui amplikon ITS jamur lichen dan tanaman serta amplikon eukariotik (18S) yang ditugaskan untuk alga. Rata-rata, 11,4% ± 16,9% dari pembacaan jamur di setiap sampel ditugaskan untuk simbion jamur lichen (Gambar S5 ), sementara sisanya didistribusikan di antara parasit lichen, jamur koprofilik, dan jamur lingkungan lainnya (dibahas kemudian). Kekayaan dan keanekaragaman OTU jamur lichen bervariasi secara signifikan di antara kelompok karibu: karibu gunung bersalju tebal menampung dua hingga tiga kali lipat lebih sedikit OTU jamur lichen daripada karibu gunung bersalju dangkal atau karibu Revelstoke Pen (ANOVA F 3 = 6,41, p = 0,001; Gambar 2a dan Tabel S2 ). Hanya 12 OTU jamur lichen yang terdeteksi pada rusa kutub yang diberi pelet dari LARS, semuanya pada kelimpahan dan prevalensi relatif rendah (Gambar 2a dan Tabel S3 ), sehingga populasi ini dikeluarkan dari analisis beta-diversitas dan kelimpahan diferensial berikutnya. Tiga kelompok karibu yang tersisa menunjukkan pemisahan yang jelas dan signifikan dalam analisis beta-diversitas (PERMANOVA F 2 = 21,4, R 2 = 0,46, p < 0,001; Gambar 2b , Gambar S6 , dan Tabel S4 ) dan dapat dibedakan dengan akurasi 97% dalam model hutan acak yang dilatih pada bacaan sekuensing jamur lichen mereka (Tabel S5 ).
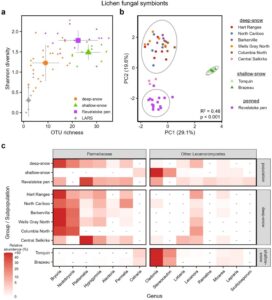
Sehubungan dengan komposisi taksonomi, lumut rambut arboreal Bryoria dan Nodobryoria mencakup 62% dari semua bacaan jamur lumut di karibu gunung bersalju tebal dibandingkan dengan hanya 8% di karibu Revelstoke Pen dan 0% di karibu gunung bersalju dangkal (Gambar 2c ). Genus lumut rambut Alectoria terdeteksi hanya pada kelimpahan relatif rendah (0,49%–1,05%) di sebagian kecil subpopulasi salju tebal. Sebaliknya, lebih dari 95% bacaan simbion jamur lumut dari karibu gunung bersalju dangkal ditugaskan ke lumut terestrial Cladonia (81,5% ± 13,6%) dan Stereocaulon (14,3% ± 12,8%). Kelima genus yang berlimpah secara berbeda ini juga terlibat dalam analisis hutan acak karena kemampuan mereka untuk membedakan karibu berdasarkan kelompok studi mereka (Gambar 2c dan Tabel S6 ). Keanekaragaman jamur dan komposisi lichen juga bervariasi di antara subpopulasi rusa kutub bersalju tebal, meskipun pada tingkat yang lebih rendah dibandingkan di antara keempat kelompok studi (Gambar S7 ); variasi ini terutama didorong oleh subpopulasi Selkirk Tengah, yang dikelompokkan secara terpisah dari rusa kutub pegunungan bersalju tebal lainnya dalam analisis keanekaragaman beta (Gambar 2b , Gambar S7 , dan Tabel S4 ) dan memiliki kurang dari 6% bacaan lichen yang ditugaskan ke Bryoria dan Nodobryoria (Gambar 2c dan Tabel S6 ).
Dibandingkan dengan karibu salju tebal yang berkeliaran bebas, karibu di Pen Revelstoke memiliki proporsi pembacaan yang secara signifikan lebih tinggi yang ditetapkan untuk Alectoria (6,6% ± 10,4%) dan tiga kali lipat lebih banyak pembacaan yang ditetapkan untuk lumut daun Platismatia , Hypogymnia , dan Parmelia , yang sebaliknya terdeteksi pada kelimpahan relatif sedang hingga rendah hanya pada sebagian kecil subpopulasi karibu gunung salju tebal (Gambar 2c dan Tabel S6 ). Lumut rambut Ramalina hanya ditemukan pada karibu Pen Revelstoke, dan analisis kesamaan sekuens menggunakan algoritma blastn menunjukkan bahwa OTU Ramalina ini adalah R. thrausta . Cladonia dan Bryoria masing-masing menyumbang 9,9% dan 7,7% dari pembacaan jamur lumut dari karibu Pen Revelstoke.
3.1.2 Alga
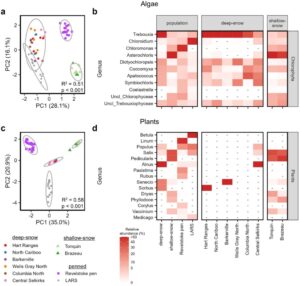
Perbedaan yang kuat dalam komposisi jamur lichen di antara kelompok studi juga tercermin dalam pembacaan alga, yang mencakup 16,7% dari pembacaan amplikon 18S (Gambar S5 ) . Secara keseluruhan, keragaman dan komposisi pembacaan alga bervariasi secara signifikan di antara kelompok studi (Gambar 3a dan Gambar S8 dan S9 ; ANOVA F3 = 80,6, p < 0,001; PERMANOVA F3 = 20,6, R2 = 0,507, p = 0,001 ) tetapi tidak di antara subpopulasi karibu salju tebal (Tabel S2 dan S4 ). Alga Trebouxia , yang merupakan mitra fotosintesis dalam lichen Bryoria (Lindgren et al. 2014 ), mencakup 56,0% pembacaan alga dari karibu salju tebal dibandingkan dengan kurang dari 6% pembacaan alga di tiga kelompok lainnya (Gambar 3b dan Tabel S7 ). Sebaliknya, 54,5% pembacaan alga untuk karibu gunung bersalju dangkal ditugaskan ke Asterochloris , fotobion umum dari Cladonia dan Stereocaulon (Skaloud dan Peksa 2010 ) yang terdeteksi pada kelimpahan kurang dari 2% pada kelompok karibu lainnya (Gambar 3b dan Tabel S7 ). Genus Chlorophyceae Chloromonas tidak terdeteksi dalam sampel karibu bersalju tebal tetapi hadir pada kelimpahan 10,4% di antara karibu bersalju dangkal dan kelimpahan 47,7% pada karibu Revelstoke Pen. Chloroidium adalah genus alga dominan yang terdeteksi pada populasi LARS, meliputi 81,4% dari semua pembacaan alga dibandingkan dengan kurang dari 4% pada populasi lain (Gambar 3b ); spesies ini kemungkinan terjadi secara alami di kandang LARS.
3.1.3 Tumbuhan
Hanya lima sampel rusa kutub gunung bersalju tebal yang menghasilkan pembacaan ITS2 tanaman. Beberapa pembacaan tanaman yang terdeteksi dalam populasi gunung bersalju tebal ditugaskan ke genera Alnus , Senecio , Populus , Salix , dan Acer (Gambar 3d ). Di antara tiga populasi yang tersisa, kekayaan OTU tanaman tetapi bukan keanekaragaman sedikit lebih tinggi pada rusa kutub pena Revelstoke (Gambar S10 dan Tabel S2 ), dan komposisi komunitas berbeda secara signifikan (Gambar 3c , Gambar S10 , dan Tabel S4 ). Sebagian besar pembacaan tanaman pada rusa kutub salju dangkal ditugaskan ke genera Pedicularis (36,1% ± 24,6%), Salix (35,8% ± 21,9%), dan Dryas (8,2% ± 20,3%) (Gambar 3d dan Tabel S8 ), yang merupakan ciri khas pegunungan Alpen di Pegunungan Rocky Alberta (Willoughby dan Gould 2021 ). Sebagian besar tumbuhan yang ditemukan di karibu Revelstoke Pen berasal dari genus Linum (47,0% ± 25,5%), Paxistima (15,0% ± 20,8%), dan Populus (14,7% ± 21,8%). Karibu yang ditawan di LARS terutama memakan genus Betula (56,0% ± 23,6%), Populus (22,9% ± 24,7%), dan Salix (11,4% ± 22,0%) (Gambar 3d ).
3.2 Bukti Komposisi Mikrobioma yang Unik
3.2.1 Bakteri
Kami mengevaluasi bagaimana perbedaan berdasarkan pola makan di antara kelompok karibu berkorelasi dengan komposisi mikrobioma bakteri usus sebagaimana terungkap melalui data amplikon 16S. Secara keseluruhan, mikrobioma usus di semua sampel didominasi oleh Firmicutes dan Bacteroidetes (>97% dari semua pembacaan), dengan sebagian besar pembacaan ditetapkan pada famili Ruminococcaceae, Lachnospiraceae, dan Bacteroidaceae (Gambar S11 ). Kami juga mendeteksi populasi kecil archaea metanogenik (Gambar S11 ). Sehubungan dengan tujuan studi kami, kami menemukan bahwa mikrobioma usus karibu salju tebal secara signifikan kurang kaya spesies (ANOVA F 3 = 250,7, p < 0,001) dan beragam (ANOVA F 3 = 118,0, p < 0,001) daripada populasi karibu lain yang kami sampel, menampung 51% dan 43% lebih sedikit OTU bakteri daripada karibu salju dangkal dan Revelstoke Pen, masing-masing (Gambar 4a dan Tabel S2 ). Populasi LARS memiliki mikrobioma paling kaya spesies (Gambar 4a ). Seperti halnya pola makan, komposisi mikrobioma usus berbeda secara signifikan di antara keempat populasi studi (Gambar 4b dan Gambar S12 ; PERMANOVA F 3 = 21,2, R 2 = 0,506, p = 0,001) dan terdiskriminasi sempurna di antara populasi studi dalam model hutan acak (Tabel S5 ). Keanekaragaman bakteri alfa dan beta juga bervariasi secara signifikan di antara subpopulasi rusa gunung bersalju tebal, meskipun pada tingkat yang lebih rendah dibandingkan di antara keempat kelompok studi (Tabel S4 dan Gambar S13 ).
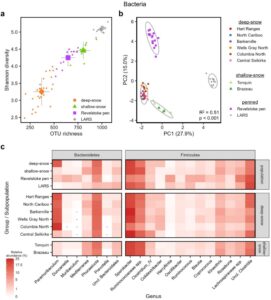
Dua puluh empat genus bakteri secara signifikan berbeda berlimpah di antara kelompok-kelompok studi. Yang paling mencolok, Paramuribaculum adalah 9 hingga 24 kali lipat lebih berlimpah secara relatif di karibu salju tebal daripada di karibu salju dangkal atau Revelstoke Pen dan hampir tidak ada dalam populasi LARS (Gambar 4c dan Tabel S9 ). Genus Phocaeicola dan Sporobacter adalah dua kali lipat lebih berlimpah secara relatif di populasi yang berkeliaran bebas dibandingkan dengan populasi yang dikandangkan dan semi-domestikasi (Gambar 4c dan Tabel S9 ); Ruminococcus dan Ruminococcaceae lain yang tidak terklasifikasi adalah 1,3 kali lipat lebih berlimpah secara relatif di karibu LARS, dan Blautia adalah lima kali lipat lebih berlimpah di karibu Revelstoke Pen. Genus lain yang terlibat dalam analisis hutan acak termasuk Subdoligranulum , yang hadir di semua karibu Revelstoke Pen tetapi tidak terdeteksi di semua kelompok lain, dan beberapa genus yang hanya hadir di rusa kutub LARS (Tabel S9 ). Beberapa genus bakteri memiliki kelimpahan yang berbeda di antara subpopulasi pegunungan bersalju tebal, dengan pengecualian Paramuribaculum yang jumlahnya relatif lebih sedikit di subpopulasi Selkirk Tengah (Gambar 4c ).
3.2.2 Protista
Di semua sampel, komunitas protista dalam mikrobioma usus sebagian besar terdiri dari Entamoeba (38,1% ± 27,5%), yang tidak bervariasi dalam kelimpahan relatif di antara populasi studi kami dan berbagai kelompok Apicomplexan (34,6% ± 33,8%) (Gambar S14 ). Meskipun Apicomplexan tiga kali lipat lebih berlimpah secara relatif di rusa kutub gunung bersalju tebal dibandingkan pada populasi lain, dua pertiga dari pembacaan sekuensing yang ditugaskan ke Apicomplexa tidak dapat diidentifikasi di bawah tingkat kelas (Tabel S10 ), membatasi kekuatan inferensial kami tentang peran potensial mikrobiota protista dalam populasi studi kami. Khususnya, dugaan Conoidasida mencakup 43,0% pembacaan dari rusa kutub bersalju tebal dibandingkan dengan kurang dari 5% pembacaan dari kelompok studi lain (Gambar S14 dan Tabel S10 ). Kami mengamati bahwa mikrobiota protista dari dua kelompok karibu liar tetap berbeda dari karibu Revelstoke Pen dan rusa kutub LARS dalam hal keanekaragaman alfa dan beta (Gambar S14 ). Secara khusus, keanekaragaman alfa protista dua kali lipat lebih tinggi dalam dua kelompok penangkaran (Gambar S14 dan Tabel S2 ), yang mengelompok secara terpisah dari karibu liar dan satu sama lain dalam analisis keanekaragaman beta (Gambar S14 dan Tabel S4 ). Lebih banyak OTU protista yang terdeteksi di karibu salju dangkal daripada di salju tebal, tetapi kedua kelompok ini tidak berbeda secara signifikan dalam komposisi komunitas (Gambar S14 dan Tabel S2 ).
3.3 Tanda Amplikon Lainnya
Bahasa Indonesia: Selain tanda-tanda berbasis diet dan mikrobioma, kami mendeteksi beberapa genus jamur non-lichen yang mewakili lebih dari 70% pembacaan sekuensing ITS2 jamur. Taksa ini agaknya mewakili campuran jamur lingkungan, tangkapan sampingan mencari makan, dan anggota mikobioma usus. Misalnya, genus koprofilik Thelebolus berlimpah di sebagian besar sampel dan mencakup 27% dari semua pembacaan ITS jamur (Gambar S15 dan Tabel S11 ). Jamur Lichenoconium , yang diketahui menjadi parasit pada Nodobryoria (Cole dan Hawksworth 2004 ), secara signifikan lebih berlimpah di rusa kutub pegunungan bersalju tebal dibandingkan di kelompok studi lain (22,0% vs. < 5%) (Gambar S15 dan Tabel S11 ). Jamur lain yang relatif melimpah dalam sampel tersebut meliputi famili Myxotrichaceae, yang terdeteksi pada kelimpahan relatif sedang di rusa kutub bersalju tebal dan rusa kutub yang terkurung, dan genus saprotrofik Troposporella , yang paling melimpah di rusa kutub bersalju dangkal (Gambar S15 dan Tabel S11 ).
3.4 Pola Makan Sebagai Prediktor Komposisi Mikrobioma
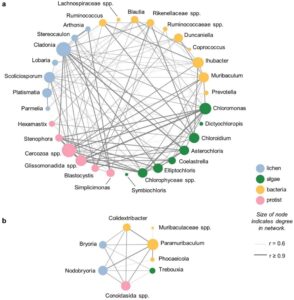
Konsisten dengan pemisahan yang kuat di antara populasi studi untuk semua amplikon yang kami uji, analisis RDA kami menunjukkan bahwa komposisi mikrobioma usus (bakteri atau protista) di keempat populasi studi kami dijelaskan dengan baik oleh ketiga komponen makanan (lumut kerak, alga, atau tanaman) ( p < 0,05 untuk semua perbandingan; Tabel S12 ). Selain itu, analisis ko-kemunculan kami di antara OTU bakteri/archaea, protista, alga, dan lumut kerak mengidentifikasi dua komunitas OTU yang terputus yang mewakili makanan dan komposisi mikrobioma yang berbeda: komunitas yang lebih kecil yang merupakan ciri khas karibu gunung bersalju tebal dan komunitas kedua yang lebih besar yang merupakan ciri khas karibu gunung bersalju dangkal (Gambar 5 , Tabel S13 dan S14 ). Pada komunitas pertama, kelimpahan relatif Bryoria dan Nodobryoria di antara kumpulan lumut kerak berkorelasi secara signifikan dengan kelimpahan relatif alga Trebouxia , genus bakteri Paramuribaculum , Colidextribacter , dan Phocaeicola , serta Conoidasida yang tidak terklasifikasi. Pada komunitas kedua, Cladonia dan Platismatia merupakan hub lumut kerak utama dan Chloromonas dan Chlorophyceae spp. merupakan hub alga utama; Ihubacter , Muribaculum , dan Cercozoa spp. merupakan genus yang paling berkorelasi dari mikrobioma.
4 Diskusi
Bahasa Indonesia: Ketika organisme memiliki pola makan terbatas, apakah ini terjadi dalam satu spesies atau, seperti pada karibu, di antara populasi atau ekotipe, peluang bahwa hilangnya habitat akan berdampak negatif pada populasi meningkat (Slatyer et al. 2013 ). Penurunan terus-menerus populasi karibu pegunungan bersalju tebal dan bersalju dangkal yang terancam punah di Kanada menyerukan penggunaan berbagai informasi dan alat untuk mendukung upaya pemulihan populasi yang sedang berlangsung. Pengalaman telah menunjukkan pentingnya kesehatan hewan dalam program pemulihan spesies yang terancam punah yang berhasil (Beckmann et al. 2022 ), dan bukti terbaru menunjukkan bahwa melestarikan pola makan alami dan menjaga mikrobioma usus yang sehat dapat meningkatkan upaya konservasi (Trevelline et al. 2019 ; West et al. 2019 ). Pertimbangan ini mungkin sangat penting untuk karibu, di mana kebutuhan pola makan dan habitat khusus yang bervariasi di antara populasi membuat setiap ekotipe sangat rentan terhadap perubahan lingkungan (Clavel et al. 2011 ). Di sini, kami menggunakan DNA metabarcoding dari pelet feses untuk meneliti variasi dalam pola makan musim dingin dan mikrobioma karibu, dan hasil kami mendukung tiga kesimpulan utama tentang ekologi karibu di salju tebal dengan implikasi untuk program penangkaran atau pemeliharaan eks-situ : (a) kami mengonfirmasi karakterisasi historis dari pola makan musim dingin berbasis lumut pohon yang sangat berbeda untuk karibu di salju tebal, yang (b) sesuai dengan mikrobioma usus unik dengan variasi tambahan di antara subpopulasi karibu di salju tebal, yang (c) tampaknya telah diubah pada karibu yang dikandangkan untuk bersalin yang dijadikan sampel untuk penelitian ini, meskipun hanya berada di dalam kandang untuk waktu yang singkat.
4.1 Pola Makan Musim Dingin dan Mikrobioma Usus Rusa Liar
Secara keseluruhan, hasil kami dari amplikon yang berfokus pada diet konsisten dengan prediksi kami bahwa diet musim dingin dan mikrobioma usus rusa kutub gunung bersalju tebal berbeda dan kurang beragam dari rusa kutub gunung bersalju dangkal. Seperti yang ditunjukkan dalam penelitian sebelumnya dari subpopulasi liar dan jinak (Cichowski 1993 ; Denryter et al. 2017 ), rusa kutub gunung bersalju dangkal mengonsumsi lumut kerak terestrial bersama dengan beberapa pohon willow, semak erikoid, dan aven gunung; untuk lumut kerak, rusa kutub ini tampaknya sangat menyukai Cladonia spp. dan, pada tingkat yang lebih rendah, Stereocaulon , dengan konsumsi Cetraria yang lebih terbatas (Gambar 2 ). Sebaliknya, rusa kutub gunung bersalju tebal mengkhususkan diri hampir secara eksklusif pada lumut kerak rambut arboreal; khususnya, data jamur menunjukkan preferensi yang kuat untuk lumut kerak Bryoria dan Nodobryoria yang berpigmen gelap dan kaya melanin daripada lumut kerak Alectoria yang kaya asam usnat . Bryoria lebih melimpah daripada Alectoria di habitat garis pepohonan yang ditempati karibu bersalju tebal dari Januari hingga April (Apps et al. 2001 ; Edwards et al. 1960 ), tetapi kami menduga bahwa rasio pembacaan sekuensing mencerminkan selektivitas makan daripada ketersediaan hijauan karena baik percobaan observasional maupun gaya kafetaria telah menunjukkan bahwa karibu lebih menyukai Bryoria dan Nodobryoria daripada Alectoria dengan margin yang lebar (Rominger dan Robbins 1996 ; Rominger et al. 1996 ). Preferensi ini mungkin berasal dari penghindaran asam usnat, metabolit berpigmen yang terlihat yang telah dilaporkan beracun bagi rusa ( Cervus canadensis ) (Cook et al. 2007 ; Roach et al. 2006 ) dan domba ( vis aries ) (Dailey et al. 2008 ) dan tidak ada di Bryoria dan Nodobryoria . Hipotesis lain adalah bahwa kandungan protein yang rendah pada Alectoria dibandingkan dengan Bryoria menyebabkan penghindaran oleh karibu (Rominger et al. 1996 ) dan rusa bagal (Robbins 1987 ). Kurangnya kesadaran akan preferensi makanan karibu mungkin menjadi alasan mengapa Alectoria diterima sebagai pakan yang dikumpulkan oleh sukarelawan untuk karibu yang dikandangkan untuk bersalin (Legebokow 2016 ), sebuah praktik yang dikonfirmasi oleh temuan kami bahwa Kandang Revelstoke adalah satu-satunya kelompok sampel yang mengandung sejumlah besar bacaan Alectoria .
Sementara data kami mengonfirmasi penghindaran lumut Alectoria , kami juga menemukan bahwa karibu salju tebal memang mengonsumsi lumut arboreal lain yang kekurangan asam usnat tetapi kurang mendapat perhatian dalam studi-studi terdahulu. Komponen-komponen makanan lain ini mencakup perwakilan dari dua kelompok morfologi lumut yang berbeda: lumut foliosa dan lumut krustosa, yang keduanya terdeteksi pada kelimpahan relatif sedang. Genus lumut daun yang paling menonjol dalam data karibu salju tebal adalah Hypogymnia, Parmelia , Platismatia , dan Lobaria . Keempat genus tersebut umum dan menghasilkan biomassa substansial di hutan yang digunakan oleh karibu salju tebal; sebagai tambahan, Platismatia sebelumnya telah terdeteksi dalam sampel rumen (Antifeau 1987 ), dan studi-studi telah mengamati Lobaria dikonsumsi di tempat-tempat makan (Edwards dan Ritcey 1960 ). Kemunculan genus crustose Lecanora yang tersebar luas di antara rusa kutub bersalju tebal menunjukkan bahwa rusa kutub yang mencari makan mengupas kulit ranting, di mana lumut seperti Lecanora circumborealis umumnya hidup berdampingan dengan Bryoria (interpretasi yang konsisten dengan kemunculan bagian tanaman berkayu dalam isi rumen; Antifeau 1987 ). Seperti yang diharapkan, sedikit pembacaan sekuensing dari rusa kutub gunung bersalju tebal yang dikaitkan dengan tanaman pakan ternak dan lumut terestrial karena jenis pakan ternak ini sebagian besar tidak tersedia dan/atau tidak tumbuh di bawah lapisan salju tebal di wilayah musim dinginnya.
Komposisi mikrobioma usus rusa kutub mengikuti ciri khas pola makan: ciri khas pola makan menjelaskan komposisi mikrobioma dalam analisis RDA, dan rusa kutub pegunungan bersalju tebal cukup berbeda dalam komposisi pola makan dan mikrobioma sehingga keduanya membentuk jaringan terpisah dalam analisis jaringan ko-kemunculan kami (Gambar 5 ). Secara keseluruhan, kami mengharapkan kelimpahan tinggi taksa fermentasi yang penting untuk pencernaan pola makan berbasis tumbuhan dan lumut kerak, yang didukung oleh dominasi umum spesies Ruminococcaceae dalam mikrobioma usus. Temuan kami selaras dengan laporan sebelumnya dari rusa kutub Norwegia ( R. t. tarandus ) (Sundset et al. 2009 ), rusa kutub Svalbard ( R. t. platyrhynchus ) (Zielińska et al. 2016 ), dan beberapa ruminansia lainnya (de Jonge et al. 2022 ; Henderson et al. 2015 ). Karibu gunung bersalju tebal dibedakan secara unik oleh kelimpahan relatif bakteri Paramuribaculum yang tinggi , dan, pada tingkat yang lebih rendah, oleh kelimpahan Colidextribacter dan Phocaeicola yang lebih tinggi . Paramuribaculum adalah genus Muribaculaceae yang baru-baru ini dideskripsikan yang dicirikan oleh ekspresi gen yang terkait dengan degradasi karbohidrat kompleks seperti kitin atau selulosa (Lagkouvardos et al. 2019 ); Colidextribacter dan Phocaeicola juga telah dikaitkan dengan fermentasi karbohidrat dan produksi asam lemak rantai pendek (Liu et al. 2022 ; Lück dan Deppenmeier 2022 ). Yang terakhir lebih melimpah pada ternak yang merumput bebas dengan diet tinggi serat (Wang et al. 2020 , 2019 ), yang menunjukkan potensi pentingnya mereka untuk degradasi polisakarida lichen kompleks.
Kami menduga bahwa mikrobioma unik ini mungkin muncul sebagian karena komposisi polisakarida yang berbeda dari lumut pohon dan lumut darat, meskipun kami tidak dapat secara langsung mengevaluasi potensi fungsional mikrobioma. Seperti yang kami harapkan, pola makan musim dingin karibu salju tebal didominasi oleh lumut dengan sebagian besar β-glukan di dinding selnya (misalnya, Bryoria ), sementara karibu salju dangkal lebih menyukai lumut dengan α-glukan (misalnya, Cladonia dan Stereocaulon ), meskipun dengan beberapa tumpang tindih antara jenis karibu dan glukan ini (misalnya, lumut Cetraria yang dikonsumsi oleh karibu salju dangkal mengandung beberapa β-glukan) (Olafsdottir dan Ingólfsdottir 2001 ). Meskipun kami menemukan korelasi kuat antara kelimpahan makanan dari lumut ini dan komponen mikrobioma tertentu (Gambar 5 ), data kami tidak memungkinkan kami untuk mengonfirmasi bahwa mikrobioma unik dari rusa kutub salju tebal didorong oleh spesialisasi mesin enzimatik untuk mencerna β-glukan. Ini karena data amplikon tidak menyediakan informasi genom secara keseluruhan yang diperlukan untuk menyimpulkan apakah genera seperti Paramuribaculum mengkode enzim yang diperlukan untuk degradasi hubungan polisakarida tertentu (Djemiel et al. 2022 ). Satu genom yang diterbitkan tersedia untuk Paramuribaculum (Low et al. 2023 ) mengandung sedikit bukti spesialisasi β-glukan (lihat Gambar S16 ); meskipun demikian, potensi enzimatik dari famili bakteri ini kurang terkarakterisasi dan dapat bervariasi di antara spesies atau galur (Lagkouvardos et al. 2019 ). Kelimpahan relatif Paramuribaculum yang sangat tinggi dalam mikrobioma karibu salju tebal menunjukkan bahwa bakteri ini dapat menjadi target penting untuk penelitian dan upaya pemantauan di masa mendatang.
4.2 Pakan Pelet Komersial dan Kandang Bersalin
Seperti yang diprediksi, rusa kutub bersalju tebal di kandang bersalin Revelstoke menunjukkan ciri-ciri pola makan dan komposisi mikrobioma usus yang sangat berbeda dari rekan-rekan mereka yang hidup bebas. Meskipun rusa kutub yang dikandangkan masih mengonsumsi Bryoria , proporsi simbion jamur lichen yang jauh lebih besar pada rusa kutub yang dikandangkan tergolong lichen foliosa dan Alectoria (Gambar 2 ). Perubahan pola makan ini dapat disebabkan oleh ketersediaan hijauan di kandang, pakan lichen yang disediakan oleh sukarelawan, atau faktor-faktor yang tidak diketahui terkait dengan kandang dan pakan komersial yang mungkin telah mengubah preferensi makan. Khususnya, rusa kutub yang dikandangkan juga tampaknya telah mengonsumsi lichen Ramalina , yang tidak terdeteksi dalam kelompok studi lain dan mengandung asam usnat (Dailey et al. 2008 ; Roach et al. 2006 ). Hasil ini mengejutkan karena lichen Ramalina jarang atau tidak ada di hutan tempat kandang itu berada (T. Spribille, pengamatan pribadi). Satu kemungkinan penjelasan untuk kemunculan DNA Ramalina dalam pelet feses Pena Revelstoke adalah bahwa Ramalina thrausta bisa saja dikumpulkan secara keliru oleh para relawan yang bermaksud mengumpulkan Alectoria sarmentosa sebagai pakan karibu, karena dapat dengan mudah tertukar dengan Alectoria dan umum di dataran rendah terdekat.
Karibu salju tebal yang dikandangkan juga tampak mengonsumsi lebih banyak tanaman daripada karibu salju tebal yang hidup bebas, karena hanya lima sampel dari individu yang hidup bebas menghasilkan rangkaian tanaman yang terdeteksi (Gambar 3 ). Yang menarik, hampir setengah dari rangkaian tanaman pada populasi kandang Revelstoke dikaitkan dengan rami ( Linum spp.), yang tidak tumbuh di area kandang. Kehadiran rami hampir pasti merupakan tanda dari pakan komersial yang diberikan kepada karibu, yang merupakan 3,5% rami menurut beratnya ( Wetaskiwin Coop Assoc. Ltd. ). Rangkaian tanaman lain yang melimpah di kandang Revelstoke dikaitkan dengan Paxistima dan Populus , yang merupakan makanan ternak umum di area kandang tersebut. Tanda-tanda pakan komersial yang disediakan di LARS (yang berisi jelai, alfalfa, dan jagung) juga dapat dideteksi pada rusa kutub LARS meskipun rangkaian ini relatif kurang melimpah dibandingkan dengan tanaman asli di area kandang LARS. Meskipun kelimpahan rangkaian tanaman pada rusa kutub di kandang Revelstoke mungkin disebabkan oleh kurangnya ketersediaan makanan lumut kerak, hal itu mungkin juga disebabkan oleh sampel feses dari rusa kutub ini dikumpulkan selama musim semi, sedangkan sampel dari rusa kutub yang hidup bebas dikumpulkan pada akhir musim dingin. Perbedaan jadwal pengumpulan ini diperlukan untuk mengumpulkan sampel dari rusa kutub yang hidup bebas selama musim pemasangan kalung GPS dan untuk menyesuaikan waktu transisi ke pola makan pelet bagi hewan yang dikandangkan. Namun, waktu ini memungkinkan rusa kutub yang dikandangkan mengonsumsi lebih banyak tanaman karena lebih banyak tanaman dengan jumlah protein yang lebih banyak tersedia sebagai makanan alami di kandang pada saat pengambilan sampel.
Mikrobioma usus rusa kutub salju tebal yang dikandangkan sangat berbeda dari rusa kutub salju tebal yang ditinggal di alam bebas, meskipun masih lebih mirip dengan spesies yang hidup di alam bebas daripada dengan rusa kutub LARS yang semi-jinak dalam analisis keragaman beta berbasis jarak (Gambar 4 ). Yang paling menonjol, rusa kutub salju tebal yang dikandangkan mengandung Paramuribaculum yang jauh lebih sedikit tetapi Muribaculum dan Duncaniella yang jauh lebih banyak . Kedua genus ini berkerabat dekat dengan Paramuribaculum dan sama-sama dikenal karena mendegradasi polisakarida kompleks (Lagkouvardos et al. 2019 ), sehingga sulit untuk mengomentari apakah atau bagaimana perbedaan taksonomi dalam komposisi mikrobioma ini dapat tercermin dalam fungsi mikrobioma atau mesin enzimatik. Memang, genom yang tersedia untuk umum dari spesies representatif dari ketiga genera ini (Beresford-Jones et al. 2022 ; Miyake et al. 2019 ; Miyake et al. 2020a , 2020b ) menunjukkan sedikit bukti spesialisasi metabolik di antara famili enzim pendegradasi karbohidrat yang terkait [yaitu, CAZymes (Cantarel et al. 2009 )] (lihat Gambar S16 ). Namun, genom yang tersedia itu tidak berasal dari spesies yang ditemukan di usus rusa kutub, dan potensi fungsional mikroba sangat bervariasi bahkan di antara spesies atau galur dari genus yang sama (Van Rossum et al. 2020 ). Oleh karena itu, menentukan apakah mikrobioma rusa kutub yang berubah mewakili beberapa kehilangan atau perolehan fungsi metabolik yang relevan dengan pencernaan atau kesehatan hewan akan memerlukan analisis fungsional atau metagenomik yang lebih terperinci.
4.3 Keterbatasan
Meskipun hasil kami sangat konsisten dengan prediksi kami bahwa (a) karibu salju tebal akan menunjukkan pola makan musim dingin berbasis lumut yang lebih sempit dan lebih arboreal daripada karibu salju dangkal, (b) mikrobioma akan mencerminkan perbedaan pola makan tersebut, dan (c) mikrobioma akan terganggu secara substansial oleh pakan pelet, desain pengambilan sampel kami memaksakan setidaknya empat batasan pada generalitas temuan ini. Pertama, kami berfokus pada pola makan musim dingin karena perbedaan yang diketahui dalam kebiasaan mencari makan musim dingin di antara subpopulasi karibu, tetapi pola makan dan mikrobioma terkait dapat bervariasi secara musiman. Karena alasan ini, sampel feses yang dikumpulkan di musim dingin untuk karibu yang berkeliaran bebas mungkin tidak sebanding dengan feses yang dikumpulkan di musim semi untuk karibu yang dikandangkan; selain itu, karibu salju tebal dan dangkal memiliki kebiasaan mencari makan yang lebih mirip di wilayah jelajah musim panas mereka (Webber et al. 2022 ). Variasi musiman dalam komposisi mikrobioma telah didokumentasikan pada rusa kutub Rusia, dan meskipun variasi ini relatif kecil (Ilina et al. 2021 ; Yildirim et al. 2021 ), pekerjaan di masa mendatang harus mengumpulkan sampel sepanjang tahun dan membandingkannya dalam dan di antara musim. Kedua, desain penelitian kami tidak memungkinkan kami untuk menentukan apakah karibu mendapatkan kembali mikrobioma tipe liar mereka saat mereka bertransisi kembali ke makanan alami sebelum dilepaskan; pengambilan sampel yang lebih luas sebelum, selama, dan setelah periode penangkapan akan menjawab pertanyaan penting ini. Ketiga, sementara ukuran sampel kami sesuai untuk menilai variasi di antara keempat kelompok penelitian kami, kami tidak dapat menilai peran potensial dari pengaruh lain yang diketahui pada pola makan dan/atau komposisi mikrobioma [misalnya, jenis kelamin, usia, atau identitas spesies (Macke et al. 2017 )] atau untuk secara kuat mengkarakterisasi variasi dalam kelompok, terutama untuk subpopulasi Selkirk Tengah yang anomali. Keterbatasan keempat adalah kami hanya memiliki sampel dari satu kandang bersalin; Studi masa depan yang membandingkan beberapa sampel dari beberapa lokasi kandang akan lebih mampu menentukan efek diet pelet pada komposisi dan fungsi mikrobioma serta sejauh mana komposisi mikrobioma di penangkaran terkait dengan kesehatan hewan atau kebugaran pasca-pelepasan.
Ada juga beberapa keterbatasan khusus untuk pendekatan metabarkode berbasis DNA. Misalnya, daya tahan DNA makanan selama pencernaan dapat bervariasi di antara jenis makanan ternak, yang akan memengaruhi perkiraan komposisi makanan kami. Lebih jauh, persentase pembacaan jamur yang ditetapkan untuk lumut bervariasi secara signifikan di antara individu dan umumnya rendah, sedangkan jamur koprofil hadir dengan kelimpahan relatif yang relatif tinggi meskipun sampel dikumpulkan segera setelah pengendapan. Dalam kasus ini, kami menduga bahwa jumlah DNA jamur condong ke organisme yang beradaptasi untuk bertahan hidup atau bahkan mendapat manfaat dari pencernaan, dan kami mencoba untuk mengurangi efek ini dengan menganalisis pembacaan lumut secara terpisah dari jamur lainnya. Terakhir, rusa gunung bersalju tebal menghasilkan pembacaan yang lebih sedikit untuk sebagian besar amplikon, yang dapat membatasi kekuatan inferensial kami. Kami mencoba untuk mengimbangi hal ini dengan mengekstrapolasi perkiraan kekayaan dan keanekaragaman dari kurva rarefaksi, mengikuti praktik terbaik untuk analisis data komposisi (Gloor et al. 2017 ), dan membandingkan hasil kami dengan data yang dijernihkan untuk memastikan bahwa kesimpulan kami kuat terhadap metode analisis yang berbeda.
5 Implikasi Pengelolaan
Meskipun ada keterbatasan yang dijelaskan di atas, hasil kami menunjukkan peran potensial bukti molekuler dalam perencanaan konservasi untuk rusa gunung dengan prinsip-prinsip yang dapat digeneralisasikan ke spesies lain. Studi kami adalah yang pertama menunjukkan bahwa, setidaknya di akhir musim dingin, rusa gunung bersalju tebal memiliki pola makan dan mikrobioma usus yang berbeda yang sedikit tumpang tindih dengan tetangga terdekatnya, rusa gunung bersalju dangkal. Kami juga menunjukkan bahwa mikrobioma usus khusus ini dapat diubah ketika rusa gunung ditempatkan di kandang bersalin dan diberi pakan komersial. Hasil kami menimbulkan pertanyaan penting apakah transisi dari pola makan alami memiliki konsekuensi bagi kesehatan, kondisi tubuh, atau kebugaran rusa gunung, yang memerlukan penelitian lebih lanjut. Meskipun demikian, kebutuhan untuk mengenali potensi kerentanan spesialis pola makan, dan kepekaan mereka yang sesuai terhadap upaya pengelolaan, menggarisbawahi tiga implikasi kehati-hatian yang dibawa hasil kami untuk upaya konservasi di masa mendatang.
Pertama, jika program penangkaran induk atau program eks situ lainnya (misalnya, penangkaran) dipertimbangkan untuk pemulihan karibu, mereka dapat memperoleh manfaat dari pertimbangan cermat tentang diet alami spesifik populasi. Misalnya, pengumpulan lumut yang lebih disukai oleh populasi target (misalnya, Bryoria daripada Alectoria ) akan mengharuskan kolektor untuk dilatih secara memadai dalam identifikasi lumut dan asosiasi habitat. Jika diet dilengkapi dengan pakan komersial, transisi ke pakan pelet dapat dibuat lebih mudah dengan komposisi pelet yang meniru komponen makanan alami sedekat mungkin; misalnya, pelet pakan dapat diformulasikan untuk mengandung jenis polisakarida yang sama dengan hijauan alami. Pertimbangan yang sama ini juga dapat menginformasikan eksperimen pemberian makanan tambahan in situ; misalnya, subpopulasi Kennedy Siding dari rusa gunung bersalju dangkal diberi pakan pelet komersial di alam liar selama 2 bulan di akhir musim gugur, sebuah intervensi yang memiliki efek positif pada kondisi tubuh, kelangsungan hidup, dan kelimpahan (Heard dan Zimmerman 2021 ; Lamb et al. 2024 ) tetapi efeknya pada komposisi mikrobioma usus tidak diketahui.
Mengingat perbedaan kuat yang kami amati antara karibu yang dikurung di salju tebal dan yang dikurung di kandang bersalin, implikasi kedua dari hasil kami adalah nilai pemantauan mikrobioma karibu yang konsisten dan jangka panjang, terutama sebelum, selama, dan setelah periode penangkaran, sebagai metrik tambahan yang dapat memandu keputusan pengelolaan. Sampel feses dapat dikumpulkan secara teratur dan non-invasif, terutama pada populasi penangkaran selama dan setelah transisi pola makan, dan beberapa laboratorium komersial mengkhususkan diri dalam memproses sampel dan data mikrobioma dengan biaya yang terjangkau. Dalam kombinasi dengan metrik kondisi tubuh lainnya, informasi rutin tentang komposisi mikrobioma dapat mendukung penyesuaian pola makan untuk mempertahankan mikrobioma hewan yang dikurung sementara (Dallas dan Warne 2023 ). Studi pemantauan jangka panjang juga dapat mengidentifikasi tingkat optimal untuk mengubah pola makan ke atau dari pakan pelet atau proporsi minimum lumut alami yang diperlukan dalam pola makan pelet serta sejauh mana komposisi mikrobioma usus terkait dengan kesehatan atau kebugaran pasca-pelepasan. Memang, pengawasan mikrobioma pra dan pasca pelepasan telah berhasil digunakan sebagai bagian dari intervensi eks situ untuk spesies terancam punah lainnya, termasuk pelatihan diet pra-pelepasan untuk mempromosikan mikrobioma tipe liar (Blyton et al. 2023 ; Chong et al. 2019 ; Yang et al. 2020 ).
Akhirnya, rentang sempit lumut kerak yang disukai oleh karibu salju tebal memperkuat pesan yang lebih luas bahwa mempertahankan populasi karibu in situ yang berkeliaran bebas akan membutuhkan perlindungan yang lebih besar terhadap habitat hutan tua yang mendukung sejumlah besar spesies lumut kerak tertentu yang dikonsumsi oleh hewan yang terancam punah ini (Holt 1977 ; Serrouya, Dickie, et al. 2021 ). Misalnya, mempertahankan beban Bryoria yang sehat dan biomassa tinggi membutuhkan tegakan hutan yang berventilasi baik (Gauslaa 2023 ; Goward 1998 ) fitur yang terkait dengan atribut usia tegakan, struktur, dan posisi lereng (Goward 1998 ; Goward et al. 2022 ). Perlindungan saat ini untuk hutan tua ini belum cukup untuk mencegah penurunan karibu (Environment Canada 2014 ). Kami menyarankan bahwa metode molekuler dapat dikombinasikan dengan model kualitas hijauan (Bishop et al. 2009 ) untuk memperkirakan jumlah tipe habitat spesifik yang diperlukan untuk mendukung populasi rusa kutub salju tebal yang mampu menopang dirinya sendiri dan memandu pembatasan aktivitas manusia di area ini berdasarkan bukti.
Masing-masing dari tiga implikasi yang kami uraikan di atas untuk konservasi karibu—pencocokan cermat pola makan liar dalam pakan hewan penangkaran, pemantauan efek transisi pola makan melalui mikrobioma, dan memastikan perlindungan atau pemulihan habitat yang memadai untuk hewan yang diperkenalkan kembali—berlaku untuk semakin banyaknya spesies yang terancam dan hampir punah yang kehilangan habitat dan degradasinya yang tak terkendali telah menciptakan kebutuhan untuk konservasi ex situ (Myers et al. 2000 ; Slatyer et al. 2013 ). Sebagai prinsip kehati-hatian, oleh karena itu kami menyarankan bahwa informasi tentang pola makan dan komposisi mikrobioma khusus populasi atau ekotipe harus dipertimbangkan ketika merancang atau mengimplementasikan program yang mengharuskan penyediaan pakan tambahan untuk hewan yang terancam punah. Mencari informasi multidisiplin yang dapat ditindaklanjuti tersebut merupakan komponen penting dari manajemen adaptif untuk mencapai tujuan konservasi di lanskap hutan (Lindenmayer et al. 2000 ).
