ABSTRAK
Nucleus Accumbens (NAc) adalah daerah otak yang penting untuk efek obat-obatan psikostimulan. Reseptor kanabinoid tipe-1 (CB 1 ), elemen utama dari sistem endocannabinoid (ECS) di otak, berpartisipasi dalam efek ini dan memodulasi fungsi sinaptik di NAc. Selain ekspresi neuronal mereka, reseptor CB 1 juga hadir dalam astrosit, di mana mereka berkontribusi pada regulasi plastisitas sinaptik dan perilaku. Namun, dampak reseptor CB 1 astroglia pada plastisitas sinaptik di NAc dan pada efek sinaptik dan perilaku yang diinduksi psikostimulan saat ini tidak diketahui. Studi ini menunjukkan bahwa amfetamin psikostimulan merusak bentuk plastisitas sinaptik yang bergantung pada reseptor CB 1 astroglia di NAc pada tikus jantan, tetapi tidak pada tikus betina. Secara konsisten, efek lokomotor amfetamin memerlukan reseptor CB 1 astroglia pada tikus jantan, tetapi tidak pada tikus betina. Hasil-hasil ini, dengan mengungkap mekanisme tak terduga yang mendasari efek amfetamin yang bergantung pada jenis kelamin, membuka jalan menuju pemahaman yang lebih baik tentang dampak beragam psikostimulan pada wanita dan pria.
1 Pendahuluan
Sebagian besar penelitian mengenai obat-obatan terlarang telah dilakukan pada hewan jantan, sementara penelitian pada hewan betina terbatas di masa lalu dan penerapan sistematisnya baru dimulai baru-baru ini (Becker dan Chartoff 2019 ; Becker dan Koob 2016 ; Calipari et al. 2017 ; Torres 2022 ). Akibatnya, sangat sedikit yang diketahui mengenai mekanisme potensial yang mendasari perbedaan yang bergantung pada jenis kelamin dalam respons terhadap obat-obatan terlarang secara umum, dan psikostimulan secara khusus (Becker dan Hu 2008 ; Cornish dan Prasad 2021 ; Torres 2022 ).
Menjadi salah satu target utama sirkuit dopamin, Nucleus Accumbens (NAc) memiliki peran penting dalam pemrosesan penghargaan dan dalam respons terhadap penyalahgunaan obat-obatan (Carlezon Jr. dan Thomas 2009 ; Lammel et al. 2014 ; Sesack dan Grace 2010 ), termasuk psikostimulan (Carboni et al. 1989 ; Heinsbroek et al. 2017 ; Luscher dan Malenka 2011 ). Aktivitas NAc sangat diatur oleh proyeksi glutamatergik yang datang dari amigdala, hipokampus, dan korteks prefrontal, yang memengaruhi neuron spinosus medium GABAergik (MSN) (Turner et al. 2018 ). Masukan glutamatergik ini mengekspresikan beberapa bentuk plastisitas yang mungkin terlibat dalam perilaku adaptif dan patologis (Heinsbroek et al. 2017 ; Jedynak et al. 2016 ; Quintero 2013 ; Turner et al. 2018 ). Selain itu, perubahan dalam plastisitas sinaptik glutamatergik terjadi setelah terpapar obat-obatan terlarang (Lee dan Dong 2011 ; Li dan Kauer 2004 ; Luscher dan Malenka 2011 ; Mameli et al. 2009 ; Schmidt dan Pierce 2010 ; Stuber et al. 2010 ). Yang penting, psikostimulan telah disarankan untuk menginduksi kadar dopamin yang lebih tinggi di NAc pada pria dibandingkan dengan wanita (Riccardi et al. 2006 ), tetapi perbedaan potensial berdasarkan jenis kelamin dalam plastisitas sinaptik terkait obat di wilayah otak ini hampir tidak diketahui (Cornish dan Prasad 2021 ; Torres 2022 ). Dengan demikian, memahami apakah dan bagaimana plastisitas sinaptik di NAc diatur secara berbeda pada subjek pria dan wanita sangat penting untuk mengurai mekanisme yang mendasari perilaku fisiologis maupun terkait obat.
Sistem endokannabinoid (ECS) dan reseptor utamanya di otak, reseptor kanabinoid tipe-1 (CB 1 ), telah muncul dalam beberapa dekade terakhir sebagai salah satu sumber modulasi terpenting dalam sistem saraf pusat (SSP) (Kano et al. 2009 ). Reseptor CB 1 fungsional hadir dalam berbagai jenis sel di seluruh otak, termasuk neuron dan glia, tetapi juga terkait dengan berbagai kompartemen subseluler seperti membran plasma dan mitokondria (Bellocchio et al. 2010 ; Benard et al. 2012 ; Gomez-Sotres et al. 2024 ; Gutierrez-Rodriguez et al. 2018 ; Hebert-Chatelain et al. 2016 ; Jimenez-Blasco et al. 2020 ; Soria-Gomez et al. 2021 ). Dengan demikian, reseptor CB 1 telah terlibat dalam banyak fungsi mulai dari pengaturan proses metabolisme seluler hingga kontrol transmisi dan plastisitas sinaptik, hingga modulasi berbagai perilaku (Busquets Garcia et al. 2016 ). ECS terlibat dalam beberapa bentuk plastisitas sinaptik di NAc (Bilbao et al. 2020 ; Covey dan Yocky 2021 ; Grueter et al. 2010 ; Kasanetz et al. 2010 ; Parsons dan Hurd 2015 ), dan gangguan pensinyalan endokannabinoid di wilayah otak ini berkontribusi pada peningkatan respons stres, keadaan emosi negatif, dan keinginan yang mendorong kecanduan (Sidhpura dan Parsons 2011 ). Namun, mekanisme seluler dan subseluler yang melibatkan reseptor CB 1 dalam plastisitas sinaptik di NAc masih sedikit diketahui. Selain itu, meskipun terdapat perbedaan yang bergantung pada jenis kelamin dalam aktivitas ECS di wilayah otak tertentu (Liu et al. 2020 ; Rubino dan Parolaro 2011 ; Wagner 2016 ), sangat sedikit yang diketahui tentang NAc.
Dengan memberikan dukungan struktural dan metabolik ke sel-sel lain, astrosit adalah pengatur utama fungsi otak (Bonvento dan Bolanos 2021 ; Chiareli et al. 2021 ). Selain itu, selama beberapa dekade terakhir, sel-sel ini muncul sebagai pengendali langsung fungsi sinaptik, menjadi pemain aktif dari apa yang disebut Sinaps Tripartit (Araque et al. 1999 ). Astrosit mengekspresikan berbagai macam reseptor fungsional yang memungkinkan mereka untuk merespons neurotransmiter yang dilepaskan oleh neuron. Pada gilirannya, astrosit melepaskan molekul neuroaktif, yang disebut gliotransmiter (Volterra dan Meldolesi 2005 ), yang merangsang reseptor pada berbagai jenis sel otak, termasuk terminal neuron pra- atau pasca-sinaptik. Melalui pelepasan gliotransmitter, astrosit dapat memodulasi aktivitas saraf dan transmisi sinaptik di beberapa area otak, sehingga secara langsung memengaruhi perilaku hewan (Araque et al. 2014 ; Covelo dan Araque 2016 ; Kofuji dan Araque 2021 ; Oliveira et al. 2015 ). Beberapa daerah di dalam sistem saraf pusat telah terbukti mengandung reseptor astrosit CB 1 yang fungsional , dan bukti yang terkumpul menunjukkan peran penting reseptor ini dalam kontribusi astrosit terhadap proses sinaptik (Covelo et al. 2021 ; Gomez-Gonzalo et al. 2015 ; Han et al. 2012 ; Martin-Fernandez et al. 2017 ; Martin et al. 2015 ; Min and Nevian 2012 ; Navarrete and Araque 2010 ; Rasooli-Nejad et al. 2014 ; Robin et al. 2018 ). Astrosit di NAc mengatur rangsangan saraf, aktivitas sinaptik, dan perilaku (Bull et al. 2014 ; Corkrum et al. 2020 ; D’Ascenzo et al. 2007 ; Fellin et al. 2007 ; Scofield et al. 2015 ; Serra et al. 2022 ), tetapi apakah dan bagaimana ini dikendalikan oleh reseptor CB 1 saat ini masih belum diketahui.
Di sini, kami menemukan bahwa reseptor CB 1 memediasi plastisitas sinaptik yang bergantung pada spike-timing (STDP) di NAc pada tikus dewasa jantan dan betina. Depresi jangka panjang yang disebabkan oleh stimulasi pra-pasca (t-LTD) (Brzosko et al. 2019 ) dimediasi oleh reseptor CB 1 astroglia dan pelepasan purin yang bekerja pada reseptor A 1 pada kedua jenis kelamin. Menariknya, kami mengamati bahwa aplikasi amfetamin memblokir t-LTD pada jantan tetapi tidak pada betina. Secara konsisten, reseptor CB 1 astroglia terlibat dalam efek perilaku amfetamin pada jantan, tetapi tidak pada tikus betina, sehingga berkontribusi pada respons dimorfik seksual terhadap psikostimulan.
2 Hasil
2.1 Depresi Jangka Panjang Bergantung pada Waktu Lonjakan (t-LTD) di Inti NAc Memerlukan Aktivitas Astrosit
Untuk mempelajari plastisitas sinaptik di NAc, kami berfokus pada plastisitas yang bergantung pada spike-timing (STDP), suatu bentuk plastisitas sinaptik jangka panjang di mana pengaturan waktu potensial aksi pra dan pasca sinaptik menentukan arah dan besarnya perubahan sinaptik (Brzosko et al. 2019 ). Kami melakukan perekaman patch-clamp whole-cell dari neuron spiny medium inti NAc (MSN) dan memantau arus pasca sinaptik rangsang (EPSC) yang ditimbulkan. STDP diinduksi dengan memasangkan stimulasi listrik pra sinaptik dengan potensial aksi pasca sinaptik (ditimbulkan oleh depolarisasi pendek 5–8 ms) dalam jendela waktu ≃10 ms (100 pasangan pada 1 Hz; Gambar 1a ). Amplitudo EPSC kemudian dipantau selama 45 menit setelah induksi STDP. Protokol pemasangan pra-pasca ini menyebabkan depresi jangka panjang (t-LTD) yang bergantung waktu secara signifikan pada tikus jantan dan betina (Gambar 1b–e ). Seperti yang diharapkan, t-LTD disebabkan oleh aktivasi berurutan yang dekat dari kompartemen pra- dan pasca-sinaptik, karena tidak ada perubahan dalam amplitudo EPSC yang diamati ketika hanya stimulasi pra- atau hanya pasca-sinaptik yang diterapkan (Gambar 1d ). Analisis koefisien variasi kuadrat (Gambar 1f ) menunjukkan bahwa t-LTD dalam inti NAc kemungkinan diekspresikan secara pra-sinaptik (Faber dan Korn 1991 ).
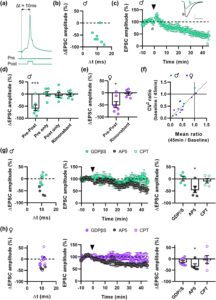
Seperti yang diharapkan (Bosch-Bouju et al. 2016 ), antagonis reseptor CB 1 Rimonabant (1 μM) memblokir t-LTD dalam irisan dari tikus jantan, tetapi juga dari tikus betina (Gambar 1d,e ), menunjukkan bahwa reseptor CB 1 diperlukan untuk bentuk plastisitas ini pada kedua jenis kelamin. Astrosit juga telah terbukti berpartisipasi dalam t-LTD di korteks dan hipokampus dengan melepaskan glutamat atau D-serin, masing-masing, untuk mengaktifkan reseptor NMDA pre-sinaptik (Andrade-Talavera et al. 2016 ; Min dan Nevian 2012 ). Untuk mengeksplorasi keterlibatan astrosit dalam t-LTD di inti NAc, kami memblokir pensinyalan Reseptor Protein-G (GPCR) astrosit dengan memuat jaringan astrosit dengan GDPβS (10 mM) (Corkrum et al. 2020 ; Covelo dan Araque 2018 ). Perawatan ini memblokir t-LTD pada tikus jantan dan betina (Gambar 1g,h ), yang menunjukkan bahwa bentuk plastisitas sinaptik ini melibatkan aktivasi astrosit. Untuk menyelidiki konsekuensi fungsional dari aktivasi tersebut, selanjutnya kami mengeksplorasi identitas gliotransmitter potensial yang terlibat. D-AP5 (100 μM), antagonis reseptor NMDA selektif, tidak memblokir plastisitas pada tikus jantan atau betina (Gambar 1g,h ), tidak termasuk keterlibatan reseptor NMDA dalam t-LTD NAc. Astrosit dalam inti NAc telah dilaporkan melepaskan purin (adenosin dan/atau ATP) yang menghambat transmisi sinaptik dengan bekerja pada reseptor adenosin A 1 penghambat (Corkrum et al. 2020 ). Secara konsisten, kami menemukan bahwa t-LTD diblokir oleh antagonis reseptor adenosin A 1 CPT (2 μM) pada irisan tikus jantan dan betina (Gambar 1g,h ), yang menunjukkan bahwa purin terlibat dalam bentuk plastisitas sinaptik NAc ini. Secara keseluruhan, data ini menunjukkan bahwa t-LTD memerlukan pensinyalan reseptor CB 1 , aktivasi astrosit, dan stimulasi reseptor adenosin A 1 pada kedua jenis kelamin.
2.2 T-LTD Dimediasi oleh Reseptor CB 1 yang Terletak di Membran Plasma Astrosit
Berikutnya, kami menyelidiki lokasi seluler dan subseluler reseptor CB 1 yang terlibat dalam t-LTD. Pada tingkat subseluler, reseptor CB 1 sebagian besar terlokalisasi di kompartemen membran plasma (pmCB 1 ). Namun, mereka juga dapat ditemukan secara intraseluler, misalnya terkait dengan membran mitokondria (mtCB 1 ), di mana mereka dapat memengaruhi fungsi seluler, sinaptik, dan perilaku (Bellocchio et al. 2010 ; Benard et al. 2012 ; Gutierrez-Rodriguez et al. 2018 ; Hebert-Chatelain et al. 2016 ; Jimenez-Blasco et al. 2020 ; Soria-Gomez et al. 2021 ). Dengan demikian, kami menggunakan galur tikus yang reseptor CB 1-nya dikecualikan dari membran mitokondria (DN22-CB 1 -KI) (Benard et al. 2012 ; Hebert-Chatelain et al. 2016 ) untuk menyelidiki apakah reseptor mtCB 1 terlibat dalam t-LTD. Bentuk plastisitas ini masih ada dalam irisan NAc yang berasal dari tikus DN22-CB 1 -KI (Gambar 2a ) tetapi diblokir oleh Hemopresin (10 μM; Gambar 2a ), antagonis reseptor CB 1 yang tidak dapat melewati membran sel (Bellocchio et al. 2010 ; Benard et al. 2012 ). Data ini menunjukkan bahwa reseptor pmCB 1 memediasi t-LTD dalam inti NAc secara independen dari reseptor mtCB 1 .
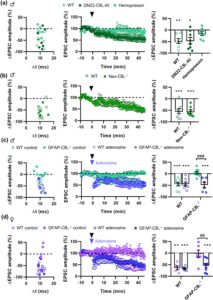
Selanjutnya kami menyelidiki lokasi seluler reseptor CB 1 yang terlibat dalam t-LTD. Pada tingkat sinaptik, pandangan klasik tentang cara kerja ECS adalah bahwa endokannabinoid dimobilisasi dari kompartemen pascasinaptik dan berjalan mundur ke sel prasinaptik, tempat mereka mengaktifkan reseptor CB 1 neuronal untuk mengurangi pelepasan neurotransmitter (Araque et al. 2017 ). Meskipun melibatkan astrosit, masih mungkin bahwa mekanisme neuronal serupa terlibat dalam t-LTD. Jadi, kami bertanya apakah reseptor CB 1 yang diekspresikan dalam akson glutamatergik yang menekan NAc berperan dalam t-LTD. Untuk menjawab pertanyaan ini, kami menggunakan galur tikus mutan yang secara spesifik kekurangan reseptor CB 1 pada neuron glutamatergik kortikal (tikus Nex-CB 1 −/− , juga dikenal sebagai Glu-CB 1 −/− ) (Bellocchio et al. 2010 ; Monory et al. 2006 ). Khususnya, tikus-tikus ini menunjukkan t-LTD normal (Gambar 2b ), yang menunjukkan bahwa reseptor CB 1 yang terletak di terminal pra-sinaptik neuron glutamatergik kortikal tidak terlibat dalam bentuk plastisitas NAc ini.
Reseptor CB 1 astrosit sebelumnya telah terbukti berpartisipasi dalam plastisitas sinaptik, termasuk STDP di neokorteks (Min dan Nevian 2012 ). Untuk mengeksplorasi apakah subpopulasi reseptor CB 1 ini terlibat dalam NAc t-LTD, kami menggunakan garis tikus transgenik yang secara spesifik tidak memiliki reseptor CB 1 dalam sel yang mengekspresikan protein asam fibrilar glia penanda astrosit (tikus GFAP-CB 1 −/− ) (Han et al. 2012 ). Yang mengejutkan, t-LTD tidak terdapat pada tikus GFAP-CB 1 −/− jantan maupun betina (Gambar 2c,d ), yang menunjukkan bahwa t-LTD memerlukan aktivasi reseptor CB 1 astrosit .
Akhirnya, kami menyelidiki apakah kurangnya pelepasan purin mungkin menjadi penyebab gangguan t-LTD pada NAc tikus GFAP-CB 1 −/− . Khususnya, aplikasi semprotan adenosin selama protokol induksi STDP menyelamatkan t-LTD pada tikus jantan dan betina GFAP-CB 1 −/− , tanpa memengaruhi plastisitas induk WT (Gambar 2c,d ). Secara keseluruhan, data ini menunjukkan gagasan bahwa t-LTD NAc dimediasi oleh aktivasi reseptor astrosit pmCB 1 , yang akhirnya menyebabkan pelepasan purin dan stimulasi reseptor adenosin A 1 .
2.3 Dinamika Kalsium Astrosit Terkait dengan Induksi t-LTD
Perubahan dalam dinamika Ca 2+ intraseluler saat ini dianggap sebagai mekanisme utama yang mendasari fungsi seluler dan sinaptik astrosit (Covelo et al. 2022 ; Guerra-Gomes et al. 2017 ). Untuk menyelidiki apakah astrosit mengalami perubahan Ca 2+ sitosol selama protokol induksi t-LTD, kami mengekspresikan sensor Ca 2+ GCaMP6f secara viral dalam astrosit (Gambar 3a ). Analisis pencitraan 2-foton langsung dari astrosit yang mengekspresikan GCaMP6f dalam irisan NAc akut dari tikus jantan dan betina mengungkapkan bahwa induksi t-LTD dikaitkan dengan peningkatan frekuensi kejadian Ca 2+ astrosit pada kedua jenis kelamin (Gambar 3b–d dan S1a ), tanpa perubahan dalam amplitudo, durasi, atau penyebaran (Gambar 3e–g dan S1b–d ). Penghambat reseptor CB 1 Rimonabant menghilangkan peningkatan frekuensi kejadian Ca 2+ yang berhubungan dengan t-LTD (Gambar 3c,d dan S1a ), menunjukkan bahwa reseptor CB 1 mengendalikan dinamika Ca 2+ astrosit setelah induksi t-LTD.

Secara keseluruhan, data elektrofisiologi dan pencitraan menunjukkan bahwa STDP mengaktifkan reseptor pmCB 1 astrosit NAc , yang memicu pensinyalan Ca 2+ intraseluler yang akhirnya mengarah pada pelepasan purin dan t-LTD.
2.4 Keterlibatan Reseptor CB 1 Astroglia yang Bergantung pada Jenis Kelamin pada Hiperlokomosi yang Diinduksi Amfetamin
Plastisitas sinaptik di NAc telah diusulkan untuk mendasari tindakan sebagian besar obat yang disalahgunakan, termasuk psikostimulan (Heinsbroek et al. 2017 ; Jedynak et al. 2016 ; Quintero 2013 ; Turner et al. 2018 ). Oleh karena itu, kami selanjutnya menyelidiki peran potensial reseptor astrosit CB 1 NAc dalam efek psikomotorik dari psikostimulan prototipe amfetamin. Untuk tujuan ini, kami menyuntikkan vektor virus adeno-asosiasi yang mengekspresikan Cre di bawah kendali promotor GFAP (AAV-GFAP-Cre) ke dalam NAc tikus CB 1 flox/flox untuk menghasilkan tikus NAc-GFAP-CB 1 −/− , yaitu, tikus yang membawa delesi reseptor spesifik astrosit di NAc (Gambar 4a ). Pada tikus NAc-GFAP-CB 1 −/− , imunopewarnaan menunjukkan bahwa hampir semua sel Cre + juga mengekspresikan penanda astrosit GFAP atau S100β, sementara hanya sedikit sel yang mengandung penanda neuronal NeuN (Gambar 4b,c ). Yang penting, virus menunjukkan efikasi yang tinggi karena sebagian besar sel yang mengekspresikan GFAP atau S100β juga mengekspresikan Cre (Gambar 4c ). Selain itu, ketika AAV-GFAP-Cre disuntikkan ke dalam NAc dari garis reporter Cre tikus Ai6 (Madisen et al. 2010 ) (Gambar S2a ) untuk memeriksa rekombinasi aktual yang disebabkan oleh ekspresi protein Cre, kami hanya menemukan rekombinasi marginal dalam sel NeuN + , sedangkan sebagian besar rekombinasi terdapat dalam astrosit (Gambar S2b ). Namun, karena beberapa ekspresi virus marginal dan rekombinasi protein masih ada di neuron NAc, kami melakukan hibridisasi fluoresensi in situ (FISH) yang dikombinasikan dengan imunohistokimia untuk mendeteksi mRNA reseptor CB 1 di NAc tikus NAc-GFAP-CB 1 −/− . Seperti yang telah dilaporkan, mRNA reseptor CB 1 jarang di inti NAc (Van Waes et al. 2012 ) dan terlokalisasi bersama dengan protein NeuN (Gambar S2c,d ), yang menunjukkan bahwa, seperti di banyak daerah otak, reseptor CB 1 dapat dideteksi dengan mikroskopi fluoresensi hanya di neuron (Busquets-Garcia et al. 2018 ), sedangkan astrosit mengekspresikan tingkat reseptor yang rendah (meskipun penting secara fungsional). Tidak ada perbedaan dalam jumlah sel CB 1 + yang ditemukan pada tikus NAc-GFAP-CB 1 −/− dan tikus yang disuntik dengan virus kontrol (Gambar S2e)). Bersama-sama, data ini menunjukkan bahwa AAV-GFAP-Cre secara spesifik diekspresikan dalam astrosit, tempat rekombinasi terutama terjadi, dan bahwa injeksi vektor virus tidak menurunkan ekspresi reseptor CB 1 neuronal pada tikus CB1 flox/flox . Yang penting, sementara astrosit NAc dari tikus yang disuntik dengan virus kontrol merespons dengan peningkatan kalsium terhadap aplikasi semprotan agonis CB 1 R WIN 55,212–2 (10 μM), astrosit dari NAc-GFAP-CB 1 −/− tidak merespons (Gambar S3 ). Namun, mereka masih menunjukkan respons kalsium yang kuat terhadap ATP (2 mM), yang menunjukkan bahwa astrosit dari tikus NAc-GFAP-CB 1 −/− tetap berfungsi tetapi secara selektif tidak memiliki respons yang diinduksi CB 1 R. Selain itu, t-LTD tidak ada pada tikus NAc-GFAP-CB 1 −/− (Gambar 4d ), yang semakin mendukung bahwa reseptor astrosit CB 1 lokal terlibat dalam jenis plastisitas sinaptik ini.
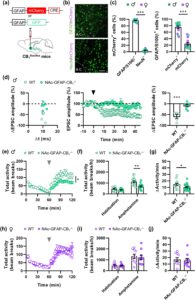
Hiperlokomosi yang diinduksi amfetamin pada tikus NAc-GFAP-CB 1 −/− jantan dan betina dipelajari dalam kandang aktimetri (Mariani et al. 2023 ). Lokomosi direkam selama periode habituasi 1 jam, setelah itu tikus disuntik secara intraperitoneal (ip) dengan amfetamin (5 mg/kg) dan lokomosinya dipantau selama satu jam lagi. Tidak ada perbedaan genotipe yang diamati selama habituasi dalam aktivitas lokomotor total pada tikus jantan atau betina (Gambar 4e,f,h,i ), yang menunjukkan bahwa mutasi tidak mengubah lokomosi basal. Pemberian amfetamin meningkatkan aktivitas lokomotor semua kelompok tikus (Gambar 4e–j ). Namun, amplitudo hiperlokomosi yang diinduksi amfetamin berkurang pada tikus NAc-GFAP-CB 1 −/− jantan dibandingkan dengan kontrol littermates (Gambar 4e–g ). Sebaliknya, tidak ditemukan perbedaan dalam hiperlokomosi yang diinduksi amfetamin pada tikus betina NAc-GFAP-CB 1 −/− dibandingkan dengan kontrol (Gambar 4h–j ), yang mengindikasikan bahwa reseptor astrosit CB 1 di NAc terlibat dalam hiperlokomosi yang diinduksi amfetamin pada jantan tetapi tidak pada betina. Yang penting, efek ini disebabkan oleh penghapusan reseptor astrosit CB 1 , karena ekspresi Cre pada astrosit dari tikus C57/Bl6 tidak berpengaruh pada hiperlokomosi yang diinduksi amfetamin (Gambar S4f,g ). Untuk menyingkirkan kemungkinan bahwa efek yang ditemukan pada tikus jantan dihasilkan oleh ekspresi marginal virus pada neuron, tikus CB 1 flox/flox jantan disuntik dengan AAV yang mengekspresikan Cre di bawah kendali promotor Syn (AAV-Syn-Cre) di NAc (NAc-Syn-CB 1 −/− ), yang mendorong ekspresi neuronal Cre (Gambar S4a,b ). FISH untuk mendeteksi mRNA reseptor CB 1 menunjukkan bahwa ekspresi CB 1 secara virtual dihapuskan di NAc pada tikus NAc-Syn-CB 1 −/− (Gambar S4c,d ). Yang penting, tikus-tikus ini tidak menunjukkan perbedaan dalam hiperlokomosi yang diinduksi amfetamin dibandingkan dengan tikus kontrol (Gambar S4e ), yang menunjukkan bahwa reseptor CB 1 neuronal di NAc tidak berkontribusi pada perilaku ini. Secara keseluruhan, hasil ini menunjukkan bahwa reseptor astrosit CB 1 di NAc terlibat dalam efek lokomotor amfetamin pada tikus jantan tetapi tidak pada tikus betina.
2.5 Dampak Amfetamin terhadap t-LTD Berdasarkan Jenis Kelamin
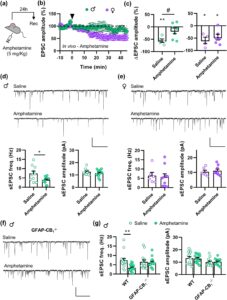
Data yang dikumpulkan sejauh ini menunjukkan bahwa t-LTD diekspresikan secara setara pada tikus jantan dan betina dan sepenuhnya bergantung pada reseptor astrosit CB 1 pada kedua jenis kelamin. Namun, hanya tikus NAc-GFAP-CB 1 −/− jantan yang menunjukkan respons hiperlokomotor yang berkurang terhadap psikostimulan amfetamin. Hasil-hasil ini menunjukkan bahwa interaksi antara amfetamin dan reseptor CB 1 mungkin berbeda pada jantan dan betina. Jadi, kami selanjutnya menyelidiki apakah psikostimulan menghasilkan efek diferensial pada t-LTD NAc pada tikus jantan dibandingkan dengan tikus betina. Untuk menguji ini secara langsung, pertama-tama kami memperlakukan tikus jantan dan betina in vivo dengan amfetamin untuk kemudian menganalisis t-LTD dalam irisan NAc (Gambar 5a ). Untuk menghindari efek perancu dari keberadaan akut obat di otak, aplikasi amfetamin in vivo dilakukan 24 jam sebelum pengorbanan dan persiapan irisan. Yang mengejutkan, perawatan ini menghapuskan t-LTD pada irisan dari tikus jantan, tetapi tidak berpengaruh pada irisan dari tikus betina (Gambar 5b,c ). Yang menarik, efek pada irisan jantan ini disertai dengan pengurangan signifikan frekuensi, tetapi bukan amplitudo, arus postsinaptik rangsang spontan (sEPSC) pada neuron NAc (Gambar 5d ). Namun, tidak ada efek seperti itu yang diamati pada irisan dari tikus betina (Gambar 5e ). Hal ini menunjukkan bahwa perawatan amfetamin in vivo mengurangi masukan sinaptik pada tikus jantan, sehingga mungkin menghalangi induksi t-LTD di NAc. Yang penting, efek ini sepenuhnya tidak ada pada tikus GFAP-CB 1 −/− (Gambar 5f,g ), yang menunjukkan bahwa reseptor astrosit CB 1 memainkan peran penting dalam regulasi plastisitas sinaptik jantan di NAc.
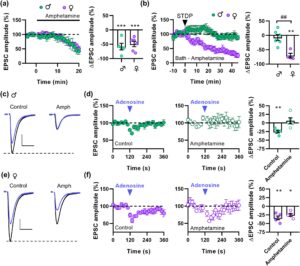
Bahasa Indonesia: Untuk menyelidiki lebih baik mekanisme akut dari efek amfetamin yang bergantung pada jenis kelamin, kami kemudian beralih ke aplikasi langsung obat ke irisan NAc. Amfetamin memiliki efek serupa pada transmisi sinaptik dalam irisan yang diperoleh dari tikus jantan dan betina (Gambar 6a ). Namun, ia sepenuhnya mereproduksi hasil yang diperoleh dengan pengobatan in vivo, dengan amfetamin menghapuskan t-LTD dalam irisan NAc dari tikus jantan, tetapi tidak memiliki efek pada irisan dari tikus betina (Gambar 6b ). Efek amfetamin pada transmisi sinaptik dan t-LTD dimediasi oleh mekanisme seluler konvergen yang melibatkan aktivasi astrosit dan pelepasan purin yang mengaktifkan reseptor A1 ( Corkrum et al. 2020 ). Oleh karena itu, ada kemungkinan bahwa amfetamin menyumbat t-LTD pada pria dengan meningkatkan saturasi reseptor ini. Untuk menguji ini, kami menilai efek sinaptik adenosin sebelum dan sesudah aplikasi mandi amfetamin. Pada irisan yang diperoleh dari tikus jantan, semprotan adenosin menyebabkan penurunan sementara transmisi sinaptik dalam kondisi kontrol, tetapi tidak berpengaruh dengan adanya amfetamin (Gambar 6c,d ). Sebaliknya, adenosin masih dapat menurunkan transmisi sinaptik dengan adanya amfetamin pada irisan dari tikus betina (Gambar 6e,f ). Yang penting, efek adenosin diblokir sepenuhnya oleh CPT (2 μM), antagonis reseptor adenosin A 1 (Gambar S5 ), yang menunjukkan bahwa efek penghambatan adenosin dalam sinaps di NAc sepenuhnya dimediasi oleh reseptor ini. Data ini menunjukkan bahwa amfetamin menyebabkan saturasi reseptor adenosin A 1 pada pria tetapi tidak pada wanita, yang mungkin mendasari efek diferensial psikostimulan yang bergantung pada jenis kelamin.
Berikutnya, kami menyelidiki apakah perbedaan yang bergantung pada jenis kelamin ini disebabkan oleh sensitivitas reseptor adenosin yang berbeda. Untuk menguji ini, kami menilai efek sinaptik dari peningkatan konsentrasi adenosin dalam irisan yang diperoleh dari tikus jantan dan betina. Peningkatan dosis adenosin secara progresif mengurangi amplitudo transmisi sinaptik rangsang yang ditimbulkan dalam irisan NAc (Gambar 7a,b ). Efek ini diparalelkan oleh peningkatan rasio pulsa berpasangan (PPR, Gambar 7c ), yang menunjukkan efek presinaptik purin. Kami menemukan bahwa dosis adenosin yang lebih rendah (1–10 μM) memberikan efek yang lebih tinggi pada pria dibandingkan dengan wanita (Gambar 7a,b ), sementara mencapai efek yang sama pada dosis tertinggi (25–100 μM), yang menunjukkan bahwa perbedaan yang ditemukan disebabkan oleh sensitivitas reseptor yang berbeda daripada ekspresi yang berbeda. Lebih jauh, kami mengevaluasi kadar protein reseptor A1 di NAc menggunakan western blot dan tidak menemukan perbedaan dalam ekspresi reseptor antara tikus jantan dan betina (Gambar S6 ). Yang penting, antagonis reseptor A1 CPT (2 μM) sama-sama meningkatkan transmisi sinaptik pada tikus jantan dan betina (Gambar 7d–f ), yang menunjukkan bahwa tonus adenosin serupa pada kedua jenis kelamin. Data ini menunjukkan bahwa neuron NAc dari tikus jantan lebih sensitif terhadap adenosin daripada yang betina.
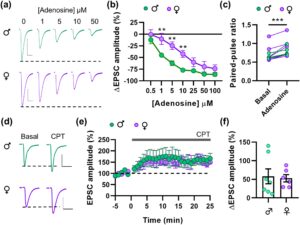
Secara keseluruhan, hasil-hasil ini menunjukkan bahwa tikus jantan berbeda dari tikus betina dalam kepekaan mereka terhadap efek penyumbatan amfetamin pada t-LTD, mungkin karena fakta bahwa reseptor adenosin presinaptik NAc mereka lebih jenuh daripada yang ada pada tikus betina.
3 Diskusi
Hasil saat ini menunjukkan bahwa reseptor CB 1 astroglia adalah elemen mekanistik kunci yang menentukan spesifisitas jenis kelamin dari efek lokomotor amfetamin. Dengan menginduksi pelepasan purin dan aktivasi reseptor A 1 , reseptor pmCB 1 astroglia memediasi t-LTD di inti NAc. Mekanisme antarsel yang diusulkan untuk bentuk plastisitas sinaptik ini analog pada tikus jantan dan betina; namun, amfetamin psikostimulan menghapuskan t-LTD di NAc pada tikus jantan tetapi tidak pada tikus betina. Secara konsisten, reseptor CB 1 astroglia NAc diperlukan untuk efek hiperlokomotor amfetamin pada tikus jantan tetapi tidak pada tikus betina. Hal ini menunjukkan bahwa meskipun reseptor CB 1 astroglia pada tikus jantan dan betina memediasi bentuk t-LTD yang setara di inti NAc, amfetamin memberikan dampak khusus jenis kelamin pada plastisitas sinaptik dan perilaku yang bergantung pada CB 1 .
Stimulasi pra-dan pasca-sinaptik berurutan yang bergantung waktu diketahui menginduksi t-LTP di hipokampus dan korteks (Brzosko et al. 2019 ) dan t-LTD di striatum (Fino et al. 2005 ) dan NAc (Bosch-Bouju et al. 2016 ). Sementara t-LTD di NAc sebelumnya telah dikaitkan dengan ECS (Bosch-Bouju et al. 2016 ), lokasi seluler dan subseluler reseptor CB 1 yang terlibat di dalamnya masih belum diketahui. Data kami menunjukkan bahwa reseptor CB 1 yang terletak di astrosit, tetapi tidak di neuron, bertanggung jawab atas induksi t-LTD di inti NAc. Baru-baru ini, lapisan kompleksitas tambahan dalam studi fungsi yang diatur ECS ditambahkan oleh penemuan reseptor CB 1 fungsional yang terkait dengan membran mitokondria (mtCB 1 ) pada neuron dan astrosit (Benard et al. 2012 ; Gutierrez-Rodriguez et al. 2018 ; Hebert-Chatelain et al. 2016 ; Jimenez-Blasco et al. 2020 ). Reseptor mtCB 1 astroglia memainkan peran kunci dalam regulasi dinamika Ca 2+ seluler yang diperlukan untuk memodulasi integrasi sinaptik di hipokampus (Serrat et al. 2021 ) dan dalam regulasi metabolisme glukosa (Jimenez-Blasco et al. 2020 ). Namun, di sini kami menemukan bahwa t-LTD dimediasi oleh reseptor pmCB 1 , yang menunjukkan bahwa kumpulan reseptor CB 1 plasma dan membran mitokondria terlibat dalam mekanisme regulasi yang berbeda.
Waktu aktivitas pra- dan pasca-sinaptik secara ketat mengontrol arah dan besarnya perubahan sinaptik yang diamati setelah induksi STDP (Brzosko et al. 2019 ). Hasil kami menunjukkan bahwa astrosit dalam inti NAc memainkan peran kunci dalam regulasi ketat ini, menjadi elemen ketiga dalam kontrol STDP dengan berkomunikasi dua arah dengan neuron pra- dan pasca-sinaptik. Hasil kami menunjukkan bahwa astrosit merespons endokannabinoid yang dilepaskan selama induksi t-LTD dengan peningkatan Ca 2+ intraseluler , diikuti oleh pelepasan purin yang bekerja pada reseptor A 1 yang kemungkinan berada di kompartemen pra-sinaptik. Mekanisme kerja ini berbeda dari yang ditemukan di korteks dan hipokampus, yang melibatkan pensinyalan reseptor NMDA (Andrade-Talavera et al. 2016 ; Min dan Nevian 2012 ). Menariknya, laporan sebelumnya menemukan bahwa astrosit dalam inti NAc dapat melepaskan purin untuk menginduksi penurunan sementara dalam transmisi sinaptik (Corkrum et al. 2020 ). Di sini kami menunjukkan bahwa kebetulan aktivitas purinergik ini dengan stimulasi neuronal menyebabkan perubahan jangka panjang dalam transmisi sinaptik. Dengan demikian, hasil kami menetapkan peran sentral bagi astrosit dalam regulasi aktif plastisitas sinaptik jangka panjang di NAc.
Amfetamin diketahui mengatur plastisitas sinaptik di daerah otak yang terkait dengan pemrosesan penghargaan, seperti NAc (Li dan Kauer 2004 ), VTA (Ahn et al. 2010 ; Jones et al. 2000 ; Medrano et al. 2021 ) dan korteks (Xu et al. 2010 ). Namun, penelitian ini dilakukan pada hewan jantan, dalam kelompok campuran, atau tidak menyebutkan jenis kelamin subjek (Ahn et al. 2010 ; Jones et al. 2000 ; Li dan Kauer 2004 ; Xu et al. 2010 ), sehingga tidak mengidentifikasi potensi perbedaan yang bergantung pada jenis kelamin. Khususnya, di sini kami menemukan bahwa t-LTD di inti NAc serupa antara jenis kelamin dalam kondisi fisiologis, tetapi diblokir oleh amfetamin hanya pada tikus jantan. Amfetamin menekan transmisi sinaptik di inti NAc dengan meningkatkan kadar dopamin yang mengaktifkan astrosit secara berlebihan, yang kemudian melepaskan purin yang menekan transmisi sinaptik dengan bekerja pada reseptor A1 ( Corkrum et al. 2020 ). Kami menemukan bahwa mekanisme kerja ini tumpang tindih dengan induksi t-LTD dan mungkin mendasari perbedaan yang ditemukan antara pria dan wanita. Dengan demikian, hasil kami menunjukkan bahwa efek amfetamin ini cukup untuk menginduksi saturasi reseptor A1 dan dengan demikian menghalangi t-LTD pada pria tetapi tidak pada wanita. Lebih jauh lagi, efek khusus jenis kelamin ini disebabkan oleh fakta bahwa reseptor adenosin pada pria lebih sensitif terhadap tindakan depresi presinaptik dari ligannya. Studi menggunakan positron emission tomography (PET) menemukan ketersediaan reseptor A1 yang lebih tinggi di otak wanita dibandingkan dengan pria (Hohoff et al. 2020 ; Pierling et al. 2021 ), yang menunjukkan bahwa perbedaan jenis kelamin mungkin ada dalam tingkat ekspresi reseptor A1 . Namun, kami tidak menemukan perbedaan dalam ekspresi reseptor ini di NAc tikus jantan dan betina, yang menunjukkan bahwa efek yang diamati mungkin disebabkan oleh sensitivitas reseptor yang lebih tinggi pada pria daripada pada wanita. Perlu dicatat, sementara efek diferensial jenis kelamin adenosin ditemukan di presinaps, kami telah mengukur tingkat ekspresi reseptor A1 di seluruh NAc. Dengan demikian, ada kemungkinan bahwa perbedaan potensial dalam tingkat presinaptik reseptor A1 telah dikacaukan oleh metodologi yang digunakan.
Perbedaan jenis kelamin telah dijelaskan untuk banyak efek obat-obatan yang disalahgunakan (Becker dan Chartoff 2019 ; Becker dan Hu 2008 ; Becker dan Koob 2016 ; Cornish dan Prasad 2021 ; Torres 2022 ). Namun, sebagian besar penelitian tentang mekanisme kerja psikostimulan telah dilakukan pada pria, sementara penelitian pada wanita telah diabaikan. ECS telah terlibat dalam respons terhadap psikostimulan dan, khususnya, terhadap efek akut amfetamin, ekspresi sensitisasi perilaku dan kekambuhan pada pria (Bonm et al. 2021 ; Corbille et al. 2007 ; Thiemann, Di Marzo et al. 2008 ; Thiemann, van der Stelt et al. 2008 ). Di sini, kami menemukan bahwa reseptor astrosit CB 1 di NAc terlibat dalam hiperlokomosi yang diinduksi amfetamin pada tikus jantan, tetapi tidak pada tikus betina. Tikus jantan CB 1 −/− konstitutif mengekspresikan amplitudo yang lebih rendah dari hiperlokomosi yang diinduksi amfetamin (Corbille et al. 2007 ; Thiemann, van der Stelt et al. 2008 ), seperti yang telah kami amati pada tikus jantan NAc-GFAP-CB 1 −/− . Menariknya, menyelamatkan CB 1 di MSN tikus CB 1 −/− tidak cukup untuk menyelamatkan hiperlokomosi yang diinduksi amfetamin (Bonm et al. 2021 ), sehingga tempat kerja kontrol efek amfetamin yang bergantung pada ECS tidak diketahui (Bonm et al. 2021 ). Dalam konteks ini, penting untuk dicatat bahwa data kami menunjukkan bahwa penghapusan neuronal global reseptor CB1 di NAc tidak mengubah efek amfetamin, yang menunjukkan bahwa MSN lokal atau interneuron tidak terlibat dalam interaksi ini. Dengan demikian, kami menunjukkan di sini bahwa ekspresi CB 1 dalam astrosit diperlukan untuk pengembangan penuh hiperlokomosi yang diinduksi amfetamin pada tikus jantan, tetapi tidak pada tikus betina. Selain itu, aktivitas Ca 2+ astrosit dan reseptor astroglia D 1 diperlukan untuk hiperlokomosi yang diinduksi amfetamin pada pria dan wanita (Corkrum et al. 2020 ). Jadi, sementara aktivitas astrosit diperlukan untuk efek perilaku amfetamin ini pada kedua jenis kelamin, efek regulasi ECS pada psikostimulan berbeda tergantung pada jenis kelamin. Menariknya, aktivasi farmakologis berulang reseptor CB 1 pada wanita menghasilkan desensitisasi dan penurunan regulasi reseptor yang lebih tinggi (Farquhar et al. 2019 ), dan mengarah pada peningkatan sensitisasi amfetamin (Lee et al. 2014).). Hal ini menunjukkan bahwa pengaturan ECS dan interaksinya dengan psikostimulan pada dasarnya berbeda antara pria dan wanita. Yang penting, perlu dicatat bahwa hormon seks, seperti estradiol, mengatur respons perilaku terhadap psikostimulan tertentu (Zovkic dan McCormick 2019 ) dan dapat berinteraksi dengan sinyal reseptor CB 1 (Potier et al. 2023 ), yang menunjukkan bahwa interaksi ini mungkin berperan dalam efek psikostimulan yang bergantung pada jenis kelamin.
Singkatnya, hasil saat ini menunjukkan bahwa reseptor CB 1 astroglia berpartisipasi dalam plastisitas sinaptik di inti NAc dengan meningkatkan kadar Ca 2+ sitosolik dan menginduksi pelepasan adenosin/ATP. Meskipun hubungan silang antarsel ini hadir pada pria dan wanita, regulasinya oleh amfetamin terjadi melalui mekanisme khusus jenis kelamin. Dengan demikian, amfetamin memblokir t-LTD pada pria tetapi tidak pada wanita, kemungkinan dengan meningkatkan saturasi reseptor adenosin A 1. Secara konsisten, reseptor CB 1 astroglia di NAc berpartisipasi dalam respons perilaku terhadap amfetamin pada pria tetapi tidak pada wanita. Memahami regulasi plastisitas sinaptik di NAc akan menjelaskan proses fisiologis yang mendasari kontrol lokomosi dan efek patologis obat-obatan terlarang. Hasil penelitian kami menunjukkan bahwa reseptor astrosit CB 1 di NAc berperan penting dalam pengaturan plastisitas sinaptik ini, serta dalam perilaku, secara khusus pada jenis kelamin, dan menunjukkan bahwa interaksi antara ECS dan amfetamin pada dasarnya berbeda pada hewan jantan dan betina.
4 Bahan dan Metode
4.1 Hewan
Semua protokol hewan sesuai dengan Pedoman Perawatan dan Penggunaan Hewan dan Arahan Dewan Komunitas Eropa tanggal 22 September 2010 (2010/63/EU, 74) dan disetujui oleh Kementerian Pertanian dan Pendidikan Prancis.
Tikus ditempatkan dalam kandang kolektif (maksimum 8 tikus per kandang) dengan siklus terang-gelap 12–12 jam (terang mulai pukul 7:00 pagi) dengan makanan dan air sepuasnya dan suhu terkontrol 21°C ± 2°C. Semua percobaan dilakukan selama periode terang. Tikus jantan dan betina mutan reseptor CB 1 konstitutif dan kondisional inbred digunakan. Kecuali dinyatakan lain, percobaan dilakukan pada tikus CB 1 flox/flox (berusia 6–12 minggu untuk elektrofisiologi dan 10–13 minggu untuk perilaku) yang membawa versi “floxed” dari gen CB 1 (Marsicano et al. 2003 ). Garis keturunan tikus Nex-CB 1 −/− yang membawa delesi kondisional gen CB 1 pada neuron glutamatergik otak depan di bawah kendali rekombinase Nex-Cre, dihasilkan dan dibiakkan sebagaimana dijelaskan sebelumnya (Bellocchio et al. 2010 ; Monory et al. 2006 ). Untuk menghasilkan garis keturunan tikus GFAP-CB 1 −/− , tikus CB1 flox/flox disilangkan dengan tikus GFAP-CreERT2 (Hirrlinger et al. 2006 ) menggunakan prosedur persilangan balik tiga langkah untuk memperoleh keturunan CB 1 flox/flox ; keturunan GFAP-CreERT2 dan CB 1 flox/flox (Han et al. 2012 ), yang disebut tikus GFAP-CB 1 −/− dan keturunan WT, masing-masing. Tikus GFAP-CB 1 −/− diobati dengan tamoxifen untuk menginduksi eksisi lokus gen CB 1 yang bergantung pada CreERT2 dan mencapai penghapusan astrosit CB 1. Tikus GFAP-CB 1 −/− dan induk WT (> 6 minggu) disuntik selama 8 hari berturut-turut dengan tamoxifen (1 mg, ip) yang dilarutkan dalam minyak wijen 90% dan etanol 10% hingga konsentrasi akhir 10 mg/mL. Hewan tersebut digunakan 4–8 minggu setelah pengobatan tamoxifen. Garis tikus DN22-CB 1 -KI, garis tikus knock-in yang menggantikan gen CB 1 tipe liar dengan bentuk terpotong dari gen CB 1 yang tidak memiliki 22 asam amino pertama yang mengurangi ekspresi terkait mitokondria (Benard et al. 2012 ; Hebert-Chatelain et al. 2016 ) dihasilkan dan dibiakkan seperti yang dijelaskan sebelumnya (Soria-Gomez et al. 2021 ). Garis tikus Ai6, garis tikus reporter yang mengekspresikan GFP ketika protein Cre hadir (Madisen et al. 2010 ) digunakan dalam kombinasi dengan injeksi GFAP-CRE AAV seperti yang dijelaskan kemudian. Masing-masing littermates tipe liar dari semua garis digunakan sebagai kontrol.
Tikus digenotipe dengan PCR pada DNA ekor menggunakan primer berikut: lokus CB 1 -flox (5′GCTGTCTCTGGTCCTCTTAAA dan 5′GGTGTCACCTCTGAAAACAGA), lokus Nex-CRE (5′TCTTTTTCATGTGCTCTTGG dan 5′CGCGCCTGAAGATATAGAAGA), lokus GFAP-CreERT2 (5′-CCT GGA AAA TGC TTC TGT CCG dan 5′-CAG GGT GTT ATA AGC AAT CCC), lokus DN22-CB 1 -KI (5′TGTGTGAATCGATAGTACTAAC dan 5′CCTGGCACCTCTTTCTCAGT).
4.2 Virus Adeno-Associated (AAV)
Vektor virus AAV8-hGFAP-mCherry-Cre (di sini disebut sebagai AAV-GFAP-Cre) dibeli dari inti vektor Universitas Carolina Utara (UNC), dan vektor virus ssAAV9/2-hGFAP-hHBbI/E-GCaMP6f-bGHp(A) (di sini disebut sebagai AAV-GFAP-GCaMP6f), v146-8 ssAAV-hSyn1-chI-EGFP-2A-iCre-WPRE-SV40p(A) (di sini disebut sebagai AAV-Syn-Cre) dan v133-8 ssAAV-hSyn1-chI-mCherry-WPRE-SV40p(A) (kontrol untuk AAV-Syn-Cre dan di sini disebut sebagai AAV-Syn-mCherry) dibeli dari Universitas Zurich. Vektor virus AAV8-hGFAP-EGFP (disebut di sini sebagai AAV-GFAP-EGFP dan digunakan sebagai kontrol untuk vektor virus AAV-GFAP-Cre) disubklon menggunakan teknik kloning molekuler standar yang sebelumnya digunakan di laboratorium (Hebert-Chatelain et al. 2016 ). Vektor yang dihasilkan diproduksi oleh transfeksi sel HEK293 yang dimediasi PEI bersama dengan plasmid pengemasan serotipe AAV8 (Hammond et al. 2017 ). Virus kemudian dimurnikan dengan gradien densitas iodixanol dan dititrasi seperti yang dijelaskan sebelumnya (McClure et al. 2011 ). Titer virus adalah 10 10 salinan genom per ml untuk AAV-GFAP-Cre dan AAV-GFAP-EGFP dan 10 11 salinan genom per ml untuk AAV-GFAP-GCaMP6f, AAV-Syn-Cre, dan AAV-Syn-mCherry.
4.3 Bedah Stereotaksis
Tikus (> 6 minggu) disuntik secara subkutan dengan buprenorfin analgesik (0,05 mg/kg, Buprecare) dan dibius dengan isoflurana (5%). Anestesi kemudian dipertahankan dengan isoflurana 2%–2,5%. Bantalan pemanas diposisikan di bawah hewan untuk menjaga suhu tubuh pada 37°C selama semua langkah pembedahan. Dehidrasi mata dicegah dengan aplikasi topikal gel oftalmik. Kulit di atas tengkorak dicukur dengan pisau cukur dan didisinfeksi dengan betadine. Tikus ditempatkan ke dalam peralatan stereotaxic (Model 900, David Kopf Instruments) dengan adaptor tikus dan batang telinga lateral. Analgesia lokal diberikan dengan lidokain (0,1 mL pada 0,5%, Lidor) sebelum sayatan. Kulit dan periosteum dipisahkan dengan hati-hati dan dijaga agar tetap terhidrasi dengan garam selama durasi pembedahan. Dua lubang dibor di tengkorak. Vektor virus (1 μL) disuntikkan secara bilateral menggunakan spuit Hamilton yang dipasang pada jarum ukuran 29 dengan laju 0,2 μL/menit. Konstruksi virus ditargetkan ke astrosit NAc tikus CB 1 flox/flox menggunakan koordinat berikut (dari bregma): anterior-posterior +1,50 mm; medial-lateral +/− 0,75 mm; dorsal-ventral -4,50 mm. Setelah penyuntikan, virus dibiarkan berdifusi selama minimal 5 menit sebelum spuit ditarik. Tikus dijahit, disuntik intraperitoneal dengan meloxicam antiinflamasi nonsteroid (5 mg/kg, Metacam) untuk analgesia, dan dibiarkan dalam inkubator pada suhu 37°C hingga mereka benar-benar sadar. Tikus diobati dengan meloxicam (5 mg/kg, Metacam) selama 2 hari setelah operasi, dan pemulihan serta pertambahan berat badan yang tepat dipantau selama 4–6 hari setelah operasi. Tikus digunakan untuk percobaan ≥ 4 minggu setelah operasi stereotaxic.
4.4 Persiapan Irisan Otak Akut
Hewan untuk percobaan elektrofisiologi diambil dari kandang kolektif. Dalam percobaan tertentu, hewan ditempatkan selama 1 jam di kandang baru, diobati dengan amfetamin (5 mg/kg) atau garam, dan ditempatkan kembali di kandang kolektif setelah satu jam. Tikus dikorbankan dengan pemenggalan kepala, dan otak segera diambil dan ditempatkan dalam larutan pemotongan dingin yang mengandung (dalam mM): KCl 2,5, NaH 2 PO 4 1,25, NaHCO 3 26, CaCl 2 0,2, MgCl 2 12, sukrosa 180, dan glukosa 11 (pH = 7,3–7,4). Irisan koronal setebal 350 μm yang mengandung inti NAc dibuat dengan vibratom (Leica VT 1200S) dan dimasukkan ke dalam cairan serebrospinal buatan (ACSF) yang mengandung (dalam mM): NaCl 123, KCl 2,5, NaH 2 PO 4 1,25, NaHCO 3 26, CaCl 2 2,5, MgCl 2 1,3, dan glukosa 11 (pH = 7,3–7,4). Irisan diinkubasi dalam ACSF pada suhu 34°C selama 30 menit dan kemudian pada suhu kamar selama > 30 menit. Baik larutan pemotongan maupun ACSF terus-menerus dioksigenasi dengan karbogen (95% O 2 /5% CO 2 ). Irisan ditempatkan dalam ruang perekaman imersi dan disuperfusi (2 mL/menit) dengan ACSF beroksigen dan divisualisasikan dengan mikroskop Olympus tegak dengan iluminasi inframerah untuk perekaman elektrofisiologi atau mikroskop Femtonics FEMTO3D-RC 2-foton untuk pencitraan Ca 2+ .
4.5 Elektrofisiologi
Rekaman elektrofisiologi sel utuh dari MSN dan astrosit dalam inti NAc dibuat dalam konfigurasi voltage-clamp. Untuk rekaman neuronal, elektroda patch-clamp memiliki resistansi 4–6 MΩ saat diisi dengan larutan internal yang mengandung (dalam mM): K-glukonat 135, KCl 10, HEPES 10, EGTA 1, MgCl 2 2, CaCl 2 0,3, ATP-Mg +2 3, GTP-Na + 0,3, dan fosfokreatin 7 (pH = 7,3). Untuk rekaman astrosit, elektroda patch-clamp memiliki resistansi 6–10 MΩ saat diisi dengan larutan internal yang mengandung (dalam mM): KMeSO 4 100, KCl 50, HEPES-K 10, dan ATP-Na +2 4 (pH = 7,3). GDPßS (10 mM) dimasukkan ke dalam pipet patch astrosit untuk mencegah pensinyalan intraseluler yang dimediasi protein G pada astrosit. Astrosit ditempelkan selama minimal 15 menit untuk memungkinkan dialisis GDPßS di seluruh jaringan astrosit yang terhubung dengan gap-junction. Kemudian, MSN dalam bidang pandang yang sama direkam dengan patch-clamp untuk memantau EPSC (Corkrum et al. 2020 ).
Rekaman diperoleh dengan amplifier Multiclamp 700B (Molecular devices). Potensial membran dipertahankan pada −80 mV untuk neuron dan astrosit. Resistansi seri dan input dipantau sepanjang percobaan menggunakan pulsa −5 mV, dan sel dibuang saat berubah > 20%. Sinyal diumpankan ke PC melalui papan antarmuka DigiData 1440A (Molecular devices). Sinyal difilter pada 1 KHz dan diperoleh pada laju pengambilan sampel 10 KHz. pCLAMP 10.4 (Axon instruments) digunakan untuk pembangkitan stimulus, tampilan data, akuisisi, dan penyimpanan.
4.6 Stimulasi Sinaptik dan Induksi STDP
Arus sinaptik dibangkitkan menggunakan kapiler theta bipolar yang diisi dengan ACSF yang ditempatkan di inti NAc. Pulsa berpasangan (durasi 2 ms dengan interval 50 ms) dihantarkan secara terus-menerus pada 0,33 Hz menggunakan unit isolasi DS2A-Mk. II (Digitimer Ltd). Arus pascasinaptik eksitatori (EPSC) diisolasi menggunakan picrotoxin (50 μM) dan CGP5462 (1 μM) untuk memblokir reseptor GABA A dan GABA B.
Selama induksi STDP, neuron direkam dalam penjepit arus. Untuk induksi STDP, protokol pra-pasca digunakan: stimulasi sinaptik diterapkan diikuti oleh depolarisasi singkat yang menimbulkan potensial aksi tunggal (jendela waktu ≃10 ms antara stimulasi sinaptik dan potensial aksi). 100 pasangan pra-pasca diterapkan pada 1 Hz. Amplitudo EPSC rata-rata dasar diperoleh dengan merata-ratakan nilai rata-rata yang direkam dalam 10 menit dari dasar. Kemudian, amplitudo EPSC dikelompokkan dalam wadah waktu 1 menit dan dinormalisasi ke dasar. Keberadaan t-LTD ditetapkan dengan membandingkan EPSC yang dinormalisasi yang direkam selama dasar dan 45 menit setelah induksi STDP.
Untuk aplikasi semprotan adenosin eksogen (250 μM), pipet kaca borosilikat yang berisi obat ditempatkan di atas inti NAc, dan adenosin diaplikasikan dengan denyut tekanan (0,5 bar) selama protokol induksi STDP (Gambar 2 ) atau selama 5 detik (Gambar 6 ). Untuk respons dosis adenosin (Gambar 7 ), peningkatan konsentrasi adenosin diaplikasikan dalam bak mandi.
Untuk percobaan yang menilai efek adenosin yang dioleskan pada transmisi sinaptik, amplitudo EPSC dikelompokkan dalam kelompok waktu 15 detik dan EPSC yang diperoleh 2 menit sebelum dan 30 detik setelah pemberian amfetamin dibandingkan. Untuk percobaan yang menyelidiki efek adenosin yang dioleskan pada bak mandi pada transmisi sinaptik, amplitudo EPSC 5 menit sebelum dan 10 menit setelah pemberian adenosin dibandingkan. Untuk percobaan yang mempelajari efek amfetamin (10 μM) atau CPT (2 μM) pada transmisi sinaptik, amplitudo EPSC dikelompokkan dalam kelompok waktu 1 menit dan EPSC yang diperoleh 5 menit sebelum dan 25 menit setelah pemberian amfetamin atau CPT dibandingkan.
4.7 Pencitraan Ca 2+
Perubahan kadar Ca 2+ pada astrosit yang terletak di inti NAc dipantau dengan mikroskopi 2-foton menggunakan indikator Ca 2+ GCaMP6f. Irisan divisualisasikan dengan kamera sCMOS (Hamamatsu Orca Flash 2.8), elektroda stimulasi dipasang di inti NAc, dan MSN dijepit untuk menginduksi STDP seperti dijelaskan di atas. Akuisisi 2-foton GCaMP6f dilakukan menggunakan mikroskop Femtonics FEMTO3D-RC dengan lensa objektif perendaman air 20X (Olympus). Sampel disinari menggunakan laser femtodetik Coherent Chameleon Vision 2 dan dipindai dengan pemindai galvanometrik. Gambar diambil setiap 0,55–0,66 detik dengan ukuran piksel 0,3–0,6 μm.
Analisis gambar dilakukan menggunakan makro ImageJ (NIH) kustom (tersedia di Zenodo: DOI: 10.5281/zenodo.11922155 ) (Serrat et al. 2021 ). Astrosit dianggap mengalami peristiwa Ca 2+ ketika fluoresensi meningkat lebih dari 4 kali deviasi standar fluoresensi latar belakang. Peristiwa Ca 2+ dideteksi dan dianalisis dalam 3D (x, y, t). Untuk setiap peristiwa Ca 2+ , amplitudo, frekuensi, durasi, dan koefisien penyebaran (jarak x maks * jarak y maks) dihitung.
Untuk percobaan yang menilai respons astrosit terhadap WIN dan ATP, astrosit divisualisasikan menggunakan mikroskop Olympus tegak yang disinari dengan CooLED, dan gambar diperoleh pada 10 Hz. Analisis gambar dilakukan menggunakan Aplikasi MATLAB khusus (tersedia di Zenodo: 10.5281/zenodo.14999462 dan di halaman GitHub tommigara/Mandrake) yang digunakan untuk mendeteksi daerah minat aktif (ROI), ekstraksi, koreksi, dan normalisasi jejak fluoresensi, dan deteksi peristiwa Ca 2+ . ROI aktif diperiksa secara manual, dan jejak tanpa puncak yang terdeteksi dikecualikan. Waktu terjadinya peristiwa Ca 2+ ditentukan pada awal peristiwa Ca 2+ . Peristiwa Ca 2+ yang direkam dari 30 hingga 100 ROI aktif dalam bidang pandang dikelompokkan ke dalam bin 10 detik. Setiap ROI diberi nilai 0 untuk bin tanpa respons dan 1 untuk bin di mana peristiwa Ca 2+ terjadi. Terakhir, probabilitas kejadian Ca 2+ dihitung sebagai jumlah peningkatan Ca 2+ di setiap kelompok waktu dibagi dengan jumlah total ROI aktif (Covelo dan Araque 2018 ).
4.8 Hiperlokomosi yang Disebabkan Amfetamin
Untuk menilai efek lokomotor yang disebabkan oleh amfetamin, kami menggunakan peralatan Actimeter (Imetronic, Marcheprime) (Mariani et al. 2023 ) yang terdiri dari rak berventilasi aluminium yang dilapisi pelat PVC. Rak tersebut berisi 8 kotak tunggal (kandang actimetry), berukuran 30 × 16 × 11cm. Setiap kotak dilengkapi dengan sensor inframerah untuk mendeteksi aktivitas lokomotor saat sinar terputus. Rak tersebut terhubung ke antarmuka elektronik yang menerima informasi dari sensor inframerah dan memungkinkan komunikasi dengan komputer.
Tikus dibiasakan dengan ruang pengujian selama minimal 45 menit. Setelah periode ini, tikus ditempatkan dalam satu kotak dan pergerakan basalnya direkam selama 1 jam (pembiasaan). Kemudian, tikus menerima suntikan amfetamin (5 mg/kg, ip), dan pergerakannya direkam selama 1 jam (pengujian).
Perangkat lunak Imetronic menyimpan data sebagai beam-breaks/5 menit. Aktivitas lokomotor dinyatakan sebagai aktivitas total, yang sesuai dengan aktivitas total selama 1 jam perekaman, atau sebagai Δaktivitas/menit, yang dihitung dengan mengurangi aktivitas/menit selama 15 menit terakhir fase pembiasaan (rentang waktu di mana lokomosi yang disebabkan oleh eksplorasi lingkungan baru distabilkan) dari aktivitas/menit yang direkam selama periode pasca-injeksi total. Outlier (1 dari 19 tikus WT jantan) dan tikus yang tidak responsif terhadap amfetamin (aktivitas penggerak lebih tinggi selama pembiasaan daripada setelah injeksi amfetamin: 3 dari 19 tikus WT jantan, 2 dari 12 tikus WT betina, 1 dari 22 tikus NAc-NAc-GFAP-CB 1 −/− jantan dan 3 dari 13 tikus NAc-GFAP-CB 1 −/− betina) dikeluarkan dari penelitian ini.
4.9 Perfusi dan Krioseksi
Tikus dibius dengan campuran segar pentobarbital (300 mg/kg) dan lidokain (30 mg/kg) dan diperfusi transkardial dengan 20 mL larutan penyangga fosfat (PBS 0,1 M, pH 7,4) diikuti oleh 50 mL paraformaldehida 4% dingin (PFA, Sigma, HT501128-4 L). Setelah perfusi, otak diekstraksi dan difiksasi ulang dalam larutan fiksatif yang sama semalaman pada suhu 4°C. Otak kemudian ditanamkan dalam sukrosa 30% (Sigma, S0389) selama 3 hari, dibekukan dalam isopentana (Sigma, M32631) dan disimpan pada suhu -80°C. Krioseksi koronal otak serial (30 μm) dari NAc dipotong dalam kriostat (Leica, CM1950S) dan dikumpulkan dalam larutan antibeku (dalam 0,2 M penyangga fosfat H 2 PO 4 − /HPO 4 −2 : 20% v/v gliserol; 30% v/v Etilen glikol). Sampel disimpan pada suhu -20°C hingga digunakan lebih lanjut.
4.10 Imunofluoresensi
Dua imunofluoresensi dilakukan untuk melihat ekspresi Cre dan neuron atau astrosit. Oleh karena itu, kriosesi dipermeabilisasi dan diblokir selama 1 jam pada inkubasi RT dengan larutan pemblokiran (dalam PBS 1X: 10% serum keledai; 0,3% triton X-100). Setelah itu, irisan diinkubasi semalam pada suhu 4°C dengan campuran antibodi primer. Campuran 1: anti-NeuN tikus (1:500; Millipore, MAB377) dan anti-DSred kelinci (1:1000; Takarabio, 632.496); atau Campuran 2: anti-GFAP ayam (1:500, Abcam ab4674), anti-S100β tikus (1:500; Sigma, S2532) dan anti-DSred kelinci (1:1000; Takarabio, 632.496). Setelah beberapa kali pencucian dengan PBS 1X, jaringan diinkubasi selama 2 jam pada suhu RT dengan campuran antibodi sekunder: Campuran 1: keledai anti-tikus AF 488 (1:500, Invitrogen) dan kambing anti-kelinci AF 546 (1:500, Invitrogen); atau Campuran 2: kambing anti-ayam AF 647 (1:500, Invitrogen), keledai anti-tikus AF 488 (1:500, Invitrogen) dan kambing anti-kelinci AF 546 (1:500, Invitrogen). Semua antibodi disiapkan dalam larutan pemblokiran, dan inti diwarnai dengan DAPI (1:20000 yang disiapkan dalam PBS). Irisan dipasang, dikeringkan, ditutup dengan kaca penutup, dan dicitrakan dengan mikroskop multi-foton Leica SP5.
4.11 Hibridisasi In Situ Bebas-Mengambang dan Imunofluoresensi
Peroksidase endogen dari krioseseksi diinaktivasi dengan 3% H 2 O 2 yang diencerkan dalam PBS-DEPC selama 30 menit pada suhu RT. Kemudian, irisan diinkubasi selama 20 menit pada suhu RT dalam 0,2 mM HCl-DEPC diikuti oleh langkah asetilasi selama 10 menit dengan 0,1 M trietanolamin-HCl (pH 8) dan 0,25% anhidrida asetat. Riboprobe CB1-DIG antisense (1:1000) (Marsicano dan Lutz 1999 ) digunakan untuk mendeteksi mRNA CB 1 tikus , dan riboprobe CB1-DIG sense (1:1000) (Marsicano dan Lutz 1999 ) digunakan sebagai kontrol negatif. Irisan dihibridisasi semalaman pada suhu 60°C dengan probe CB1-DIG sense atau antisense. Setelah itu, potongan diinkubasi selama 2 jam pada suhu RT dengan antibodi POD anti-DIG domba (1:1500, Roche 11.207.733.910) diikuti oleh inkubasi selama 10 menit dengan TSA Plus FITC (1:100, Akoya biosciences, NEL741001KT). Setelah itu, potongan dipermeabilisasi dan diblokir selama 1 jam pada suhu RT dalam larutan pemblokiran. Setelah itu, irisan diinkubasi semalaman pada suhu 4°C dengan campuran antibodi primer: anti-NeuN tikus (1:500, Millipore, MAB377) dan anti-GFP kelinci (1:1000, Chemicon, A11122). Setelah beberapa kali pencucian, potongan diinkubasi selama 2 jam pada suhu kamar dengan antibodi sekunder keledai anti-tikus AF 555 (1:500, Invitrogen A31570) dan kambing anti-kelinci AF 488 (1:500, Invitrogen A11008). Semua antibodi disiapkan dalam larutan pemblokiran, dan inti diwarnai dengan DAPI (1:20000 dalam PBS). Akhirnya, potongan dipasang, dikeringkan, ditutup dengan kaca penutup, dan dicitrakan dengan mikroskop multi-foton Leica SP5. Semua larutan DEPC memiliki konsentrasi DEPC 5% v/v.
4.12 Penyakit Western Blot
Tikus CB 1 flox/flox jantan dan betina yang naif dieutanasia dengan dislokasi serviks, otak diekstraksi dan NAc dibedah dengan cepat menggunakan matriks otak koronal, dan diproses seperti yang dijelaskan sebelumnya (Mariani et al. 2023 ; Vallee et al. 2014 ). Sampel jaringan segera dibekukan dalam es kering dan disimpan pada suhu -80°C. Sampel kemudian dihomogenisasi menggunakan Tissue Lyser (Quiagen, Hilden, Jerman) dalam buffer lisis (0,05 M Tris–HCl pH 7,4, 0,15 M NaCl, 0,001 M EDTA, 10% Gliserol, 1% Triton X-100) yang mengandung inhibitor protease (Roche, Basel, Swiss). Setelah 10 menit inkubasi pada suhu 4°C, sampel disentrifugasi (12.500 rpm, 10 menit, 4°C). Uji protein Bradford dilakukan pada fraksi yang dilarutkan untuk mengukur kandungan protein. Sampel kemudian dicampur dengan denaturasi 4× Laemmli loading buffer (250 mM Tris–HCl, 40% Gliserol, 8% SDS, 5% β-Mercaptoethanol, 0,2% Bromophenol blue) dan dipanaskan pada suhu 37°C selama 30 menit. Sampel dianalisis pada gel poliakrilamid pracetak 4%–20% (Bio-Rad, Hercules, California) dan dipindahkan ke membran PVDF 0,45 μm (Merk Millipore, Burlington, MA). Membran diblokir dalam campuran salin yang dibuffer Tris dan polisorbat 20 (20 mM Tris–HCl pH 7,6, 150 mM NaCl, 0,05% Tween 20) yang mengandung 5% susu bubuk tanpa lemak selama 1 jam pada suhu kamar. Untuk imunoblotting, antibodi terhadap Adora1AR (AAR-006; 1:500, ON pada suhu 4°C, Alomone Labs, Israel) dan tubulin (#3873; 1:5000, 1 jam RT, Cell Signaling Technology, Danvers, MA) digunakan. Sinyal dideteksi dengan antibodi terkait HRP (1:2000, Cell Signaling Technology, Danvers, MA) dan divisualisasikan dengan deteksi kemiluminesensi yang ditingkatkan (Clarity Western ECL Substrate, Bio-Rad, Hercules, California). Gambar diambil pada ChemiDoc Touch (Bio-Rad, Hercules, California) dan dianalisis menggunakan perangkat lunak Image Lab (Bio-Rad, Hercules, California).
4.13 Statistik
Untuk mengkaji keberadaan atau ketiadaan plastisitas sinaptik pada setiap kondisi eksperimen, digunakan uji- t berpasangan yang membandingkan nilai awal dengan 45 menit pasca-induksi STDP. Seperti yang dilaporkan sebelumnya, beberapa neuron mengalami potensiasi jangka panjang (3 dari 64 sel yang direkam dari tikus WT dalam kondisi kontrol) (Ji dan Martin 2012 ) dan dikecualikan ketika mereka secara statistik merupakan outlier (4 dari 177). Keberadaan outlier ditentukan menggunakan uji ROUT ( Q = 1%). Efek adenosin pada t-LTD pada tikus GFAP-CB 1 −/− dan efek perilaku amfetamin dibandingkan menggunakan ANOVA dua arah dengan uji post hoc Sidak. Laporan lengkap dari nilai p yang ditemukan untuk setiap uji statistik dapat ditemukan di Tabel S1 . Data dinyatakan sebagai mean ± sem (kesalahan baku mean). Ambang batas statistik yang digunakan adalah * p < 0,05, ** p < 0,01, dan *** p < 0,001.
