ABSTRAK
Ekosistem lahan basah menghadapi tingkat kerusakan dan degradasi yang mengkhawatirkan, yang menimbulkan tantangan signifikan bagi populasi burung yang bergantung pada habitat ini. Kesehatan burung terkait erat dengan komposisi mikrobiota usus mereka, yang terutama dipengaruhi oleh kondisi lokal, terutama melalui makanan. Berdasarkan pekerjaan kami sebelumnya yang mengidentifikasi variasi makanan di antara populasi burung di rawa-rawa dalam situs Ramsar di sepanjang sungai Somme dan Avre (Prancis), studi percontohan ini bertujuan untuk menilai relevansi penggunaan sampel tinja yang dikumpulkan dari tanah untuk mengkarakterisasi mikrobiota usus burung melalui metabarkode 16S rRNA. Kami berhipotesis bahwa metode pengambilan sampel noninvasif ini akan menangkap bagaimana sifat burung dan faktor lingkungan membentuk komposisi mikrobiota tinja. Pengambilan sampel dilakukan selama musim kawin di tujuh lokasi (enam di dalam situs Ramsar dan satu di pinggirannya) yang mencakup lingkungan pedesaan atau pinggiran kota. Sebanyak 52 sampel tinja dari sembilan spesies atau famili burung, terutama burung air, dianalisis untuk komposisi bakteri. Pada tingkat filum, Firmicutes dan Proteobacteria dominan, dengan kelimpahan relatif genus seperti Clostridium , Rothia , Bacillus , Caldilinea , dan Pseudomonas bervariasi di antara spesies burung. Enteropatogen potensial Campylobacter terutama terdeteksi dalam sampel dari lokasi peri-perkotaan. Analisis multivariat mengungkapkan variasi signifikan dalam komposisi bakteri yang terkait dengan serikat trofik burung, ekologi, panjang tubuh, permukaan kolam, dan lokasi habitat. Selain itu, korelasi lemah diamati antara filogeni inang dan komposisi mikrobiota. Meskipun ukuran sampel yang terbatas, terutama untuk beberapa spesies, membatasi ketahanan temuan ini, tren yang diamati selaras dengan ekspektasi ekologis. Studi ini menyoroti potensi sampel feses yang dikumpulkan secara oportunistik sebagai alat berdampak rendah untuk mengeksplorasi hubungan antara mikrobiota usus burung dan habitatnya.
1 Pendahuluan
Mikrobiota usus burung memainkan peran penting dalam berbagai proses fisiologis, termasuk perkembangan usus, pencernaan, pengecualian patogen, fungsi imun dan perilaku (Waite dan Taylor 2014 ; Grond et al. 2018 ; Sun et al. 2022 ). Selain itu, plastisitas metagenom usus dianggap memfasilitasi aklimatisasi ekologis yang cepat dan adaptasi organisme inang terhadap perubahan lingkungan (Alberdi et al. 2016 ). Komunitas mikroba yang terkait dengan inang mengikuti prinsip ekologi yang sama dengan sistem makro-ekologi (Costello et al. 2012 ), di mana interaksi mikroba (misalnya, kompetisi, kerja sama, dll.) dan faktor lingkungan membentuk komposisi bakteri usus. Faktor-faktor ini mungkin intrinsik bagi inang, seperti genetika, usia, jenis kelamin, golongan trofik, dan status kesehatan, atau ekstrinsik, termasuk diet, interaksi sosial dan paparan terhadap sumber mikroba lingkungan (Grond et al. 2018 ).
Di antara faktor-faktor intrinsik, filogeni inang umumnya dianggap sebagai prediktor lemah keragaman mikrobiota usus pada burung (Capunitan et al. 2020 ; Song et al. 2020 ), berbeda dengan mamalia, di mana kofilogeni sangat memengaruhi komposisi mikrobiota (Youngblut et al. 2019 ). Perbedaan ini mungkin sebagian dijelaskan oleh adaptasi terhadap penerbangan, seperti yang disarankan oleh konvergensi mikrobiota usus pada burung dan kelelawar (Song et al. 2020 ). Tuntutan metabolik yang tinggi dari penerbangan kemungkinan memaksakan tekanan selektif yang mendukung mikrobiota yang mengoptimalkan ekstraksi energi sambil meminimalkan beban pencernaan. Burung dan kelelawar juga menunjukkan waktu retensi usus yang pendek karena adaptasi morfologi, seperti saluran usus yang relatif pendek, yang selanjutnya dapat memengaruhi komposisi mikrobiota (Song et al. 2020 ). Pada burung pengicau, Bodawatta, Koane, et al. ( 2021 ) melaporkan korelasi negatif antara waktu retensi usus dan keragaman mikroba serta heterogenitas mikrobiota kloaka di 17 spesies.
Sebaliknya, guild trofik telah diidentifikasi sebagai prediktor kuat komposisi mikrobiota usus pada burung (Bodawatta, Koane, et al. 2021 ; Jarma et al. 2021 ; Wang, Zhong, et al. 2022 ). Pada vertebrata, preferensi makanan membentuk guild fungsional mikroba yang membantu nutrisi inang (Youngblut et al. 2019 ). Pada burung, sebuah studi perbandingan menemukan bahwa burung air migrasi herbivora dan karnivora memiliki jaringan mikroba yang kurang beragam dan kompleks daripada omnivora, dengan integrasi dan stabilitas yang lebih rendah (Wang, Zhong, et al. 2022 ). Namun, hubungan antara taksa bakteri tertentu dan guild trofik tetap kompleks dan tidak eksklusif. Sementara pola umum ada (misalnya, bakteri pencerna serat pada herbivora), redundansi fungsional dan variabilitas antarindividu mempersulit identifikasi taksa khusus guild yang ketat. Lebih jauh lagi, relung ekologi burung dapat berkontribusi pada kompleksitas ini, karena penggunaan habitat (misalnya, akuatik, terestrial, dan arboreal) telah terbukti memengaruhi komposisi mikrobiota usus di seluruh ordo burung (Wang, Hong, et al. 2022 ; Jones et al. 2023 ). Namun, dalam beberapa penelitian ini, interpretasi menjadi tantangan karena pengambilan sampel dilakukan di penangkaran (misalnya, kebun binatang), di mana komposisi mikrobiota mungkin berbeda secara signifikan dari populasi liar (Wienemann et al. 2011 ; Xie et al. 2016 ).
Di antara faktor ekstrinsik yang terkait dengan relung ekologi, pola makan merupakan pendorong utama struktur mikrobiota usus. Studi eksperimental pada burung pengicau telah menunjukkan bahwa pola makan memengaruhi keragaman mikroba, komposisi taksonomi, dan profil fungsional (Davidson et al. 2020 ; Teyssier et al. 2020 ; Bodawatta, Freiberga, et al. 2021 ). Pemindahan bakteri melalui jaringan trofik, dari produsen primer ke konsumen sekunder, berkontribusi pada variasi mikrobiota pada burung (Dion-Phénix et al. 2021 ; Bodawatta, Klečková, et al. 2022 ). Namun, kekuatan efek ini bervariasi antar spesies, yang menggarisbawahi kompleksitas interaksi ini (Perry et al. 2017 ; Davidson et al. 2020 ; Teyssier et al. 2020 ; Bodawatta, Freiberga, et al. 2021 ). Komposisi mikrobiota usus juga dapat berubah secara musiman sebagai respons terhadap perubahan pola makan dan habitat yang terkait dengan migrasi, reproduksi atau fluktuasi lingkungan (Tang et al. 2023 ; Zhang et al. 2025 ).
Aktivitas antropogenik selanjutnya memengaruhi pola makan burung dan, akibatnya, mikrobiota usus. Konversi habitat, seperti penggundulan hutan untuk pertanian, sering kali menurunkan kualitas habitat, yang menyebabkan pergeseran komposisi dan keanekaragaman mikrobiota burung pengicau, meskipun ada kerentanan khusus spesies (Teyssier et al. 2018 , 2020 ; San Juan et al. 2020 ). Demikian pula, hilangnya lahan basah dan perubahan penggunaan lahan telah memaksa banyak burung air untuk bergantung pada habitat buatan (misalnya, lahan basah perkotaan, area pengolahan air limbah, lingkungan yang tercemar, tempat pembuangan sampah), di mana ketersediaan makanan yang berubah, termasuk sumber daya yang disediakan manusia, memengaruhi pola makan mereka (Murray dan Hamilton 2010 ; Brochet et al. 2012 ; Wang, Kuang, et al. 2018 ; Evans dan Gawlik 2020 ; Murray et al. 2020 ). Beberapa penelitian menunjukkan bahwa paparan terhadap lingkungan ini mengubah mikrobiota usus burung air dan meningkatkan kolonisasi oleh patogen bakteri potensial (Murray et al. 2020 ; Jarma et al. 2021 ; Wang et al. 2023 ). Misalnya, Bangau Siberia ( Leucogeranus leucogeranus ) yang terancam punah baru-baru ini mengubah pola makannya di Tiongkok selatan, mengganti umbi-umbian air dengan tanaman pertanian. Transisi pola makan ini telah mengakibatkan perubahan mikrobiota, dengan bangau pemakan umbi-umbian menunjukkan pengayaan Clostridiaceae pencerna serat, sementara individu pemakan tanaman pangan memiliki mikrobiota yang lebih beragam, termasuk bakteri pemetabolisme karbohidrat dan patogen potensial (Wang et al. 2023 ). Demikian pula, burung ibis putih Amerika ( Eudocimus albus ) yang tinggal di perkotaan dan mengonsumsi roti yang kaya karbohidrat alih-alih makanan alami berprotein tinggi menunjukkan perubahan mikrobiota usus yang signifikan, yang berpotensi meningkatkan kerentanan mereka terhadap patogen enterik seperti Salmonella (Murray et al. 2020 ).
Seiring dengan ekosistem yang mengalami perubahan lingkungan yang cepat, biologi konservasi menjadi semakin relevan di era Antroposen. Penelitian terkini menyoroti pentingnya studi mikrobiota usus untuk upaya konservasi (Trevelline et al. 2019 ; Sehnal et al. 2021 ). Analisis mikrobiota usus dapat mengidentifikasi disbiosis, yaitu ketidakseimbangan mikroba yang terkait dengan berbagai faktor, termasuk gangguan lingkungan, dan dapat membantu mengembangkan metrik baru untuk menilai kualitas habitat dan efektivitas pemulihan. Memahami bagaimana kualitas habitat memengaruhi komposisi komunitas mikroba dan penularan patogen pada burung liar dapat memberikan wawasan berharga untuk strategi konservasi (Bodawatta, Hird, et al. 2022 ).
Studi ini bertujuan untuk menilai kelayakan penyelidikan faktor-faktor yang membentuk komposisi mikrobiota usus burung dalam ekosistem lahan basah menggunakan metabarkode 16S rRNA dan pendekatan pengambilan sampel feses oportunistik noninvasif, di mana kotoran burung dikumpulkan langsung dari tanah tanpa identifikasi spesies atau pengetahuan pasti tentang waktu pengendapan. Secara khusus, kami mengevaluasi apakah metode ini dapat menangkap pengaruh filogeni, sifat inang (panjang tubuh sebagai proksi panjang usus, ekologi: terestrial vs. akuatik, dan serikat trofik), dan faktor lingkungan (pola makan, tipe habitat: perkotaan vs. pedesaan, dan struktur habitat: ukuran kolam) pada struktur mikrobiota. Pendekatan ini dapat memberikan alat yang menjanjikan dan noninvasif untuk studi ekologi dan evolusi skala besar, khususnya di area konservasi kritis di mana metode pengambilan sampel tradisional mungkin tidak praktis.
2 Bahan dan Metode
2.1 Deskripsi Lapangan
Wilayah studi, yang terletak di Prancis Utara (Kawasan Biogeografi Atlantik), meliputi lahan basah di bagian hilir Sungai Somme dan Sungai Avre (Gambar 1 ). Meliputi luas 13.100 ha, situs yang dirancang Ramsar ini, “Rawa dan Lahan Gambut Lembah Somme dan Avre”, merupakan salah satu lahan gambut alkali terbesar di Eropa Barat (François 2023 ) dan mendukung keanekaragaman hayati yang signifikan (Stroud dan Davidson 2021 ).
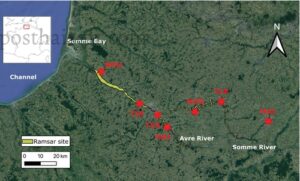
Tidak seperti Picardy Littoral (Teluk Somme), yang menjadi rumah bagi lebih dari 20.000 burung air (Kriteria Ramsar 5), Somme pedalaman menampung populasi yang lebih kecil (Schmaltz et al. 2020 ), termasuk spesies yang tercantum dalam Daftar Merah nasional, seperti teal umum yang rentan ( Anas crecca ) dan bittern Eurasia ( Botaurus stellaris ), serta bittern kecil yang terancam punah ( Ixobrychus minutus ) dan warbler Savi ( Locustella luscinioides ) (lihat: https://www.somme.fr/plan-gestion-ramsar/ ). Lahan basah ini bertindak sebagai reservoir keanekaragaman hayati di tengah aktivitas manusia yang intens seperti berburu, memancing, hiking, dan berkano. Menurut kartografi Corine Land Cover, situs tersebut terutama terdiri dari badan air dan rawa-rawa (44%), dengan tekanan perkotaan yang signifikan dan pertanian intensif di dekatnya.
Enam rawa di dalam situs Ramsar dipantau, bervariasi dalam tingkat dampak manusia (Tabel 1 ) dan kekayaan serta kepadatan populasi burung air, bersama dengan Cagar Alam Nasional di dekatnya (“Marais d’Isle”). Ini termasuk dua taman kota (Marais des Trois Vaches dan Parc de la Bouvaque), kolam pedesaan yang besar (Marais de Cléry-sur-Somme) dan tiga rawa yang lebih kecil dan lebih terisolasi (Marais de Hailles, Marais de Morcourt, Marais de Tirancourt). Menurut basis data observasi satwa liar kolaboratif Clicnat , yang dikelola oleh LSM “Picardie Nature” (Amiens, Prancis) ( https://clicnat.fr ), spesies burung air berkembang biak utama di lokasi pengambilan sampel termasuk dalam famili Anatidae (misalnya, teal umum, Anas crecca ; pochard umum, Aythya ferina ; dan mallard dan Anas platyrhynchos ), Ardeidae (misalnya, kuntul besar, Ardea alba ; bangau abu-abu, Ardea cinerea ; dan bittern kecil, Ixobrychus minutus ) dan Rallidae (misalnya, moorhen umum, Gallinula chloropus ; dan coot Eurasia Fulica atra ). Untuk daftar spesies yang lebih lengkap, lihat Fablet et al .
TABEL 1. Informasi tentang lokasi pengambilan sampel. Tujuh rawa yang dijadikan sampel bervariasi dalam hal lokasi geografis (pedesaan atau perkotaan), penggunaan antropik, dan luas permukaan kolam, yang memberikan wawasan tentang keanekaragaman habitat.
| Nama situs | Singkatan | Kota | Lokasi geografis | Letak geografis | Sungai | Penggunaan antropik | Total permukaan kolam (ha) |
|---|---|---|---|---|---|---|---|
| Taman Bouvaque | BUNGA | Abbeville | 50°6′59″ LU, 1°50′34″ BT | Pinggiran kota | Scardon | Taman kota, memancing | 7.7 |
| Marais dari Clery-sur-Somme | Bersih | Kepulauan Clery-sur-Somme | 49°57′14″ LU, 2°53′44″ BT | Pedesaan | Somme | Perburuan unggas air, memancing | 46.2 |
| Marais de Hailles | HAI | Salam | 49°48′31″ LU, 2°25′23″ BT | Pedesaan | Segera | Perburuan unggas air, memancing | 7.1 |
| Marais dari Pulau | MAI | Kota Saint-Quentin | 49°50′36″ LU, 3°18′22″ BT | Pinggiran kota | Somme | Taman kota, Cagar Alam Nasional | 14.6 |
| Marais dari Morcourt | LEBIH BANYAK | Morcourt | 49°53′47″ LU, 2°39′53″ BT | Pedesaan | Somme | Perburuan unggas air, memancing | 12.4 |
| Marais de Tirancourt | TIR | Tirancourt | 49°56′23″ LU, 2°10′52″ BT | Pedesaan | Somme | Perburuan unggas air | 9.2 |
| Marais des Trois Vaches | PPN | Kota Amiens | 49°52′38″ LU, 2°20′22″ BT | pinggiran kota | Segera | Taman kota, memancing |
2.2 Pengambilan Sampel
Bakteri feses banyak digunakan sebagai proksi untuk mikrobiota usus untuk menghindari pengorbanan hewan. Mikrobiota feses dianggap sebagai campuran bakteri dari berbagai bagian saluran pencernaan dan juga dapat dipengaruhi oleh kontaminasi lingkungan (Grond et al. 2018 ). Selama musim kawin (19–30 April 2021), kami secara oportunistik mengumpulkan 146 kotoran burung di seluruh rawa, mengambil sampel setiap lokasi hanya sekali untuk meminimalkan gangguan (lihat Tabel 2 ). Untuk mengurangi replikasi semu, di area dengan kepadatan kotoran yang lebih tinggi, kami mengambil sampel di titik-titik yang dipisahkan oleh setidaknya 2 m (Jarma et al. 2024 ). Sampel dikumpulkan antara pukul 8:00 pagi dan 12:00 siang, ketika suhu berkisar antara 3°C hingga 11°C. Kotoran segar dipilih berdasarkan penampilannya (kering atau lembap, utuh) menggunakan sarung tangan non-talc dan penyeka kapas steril, kemudian dimasukkan ke dalam kantong plastik, segera disimpan dalam pendingin, dan dibekukan pada suhu -20°C pada malam yang sama. Kotoran tersebut kemudian diawetkan pada suhu -80°C hingga ekstraksi DNA. Kondisi lapangan dan metode penyimpanan dapat memengaruhi hasil analisis mikrobiota feses burung berbasis gen 16S rRNA secara signifikan, terutama memengaruhi kelimpahan relatif filum dominan seperti Firmicutes dan Proteobacteria (Vargas-Pellicer et al. 2019 ).
TABEL 2. Jumlah sampel yang dimasukkan dalam analisis per spesies burung dan lokasi pengambilan sampel. Spesies burung sebelumnya diidentifikasi menggunakan metabarkode (Fablet et al. 2024 ).
| Lokasi | Jumlah sampel | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Anas platyrhynchos | Jawab Jawab | Ardea cinerea | Columba palumbus | Cygnus berwarna | Fulika atra | Gallinula kloroplas | Bunga Phasianus colchicus | Turdidae | |
| BUNGA | 2 | 3 | 9 | 1 | |||||
| Bersih | 1 | 1 | 2 | 4 | 3 | ||||
| HAI | 1 | 2 | |||||||
| MAI | 1 | 1 | 2 | 1 | 3 | 1 | 2 | ||
| LEBIH BANYAK | 2 | 1 | 2 | 2 | |||||
| TIR | 1 | ||||||||
| PPN | 2 | 2 | |||||||
Spesies burung diidentifikasi melalui analisis metabarkode dari sampel feses. Meskipun kami tidak melakukan survei burung standar sebelum pengambilan sampel, kami mencatat spesies burung yang diamati selama kerja lapangan. Kecuali burung pegar biasa, semua spesies yang dideteksi oleh metabarkode juga diamati secara langsung. Selain itu, seperti yang dirinci dalam Fablet et al. ( 2024 ), setiap spesimen feses difoto dan dibandingkan dengan panduan lapangan untuk jejak burung, yang mengonfirmasi konsistensi antara identifikasi visual dan hasil metabarkode. Anak burung jarang diamati, dan kami tidak mengambil sampel langsung di bawah sarang. Ukuran dan penampilan feses yang dikumpulkan konsisten dengan burung dewasa.
2.3 Ekstraksi DNA, Identifikasi Spesies Burung (12S rRNA) dan Analisis Mikrobiota Bakteri (16S rRNA) Menggunakan High-Throughput Sequencing
Kami mengekstrak DNA menggunakan DNeasy mericon Food kit (Qiagen, Jerman) (Fablet et al. 2024 ), dengan lisis mekanis melalui pembekuan nitrogen dan manik zirkonium 3 mm (Fisher Scientific, Amerika Serikat) dalam Mixer Mill MM 400 (Retsch GmbH, Jerman) selama 2 × 45 detik pada 30 Hz. Untuk meminimalkan kontaminasi, kami mengekstrak sebanyak mungkin bahan feses bagian dalam, menghindari lapisan luar yang terpapar lingkungan (Jarma et al. 2024 ). Dari 146 sampel, ekstraksi DNA berhasil untuk 116 sampel, sedangkan sampel yang tersisa tidak mencukupi atau hilang karena masalah teknis. Di antara 116 sampel, 74 berhasil diperkuat dengan PCR untuk identifikasi spesies burung menggunakan pasangan primer MiBird-U (Tabel 3 ). Kondisi siklus termal terdiri dari denaturasi awal (15 menit pada suhu 95°C), diikuti oleh 35 siklus (30 detik pada suhu 94°C, 40 detik pada suhu 50°C, dan 60 detik pada suhu 72°C), dan perpanjangan akhir (10 menit pada suhu 72°C). Rendahnya keberhasilan amplifikasi sebagian besar disebabkan oleh keberadaan asam urat dalam feses burung, yang menghambat reaksi PCR (Fablet et al. 2024 ).
TABEL 3. Urutan dan suhu pemanasan pasangan primer DNA yang digunakan untuk PCR. Basa yang mengalami degenerasi ditandai dengan huruf tebal. Pasangan primer dirancang untuk mengamplifikasi daerah tertentu, termasuk gen 12S rRNA mitokondria burung dan daerah hipervariabel V4 bakteri dari gen 16S rRNA.
| Nama primer | Taksa target | Gen target | Jenis primer | Urutan primer (5′–3′) | Suhu anil (°C) | Sumber |
|---|---|---|---|---|---|---|
| MiBird-UF | Burung | mt12S rRNA | Maju | GGGTTGGTAAATCTTGTGCCAGC | 50 | Ushio dkk. ( 2018 ) |
| MiBird-UR | Burung | mt12S rRNA | Balik | KATAGTGGGGGTATCTAATCCAGTTTG | 50 | Ushio dkk. ( 2018 ) |
| Tahun Anggaran 515 | Bakteri | Wilayah 16S rRNA V4 | Maju | GTG dan CAGC M GCCGCGGTAA | 53 | Parada dan kawan-kawan ( 2016 ) |
| 806RB | Bakteri | Wilayah 16S rRNA V4 | Balik | GGACTAC NV GGGT DI TCTAAT | 53 | Apprill dkk. ( 2015 ) |
Keanekaragaman mikroba dinilai menggunakan primer yang menargetkan wilayah hipervariabel V4 dari gen 16S rRNA bakteri: 515FY (maju) dan 806RB (mundur) (Tabel 3 ; Apprill et al. 2015 ; Parada et al. 2016 ). Setiap ekstrak DNA menjalani amplifikasi PCR rangkap tiga dalam volume 25 μL menggunakan kit PCR QIAGEN Multiplex (Qiagen, Jerman). Kondisi termosiklus untuk amplifikasi bakteri 16S meliputi denaturasi awal (15 menit pada suhu 95°C), diikuti oleh lima siklus (30 detik pada suhu 94°C, 40 detik pada suhu 50°C, dan 60 detik pada suhu 72°C), kemudian 30 siklus (30 detik pada suhu 94°C, 40 detik pada suhu 53°C, dan 60 detik pada suhu 72°C), dan perpanjangan akhir (10 menit pada suhu 72°C). Produk PCR dikumpulkan dalam volume yang sama dan dimurnikan dengan Wizard SV Gel dan PCR Clean-Up Systems (Promega Corporation, Amerika Serikat).
Percobaan ini mencakup beberapa kontrol: dua kontrol ekstraksi DNA negatif (CEXT), dua kontrol aerosol (TAER), dan dua kontrol PCR (CPCR) untuk memantau kontaminasi (Lihat Tabel S1 ; Corse et al. 2017 ). Selain itu, untuk melacak positif palsu yang disebabkan oleh lompatan tag (Schnell et al. 2015 ), tiga blanko bioinformatika (BLNK; kombinasi tag yang tidak digunakan) disertakan, bersama dengan kontrol positif (CPOS), yang terdiri dari komunitas tiruan dari NGS Standard: 20 Strain Even Mix Genomic Material—MSA-1002 (ATCC, Amerika Serikat; lihat Tabel S1 ).
Untuk pengurutan berthroughput tinggi, pendekatan PCR dua langkah dan berekor digunakan untuk membangun pustaka amplikon berpasangan yang siap dikumpulkan (Illumina Inc., Amerika Serikat). Persiapan pustaka, kualifikasi, kuantifikasi, dan pengurutan dilakukan di iGenSeq ICM (Paris Brain Institute, Prancis) menggunakan Sistem Illumina NovaSeq 6000 (Illumina Inc., Amerika Serikat) dengan kartrid siklus SP-500 (2 × 250 bp, 800 juta pembacaan berpasangan). Plot kualitas urutan per basa untuk kumpulan data bakteri ditunjukkan pada Gambar S1 .
2.4 Analisis Bioinformatika Data Metabarkode
Data sekuensing mentah tersedia untuk umum di https://doi.org/10.5281/zenodo.14883869 . Data sekuensing dianalisis di platform Argaly (Sainte-Hélène-du-lac, Prancis). Bacaan berpasangan mentah disusun, ditetapkan ke replikasi PCR yang sesuai, dan didereplikasi menggunakan rangkaian program OBITools v.4 (Boyer et al. 2016 ). Pada tahap ini, file dari tiga pustaka digabungkan, dan sekuens yang mengandung nukleotida yang tidak ditentukan, yang lebih pendek dari 18 bp (di luar rentang panjang yang diamati secara silico ), dan yang diamati hanya sekali dalam seluruh kumpulan data disaring. Sekuens yang tersisa dikelompokkan dalam Molecular Operational Taxonomic Units (MOTUs) menggunakan metode pengelompokan SumaClust (Mercier et al. 2013 ) dengan ambang pengelompokan 97%. Urutan yang paling melimpah dalam setiap klaster dipilih sebagai representatifnya. Hanya MOTU dengan sedikitnya 10 pembacaan dalam satu replikasi PCR yang disimpan untuk penugasan taksonomi, yang dilakukan menggunakan program ecotag (OBITools v. 2). Program ini membandingkan setiap MOTU dengan basis data referensi dari urutan metabarcode lengkap yang diperoleh dari basis data urutan publik GenBank (versi 249). Urutan referensi diekstraksi dari GenBank menggunakan primer penanda dan program ecoPCR (Ficetola et al. 2010 ), yang memungkinkan hingga tiga ketidakcocokan per primer. Urutan yang dihasilkan kemudian didereplikasi dan difilter untuk hanya mempertahankan urutan dengan penugasan taksonomi setidaknya ke tingkat famili, genus, atau spesies.
Bahasa Indonesia: Setelah penugasan taksonomi, penyaringan data tambahan dilakukan di R menggunakan paket metabaR (Zinger et al. 2021 ) untuk menghapus MOTU dengan identitas sekuens < 90% relatif terhadap sekuens apa pun dalam basis data referensi (kemungkinan chimera) dan MOTU yang kelimpahannya tertinggi dalam setidaknya satu replikasi kontrol negatif (kemungkinan kontaminan). Selain itu, ketika kelimpahan relatif MOTU dalam replikasi PCR < 0,1% dari total kelimpahannya di seluruh kumpulan data, kelimpahan relatif ini ditetapkan ke 0 untuk mengurangi efek lompatan tag, yang terjadi karena sekuens chimeric selama amplifikasi PCR ketika kombinasi tag yang berbeda digabungkan (Schnell et al. 2015 ). Replikasi PCR dengan pembacaan kurang dari 10.000 dihapus, dan replikasi yang tersisa dari sampel yang sama digabungkan. MOTU dengan kurang dari 100 pembacaan dalam sampel memiliki kelimpahannya dikurangi menjadi 0. Langkah-langkah dan ambang batas ini didasarkan pada tiga replikasi yang berisi DNA dengan komposisi yang diketahui (CPOS) untuk memaksimalkan persentase sekuens yang sesuai dengan taksa bakteri yang diharapkan dalam komunitas akhir (Tabel S1 ). Jumlah pembacaan dan MOTU pada setiap langkah pemrosesan dan penyaringan data, dari data mentah hingga hasil akhir, ditunjukkan pada Tabel S2 . Meskipun metode penyaringan diterapkan, beberapa MOTU yang berasal dari kontrol negatif tidak dapat sepenuhnya dihapus. Untuk menghindari penggelembungan dataset secara artifisial, MOTU yang ditemukan dalam kontrol negatif dan yang tidak sesuai dengan taksa bakteri dibuang. Namun, kami mengakui bahwa proses penyaringan tidak sempurna dan memutuskan untuk menggunakan dataset untuk menganalisis keragaman beta, tetapi bukan keragaman alfa, dari komunitas bakteri.
2.5 Analisis Statistik
Semua analisis dilakukan menggunakan R 4.2.3 (Tim Inti R 2022 ). Mikrobiota feses dinyatakan sebagai kelimpahan bacaan relatif, dihitung sebagai rasio jumlah bacaan untuk takson tertentu terhadap jumlah bacaan total per sampel.
Kesamaan mikrobiota antara spesies burung dan/atau lokasi dinilai menggunakan Non-metric Multidimensional Scaling (NMDS) dengan ketidakmiripan Bray-Curtis, menerapkan akar kuadrat dari kelimpahan bacaan relatif untuk mengurangi representasi berlebihan dari taksa yang paling melimpah. Analisis dilakukan menggunakan fungsi metaMDS dari paket R VEGAN (Dixon 2003 ). Nilai stres di bawah 0,1 dianggap sebagai indikasi representasi spasial yang baik, sementara nilai di atas 0,2 menunjukkan representasi yang buruk (Clarke 1993 ). Dispersi dievaluasi menggunakan jarak ke centroid. Koordinat centroid dihitung untuk setiap spesies burung dengan merata-ratakan koordinat titik menggunakan fungsi kmeans di R. Jarak antara titik observasi dan centroidnya kemudian dihitung sebagai akar kuadrat dari selisih kuadrat yang dijumlahkan.
Perbedaan mikrobiota yang signifikan diuji menggunakan PERmutational Multivariate ANalysis Of VAriance (PERMANOVA) berdasarkan matriks jarak, dengan mempertimbangkan tujuh prediktor: spesies burung, ekologi (burung air atau darat), panjang tubuh dan guild trofik (lihat Tabel 4 untuk karakteristik burung), serta lokasi pengambilan sampel, lokasi lokasi pengambilan sampel (pinggiran kota versus pedesaan) dan permukaan kolam (lihat Tabel 1 ). Pengujian ini dilakukan menggunakan fungsi adonis2 dari paket R VEGAN. Perbandingan berpasangan antara spesies atau lokasi dilakukan menggunakan permutasi MANOVA dengan fungsi pairwise.perm.manova dari paket RVAideMemoire R (Hervé 2020 ). Perbedaan dalam dispersi dan kelimpahan bacaan relatif dianalisis menggunakan uji Levene, analisis varians (ANOVA) dengan fungsi aov di R, dan perbandingan post hoc dengan fungsi TukeyHSD di R.
TABEL 4. Karakteristik sembilan spesies burung yang termasuk dalam analisis.
| Bebek Mallard | Angsa Abu-abu | Bangau abu-abu | Merpati kayu biasa | Angsa Bisu | Burung coot eurasia | Burung Moorhen Biasa | Burung pegar biasa | Burung hitam biasa | |
|---|---|---|---|---|---|---|---|---|---|
| Nama ilmiah | Anas platyrhynchos | Jawab Jawab | Ardea cinerea | Columba palumbus | Cygnus berwarna | Fulika atra | Gallinula kloroplas | Bunga Phasianus colchicus | Turdus merula |
| Ekologi | Burung air | Burung air | Burung air | Terestrial | Burung air | Burung air | Burung air | Terestrial | Terestrial |
| panjang badan (cm) | 65 | 89 | 98 | 45 | 160 | 39 | 38 | 71 | 27 |
| Makanan utama (gilda trofik) | Omnivora | Herbivora | Karnivora | Herbivora | Herbivora | Herbivora a | Omnivora | Omnivora | Omnivora |
| Status migrasi | Potensi migrasi | Terutama bermigrasi | Tidak banyak bergerak | Menetap dan bermigrasi | Tidak banyak bergerak | Terutama tidak banyak bergerak | Menetap dan bermigrasi | Tidak banyak bergerak | Terutama tidak banyak bergerak |
Bakteri patogen potensial diidentifikasi berdasarkan referensi yang dipublikasikan tentang patogen burung (Grond et al. 2018 ; Boukerb et al. 2021 ; Bodawatta, Hird, et al. 2022 ). Perbedaan statistik dalam prevalensi genus patogen antara sampel feses yang dikumpulkan di daerah pinggiran kota dan pedesaan diuji menggunakan uji Mann–Whitney, dengan signifikansi statistik ditetapkan pada p < 0,05.
Untuk mengeksplorasi perbedaan dalam komposisi komunitas bakteri, peta panas kluster dibuat menggunakan paket R heatmaply (Galili et al. 2018 ). Ko-evolusi bakteri-inang dinilai melalui filosimbiosis dengan mengkorelasikan jarak filogenetik inang (TimeTree; Kumar et al. 2022 ) dengan jarak dendrogram mikrobiota melalui uji Mantel (Mantel 1967 ). Korelasi peringkat Spearman diterapkan, dengan 10.000 permutasi, menggunakan fungsi mantel dari paket VEGAN.
Akhirnya, analisis korespondensi kanonik (CCA) digunakan untuk mengintegrasikan data diet dan mikrobiota (Choi et al. 2022 ). Fungsi cca dari paket R VEGAN digunakan dengan kelimpahan bacaan yang ditransformasikan secara logaritma untuk analisis set data keseluruhan. Variabel penjelas mencakup tujuh prediktor yang disebutkan di atas, bersama dengan kekayaan diet pada tumbuhan dan invertebrata, dan rasio invertebrata/tumbuhan dalam diet. Dua variabel terakhir diturunkan dari data diet yang diperoleh melalui metabarcoding, menggunakan sampel yang sama seperti penelitian saat ini (Fablet et al. 2024 ). Pemilihan variabel untuk CCA disempurnakan menggunakan regresi bertahap dua arah, dan signifikansi model dievaluasi dengan uji permutasi model regresi menggunakan fungsi anova.cca .
3 Hasil
Pengambilan sampel feses burung dilakukan di enam lokasi dalam situs Ramsar dan satu di pinggirannya (MAI) pada Musim Semi 2021 (Gambar 1 dan Tabel 1 ). Identifikasi spesies burung dari sampel feses dilakukan menggunakan metabarcoding dalam penelitian sebelumnya (Tabel S3 ; Fablet et al. 2024 ). Kami mengurutkan bagian dari wilayah hipervariabel 4 (V4) dari 16S SSU rRNA bakteri dari 74 sampel feses dari 13 spesies burung (Tabel S4 ). Namun, hanya 52 sampel dari sembilan spesies atau famili burung yang dapat dimasukkan dalam kumpulan data untuk analisis selanjutnya (Tabel 2 ). Akibatnya, kumpulan data akhir terbatas ukurannya, yang membatasi kekuatan statistik analisis kami. Penghapusan 22 sampel dari dataset disebabkan oleh spesies burung yang tidak teridentifikasi ( n = 16), spesies atau famili contoh tunggal ( n = 5: satu common Snipe, Gallinago gallinago ; satu water rail, Rallus aquaticus ; satu European Green Woodpecker, Picus viridis ; satu Rallidae; dan satu Laridae) dan tidak adanya MOTU dalam satu sampel (HAI_008). Ke-52 sampel feses yang teridentifikasi terutama berasal dari burung air (69%), dengan famili Rallidae (Eurasian coot dan common moorhen) mencakup 40% dari total, famili Anatidae (mallard, mute swan dan graylag goose) mencakup 19%, dan grey heron mewakili 10%. Setelah langkah penyaringan pertama menggunakan rangkaian program OBITools, dataset bakteri terdiri dari 13.963 MOTU. Setelah langkah penyaringan kedua, dengan menerapkan ambang batas yang ditetapkan dari kontrol positif dan negatif, tersisa 2442 MOTU. Dari jumlah tersebut, 74% diidentifikasi pada tingkat famili, 57% pada tingkat genus, dan 41% pada tingkat spesies.
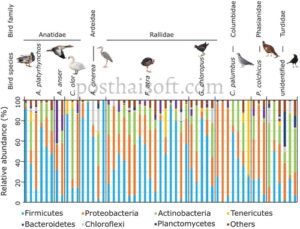
Pada tingkat filum, mikrobiota feses burung didominasi oleh Firmicutes dan Proteobacteria, dengan kelimpahan relatif Actinobacteria yang lebih rendah (Gambar 2 ). Analisis PERMANOVA menunjukkan perbedaan signifikan dalam komposisi bakteri dalam mikrobiota feses, dengan variasi terutama dikaitkan dengan spesies burung, menjelaskan 26% dari varians ( p = 0,005). Di antara berbagai variabel sifat burung yang diuji (ekologi, serikat trofik, panjang tubuh, ordo taksonomi dan famili), serikat trofik menyumbang 12% dari variasi ( p = 0,001). Namun, uji perbandingan berpasangan tidak mengungkapkan perbedaan signifikan dalam filum bakteri antara pasangan spesies burung.
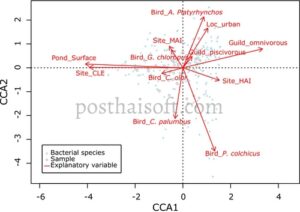
Dengan menggunakan CCA, kami menganalisis hubungan antara komposisi mikroba (bacaan pada tingkat genus/spesies) dan set data penjelasan, termasuk ciri burung (spesies, ekologi, serikat trofik, panjang tubuh) dan variabel lingkungan (lokasi, tipe lokasi, luas permukaan kolam, kekayaan makanan pada tumbuhan dan invertebrata dan rasio invertebrata/tumbuhan dalam makanan) (Tabel 1 dan 4 ). Set data terdiri dari 46 sampel dengan 346 variabel dependen dan delapan variabel penjelasan. Model akhir ditentukan sebagai berikut: log1p(MB) ~ Pond_Surface + Location + Trophique_Guild + Sampling_Site + Bird_Species , menjelaskan 36% dari varians dalam variabel dependen. Hubungan antara variabel dependen dan penjelasan signifikan secara statistik ( R 2 = 0,36, df = 12, F -value = 1,52, p = 0,001). Temuan ini menunjukkan bahwa faktor biologis dan lingkungan memainkan peran penting dalam membentuk komunitas mikroba di habitat burung (lihat analisis grafis: Gambar 3 ).
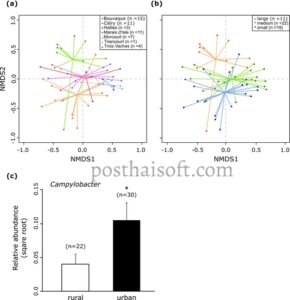
Kami melakukan analisis NMDS untuk memeriksa kesamaan mikrobiota feses pada tingkat taksonomi genus atau spesies di seluruh spesies dan sifat burung, dengan nilai stres 0,169, yang menunjukkan representasi yang dapat diterima (Gambar 4 ). Pola komunitas bakteri yang berbeda muncul di seluruh spesies burung (Gambar 4a ) dan serikat trofik burung (Gambar 4b ). Uji PERMANOVA menunjukkan bahwa perbedaan dalam spesies burung dan serikat trofik menjelaskan 24% ( p = 0,001) dan 7% ( p = 0,001) dari total varians, masing-masing, dengan efek kecil tetapi signifikan dari panjang tubuh burung dan ekologi (burung air atau darat; Tabel 5 ). Uji perbandingan berpasangan untuk perbedaan signifikan dalam mikrobiota feses antara spesies burung menunjukkan perbedaan terutama antara burung air dan darat (Tabel 6 ). Akhirnya, jarak ke centroid menunjukkan variasi intra-spesies, dengan Turdidae menunjukkan komposisi bakteri yang paling sedikit tersebar dan bangau abu-abu yang paling tersebar (Gambar 4c ). ANOVA mengkonfirmasi perbedaan dispersi yang signifikan ( p = 0,001).

TABEL 5. Hasil uji permutasi yang meneliti pengaruh sifat inang dan karakteristik lokasi pengambilan sampel terhadap komposisi mikrobiota tinja pada tingkat taksonomi genus atau spesies.
| Variabel penjelas | df | R 2 | F | P |
|---|---|---|---|---|
| Model: ~ Spesies inang × Ekologi inang × Guild trofik inang × Panjang tubuh inang × Lokasi × Permukaan kolam | ||||
| Spesies inang | 8 | 0.24 | 1.85 | 0,001** |
| Lokasi | 6 | 0.16 | 1.61 | 0,001** |
| Model: ~ Ekologi Inang × Guild Trofik Inang × Panjang Tubuh Inang | ||||
| Tuan rumah serikat trofik | 2 | 0,07 | 2.05 | 0,001** |
| Panjang tubuh inang | 1 | 0,03 | 1.58 | 0,028* |
| Ekologi inang | 1 | 0,05 | 2.6 | 0,001** |
| Guild trofik tuan rumah: ekologi tuan rumah | 1 | 0,03 | 1.57 | 0,043* |
| Model: ~ Lokasi × Permukaan kolam | ||||
| Lokalisasi situs (perkotaan/pedesaan) | 1 | 0,04 | 2.57 | 0,004** |
| Permukaan kolam | 5 | 0.18 | 2.04 | 0,001** |
TABEL 6. Hasil uji perbandingan berpasangan untuk komposisi mikrobiota tinja pada tingkat taksonomi genus atau spesies.
| Variabel | P |
|---|---|
| Spesies inang | |
| Anas platyrhynchos vs.Turdidae | 0,018* |
| Fulica atra vs. Turdidae | 0,018* |
| Gallinula chloropus vs. Turdidae | 0,036* |
| Ardea cinerea vs.Columba palumbus | 0,030* |
| Gallinula chloropus vs. Columba palumbus | 0,030* |
| Fulica atra vs.Phasianus colchicus | 0,018* |
| Columba palumbus vs. Turdidae | 0,018* |
| Situs | |
| BOU melawan CLE | 0,007** |
| BOU melawan HAI | 0,032* |
| CLE vs. HAI | 0,011* |
| CLE vs. MAI | 0,007** |
| CLE vs. MOR | 0,007** |
| CLE melawan TVA | 0,032* |
Karena komposisi bakteri feses bervariasi di antara spesies burung, kami menganalisis hubungan antara filogeni inang dan komposisi mikrobiota menggunakan pohon filogenetik sembilan spesies burung (Turdidae diwakili oleh burung hitam biasa, Turdus merula ; Gambar 5a ). Dua klade utama muncul: satu termasuk Anatida dan burung pegar biasa, dan kelompok lain Rallida, bangau abu-abu, merpati kayu biasa, dan burung hitam biasa. Jika komposisi bakteri feses dikaitkan dengan filogeni inang, spesies dalam klade yang sama harus berbagi lebih banyak bakteri daripada spesies dalam klade yang berbeda. Untuk menggambarkan hal ini, kami membuat peta panas yang menggambarkan komposisi bakteri dari sembilan spesies burung, dengan fokus pada taksa bakteri yang paling melimpah (Gambar 5b ). Pada tingkat genus atau spesies, mikrobiota Anatida herbivora, khususnya angsa bisu dan angsa abu-abu, menunjukkan mikrobiota berbeda yang dicirikan oleh kelompok unik: satu terdiri hanya dari Rhotia nasimurium dan yang lain mengandung Tsuneonella aeria , Pseudomonas , Bifidobacterium , Geobacter , Steroidobacter , Subdoligranulum dan Mediterraneibacter catenae . Sebaliknya, mikrobiota burung air lainnya sebagian besar dicirikan oleh dominasi genus Clostridium , suatu fitur yang tidak diamati pada burung darat. Untuk menguji filosimbiosis, kami membandingkan dendrogram yang menggambarkan hubungan jarak keragaman beta antara komunitas bakteri di antara burung (Gambar 5b , dendrogram atas) dengan filogeni spesies inang (Gambar 5a ). Uji Mantel menunjukkan bahwa komunitas berkorelasi dengan filogeni inang (Mantel r = 0,36; p = 0,029), yang menunjukkan hubungan sedang tetapi signifikan secara statistik. Gambar 5c menyoroti perbedaan relatif antara matriks filogeni inang dan matriks komposisi mikrobiota feses di antara berbagai spesies burung. Perbedaan terbesar terutama disebabkan oleh posisi bebek mallard relatif terhadap spesies lain, bangau abu-abu relatif terhadap burung rallid, dan pengelompokan burung pegar dan burung hitam bersama-sama, yang mungkin sebagian dijelaskan oleh status bersama mereka sebagai omnivora terestrial.

Selain itu, analisis NMDS mengungkap perbedaan mikrobiota feses di seluruh lokasi pengambilan sampel dan ukuran kolam (Gambar 6 ). Uji PERMANOVA mengindikasikan bahwa lokasi pengambilan sampel menjelaskan 16% ( p = 0,001) dan luas permukaan kolam (ha) menjelaskan 18% ( p = 0,001) perbedaan varians (Tabel 5 ), dengan konteks peri-perkotaan versus pedesaan memiliki efek yang kecil tetapi signifikan. Khususnya, di antara berbagai genera bakteri yang berpotensi patogen untuk burung yang diidentifikasi dalam kumpulan data kami ( Campylobacter , Clostridium , Enterococcus , Escherichia , Fusobacterium , Helicobacter , Pseudomonas , dan Streptococcus ), Campylobacter terdapat pada 70% sampel yang dikumpulkan di lokasi peri-perkotaan dibandingkan dengan 32% di lokasi pedesaan. Perbedaan prevalensi ini signifikan secara statistik (Gambar 6c ; p = 0,018). Uji perbandingan berpasangan untuk mengetahui perbedaan signifikan dalam genus mikrobiota feses antara lokasi pengambilan sampel menunjukkan bahwa CLE menunjukkan pola yang sangat berbeda dibandingkan dengan lokasi pengambilan sampel lainnya (Tabel 6 ).
4 Diskusi
Dalam studi percontohan ini, sampel feses yang dikumpulkan secara oportunistik dari tujuh lokasi, enam di dalam situs Ramsar dan satu di pinggirannya, selama musim semi 2021 mengungkapkan beragam mikrobiota feses burung. Analisis metabarkode mengidentifikasi komposisi bakteri dari 52 sampel feses dari sembilan spesies atau famili burung, terutama burung air, dengan Firmicutes dan Proteobacteria mendominasi tingkat filum. Analisis multivariat menunjukkan variasi signifikan dalam komposisi bakteri yang terkait dengan perbedaan spesies burung dan lokasi pengambilan sampel. Khususnya, perbedaan signifikan dalam mikrobiota feses dikaitkan dengan panjang tubuh burung, ekologi, kelompok trofik, lokasi habitat, dan ukuran kolam. Korelasi yang signifikan tetapi lemah antara filogeni inang dan komposisi mikrobiota juga terdeteksi. Sementara ukuran sampel yang terbatas membatasi generalisasi pola tertentu, tren ekologi yang diamati selaras dengan pola ekologi dan evolusi yang diharapkan. Hal ini menunjukkan bahwa pengambilan sampel feses oportunistik secara efektif menangkap perbedaan komunitas mikroba utama berdasarkan karakteristik burung dan habitat, memvalidasi potensinya sebagai alat yang andal untuk mengeksplorasi tren ekologi yang luas.
4.1 Komposisi Mikrobiota Kotoran Burung
Mirip dengan vertebrata lain, mikrobiota usus burung didominasi oleh empat filum utama: Firmicutes, Proteobacteria, Actinobacteria, dan Bacteroidetes (Waite dan Taylor 2014 ; Grond et al. 2018 ; Sun et al. 2022 ). Namun, burung cenderung memiliki proporsi Bacteroidetes yang relatif lebih rendah dan proporsi Proteobacteria yang lebih tinggi (Song et al. 2020 ). Hasil kami konsisten dengan temuan ini tetapi juga menunjukkan bahwa kelimpahan relatif filum ini dapat bervariasi secara signifikan di antara spesies dan individu burung (Gambar 2 ). Pada tingkat taksonomi yang lebih rendah, dibandingkan dengan vertebrata lain, burung menunjukkan perbedaan yang nyata dalam komposisi bakteri usus, mengelompok secara terpisah dari manusia, serangga, dan ikan sambil menunjukkan kesamaan yang lebih besar dengan kelelawar (Song et al. 2020 ). Pada tingkat genus atau spesies, data kami menunjukkan bahwa spesies burung merupakan faktor kunci yang memengaruhi struktur komunitas bakteri feses, meskipun tidak adanya hubungan yang kuat antara spesies burung tertentu dan mikrobiota tertentu (Gambar 4a , Tabel 5 dan 6 ). Khususnya, angsa bisu dan angsa abu-abu, serta burung pegar biasa dan Turdidae, mengelompok lebih jelas dari spesies lainnya (Gambar 5b ). Namun, pola ini harus ditafsirkan dengan hati-hati, karena tiga spesies pertama hanya diwakili oleh dua hingga tiga sampel. Jarak ke titik pusat, yang mencerminkan penyebaran antar individu dalam komposisi bakteri feses, juga berbeda secara signifikan antara spesies burung (Gambar 4c ). Turdidae dan burung moorhen biasa menunjukkan komposisi bakteri feses yang kurang tersebar, sementara burung bangau abu-abu dan, pada tingkat yang lebih rendah, burung coot Eurasia menunjukkan pola yang paling tersebar. Mikrobiota usus burung diketahui sangat bervariasi di antara individu spesies burung yang sama, karena dipengaruhi oleh faktor intrinsik, seperti usia, jenis kelamin, dan perilaku, dan faktor ekstrinsik, termasuk pola makan, perubahan lingkungan, dan proses stokastik (Van Dongen et al. 2013 ; Hird et al. 2014 ; Trevelline et al. 2020 ; Bodawatta, Koane, et al. 2021 ; Góngora et al. 2021 ; Sun et al. 2022 ; Wang, Zhong, et al. 2022 ).
Di antara genus dan spesies bakteri yang diidentifikasi dalam kumpulan data, yang paling dominan adalah Rothia nasimurium (filum Actinobacteria), yang terkait dengan anatid herbivora; Clostridium (filum Firmicutes), ditemukan di semua sampel burung air; dan Bacillus (filum Firmicutes), hadir di sebagian besar spesies burung yang dianalisis (Gambar 5b ). Dominasi genus Clostridium pada burung air telah dilaporkan dalam beberapa penelitian (Zhao et al. 2017 ; Laviad-Shitrit et al. 2019 ; Wang, Zhong, et al. 2022 ). Genus ini mencakup keragaman luas spesies yang sebagian besar anaerobik, beberapa di antaranya memiliki efek menguntungkan pada inang, bertindak sebagai probiotik dan membantu pencernaan atau kesehatan usus, sementara yang lain dapat bersifat patogen. Misalnya, C. butyricum telah terbukti meningkatkan kinerja pertumbuhan, meningkatkan fungsi kekebalan tubuh, dan mendukung keseimbangan mikrobiota usus pada ayam pedaging (Yang et al. 2012 ). Beberapa spesies Clostridium mampu memecah selulosa dan polisakarida kompleks lainnya menjadi metabolit yang bermanfaat bagi inangnya, seperti asam lemak rantai pendek (Sabathé et al. 2002 ; Warnick 2002 ; Varel and Pond 1992 ). Di antara spesies patogen, C. botulinum menghasilkan toksin botulinum, yang menyebabkan botulisme, penyakit neuroparalitik yang seringkali fatal pada burung, khususnya yang menyerang burung air dan burung pantai (Benskin et al. 2009 ). Demikian pula, bakteri dari genus Bacillus adalah simbion usus yang umum pada vertebrata, termasuk burung liar (Xie et al. 2016 ; Zhao et al. 2017 ; Wang, Liu, et al. 2018 ). Namun, genus ini telah dipelajari secara ekstensif untuk efek probiotiknya pada unggas dan burung domestik lainnya, di mana ia telah terbukti meningkatkan penyerapan nutrisi, meningkatkan efisiensi metabolisme, memodulasi respons imun, dan mengurangi prevalensi patogen (Grant et al. 2018 ; Grond et al. 2018 ; Bodawatta, Hird, et al. 2022 ). Sebaliknya, Rothia nasimurium jarang dideskripsikan dalam literatur. Spesies ini baru-baru ini diisolasi dari ayam, di mana ia dianggap sebagai bagian dari flora normal tetapi dapat bertindak sebagai patogen oportunistik yang mampu menginfeksi berbagai spesies hewan, termasuk angsa. Bakteri ini, yang menunjukkan fenotipe yang resistan terhadap banyak obat, dapat menyebabkan berbagai gejala, termasuk kerontokan bulu, dan dapat menyebabkan kematian ayam (Zhang et al. 2022 ).
4.2 Hubungan Antara Filogeni Burung dan Mikrobiota Fesesnya
Dalam populasi alami di berbagai taksa, termasuk spons, serangga, dan mamalia, korelasi telah diamati antara filogeni inang dan perbedaan interspesifik dalam komunitas internal yang terkait dengan inang atau mikrobiota usus (Mallott dan Amato 2021 ). Fenomena ini, yang dikenal sebagai filosimbiosis, bergantung pada heritabilitas melalui transmisi vertikal, koevolusi, dan bahkan adaptasi bersama inang. Meskipun ada faktor pengganggu potensial seperti perbedaan interspesifik dalam pola makan dan lingkungan, kelompok hewan campuran jenis kelamin atau ukuran sampel yang kecil (Trevelline et al. 2020 ; Baiz et al. 2023 ), filogeni secara umum dianggap sebagai prediktor yang relatif lemah dari keragaman mikrobiota usus pada burung secara keseluruhan, mungkin karena adaptasi yang terkait dengan penerbangan (Song et al. 2020 ). Namun, pengecualian di antara burung pengicau tidak dapat dikesampingkan, meskipun hasilnya bervariasi di berbagai penelitian (Loo et al. 2019 ; Bodawatta, Koane, et al. 2021 ; Baiz et al. 2023 ).
Pada burung air, sebuah penelitian menemukan bahwa pohon filogeni dari lima spesies, burung plover pasir kecil ( Charadrius mongolus ), burung redshank biasa ( Trigna tetanus ), burung camar berkepala cokelat ( Chroicocephalus brunnicephalus ), burung shelduck merah ( Tadorna ferruginea ), dan angsa berkepala batang ( Anser indicus ), tidak secara signifikan mencerminkan dendrogram hierarkis komunitas mikroba feses mereka di lahan basah Tibet (Bo et al. 2022 ). Demikian pula, filogeni burung tidak berkorelasi dengan mikrobiota usus dalam sampel feses dari 17 spesies burung air migrasi di Danau Poyang, Tiongkok (Wang, Zhong, et al. 2022 ). Sebaliknya, korelasi signifikan ditemukan antara filogeni inang dan struktur mikrobiota usus pada empat spesies burung air residen atau migran di Israel, termasuk bangau malam bermahkota hitam ( Nycticorax nycticorax ), kuntul kecil, burung kormoran besar, dan camar berkepala hitam (Laviad-Shitrit et al. 2019 ). Namun, dalam penelitian itu, analisis mikrobiota usus yang berasal dari berbagai bagian usus (anterior, tengah, dan posterior) tidak mengungkapkan pola filosimbiosis yang signifikan di wilayah usus posterior. Mengingat bahwa mikroorganisme dari berbagai bagian usus dapat berkontribusi secara bervariasi terhadap mikrobiota feses (Grond et al. 2018 ), temuan ini menunjukkan bahwa kehati-hatian diperlukan saat menafsirkan data filosimbiosis yang berasal dari sampel feses. Sebagai alternatif, perbedaan ekologi lainnya di antara spesies, seperti pola makan, dapat menyebabkan pola paralel antara filogeni dan mikrobiota usus, yang berpotensi membingungkan hasil, terutama ketika hanya beberapa spesies yang dipertimbangkan dalam desain penelitian. Data kami, berdasarkan konstruksi pohon filogenik dan dendrogram bakteri dominan dalam mikrobiota feses, selaras dengan kurangnya kongruensi yang kuat antara filogeni dan struktur komunitas bakteri feses pada burung (Gambar 5 ). Khususnya, bebek mallard menunjukkan pola mikrobiota feses yang lebih berbeda dari anatid lain daripada dari rallid, common wood pigeon, dan grey heron. Satu kemungkinan penjelasannya adalah interaksi sosial yang sering terjadi antara mallard dan rallid, yang dapat menghomogenkan mikrobiota feses mereka. Demikian pula, kemiripan antara pola mikrobiota feses burung pegar biasa dan burung hitam biasa, meskipun jarak filogeniknya, sebagian dapat dikaitkan dengan kesamaan dalam pola makan omnivora mereka. Relung makanan inang memiliki dampak yang kuat pada mikrobiota usus dan telah terbukti mendorong konvergensi mikrobioma usus di seluruh spesies inang dengan latar belakang filogenetik yang berbeda di seluruh kerajaan hewan (Mallott dan Amato 2021 ).
4.3 Hubungan Antara Ciri-ciri Burung dan Mikrobiota Fesesnya
Variabilitas yang diamati dalam mikrobiota feses dalam kumpulan data kami terutama berasal dari perbedaan di antara spesies inang (Gambar 3 dan 4a , Tabel 5 , dan 6 ). Ekologi inang, serikat trofik, dan panjang tubuh sebagian terkait dengan variabilitas ini (Gambar 3 dan 4b , Tabel 5 , dan 6 ). Penelitian sebelumnya secara konsisten menunjukkan bahwa burung dalam serikat trofik yang sama cenderung memiliki mikrobiota usus yang lebih mirip, meskipun spesies inang tetap menjadi faktor yang dominan (Bodawatta, Koane, dkk. 2021 ; Jarma dkk. 2021 ; Wang, Zhong, dkk. 2022 ). Ini sebagian dapat menjelaskan mengapa anatid herbivora (angsa bisu dan angsa abu-abu) dan burung darat omnivora (burung pegar biasa dan Turdidae) menunjukkan mikrobiota usus yang lebih mirip (Gambar 5b ). Sebuah studi perbandingan menemukan bahwa jaringan mikroba usus burung air karnivora menunjukkan keragaman dan kompleksitas yang lebih rendah, integrasi yang berkurang, dan stabilitas yang menurun dibandingkan dengan omnivora (Wang, Zhong, dkk. 2022 ). Karakteristik ini dapat berkontribusi pada variabilitas antar individu yang lebih besar dalam komposisi mikrobiota di antara karnivora (misalnya, bangau abu-abu dalam studi kami) sebagai respons terhadap faktor-faktor seperti pola makan, usia, dan lingkungan (Gambar 4c ).
Diet memainkan peran penting sebagai sumber utama penjajah mikroba untuk usus, menyediakan nutrisi bagi inang dan komunitas bakteri sambil juga memengaruhi pemilihan simbion (Grond et al. 2018 ; Wang, Zhong, et al. 2022 ). Di luar serikat trofik, yang mencakup rentang interaksi ekologi, perilaku, dan adaptasi fisiologis yang lebih luas daripada diet, mikrobiota usus dapat beradaptasi lebih spesifik terhadap rezim diet. Tang et al. ( 2023 ) menunjukkan bahwa pergeseran diet musiman pada ayam hutan Sichuan ( Arborophila rufipectus ) disertai dengan perubahan yang sesuai dalam komposisi mikrobiota usus. Demikian pula, coot Eurasia bergeser dari diet yang didominasi herbivora, yang sebagian besar terdiri dari tanaman yang terendam, ke rezim omnivora yang menggabungkan invertebrata selama musim kawin (Brinkhof 1997 ; Fablet et al. 2024 ), yang menunjukkan bahwa mikrobiota usus coot dapat berubah secara dinamis sepanjang siklus tahunan mereka. Fleksibilitas pola makan ini sebagian dapat menjelaskan keragaman individu yang relatif lebih tinggi dalam mikrobiota feses yang diamati pada coot dibandingkan dengan spesies lain (Gambar 4c ). Namun, dalam model CCA kami, pola makan, yang diwakili oleh kekayaan tumbuhan dan invertebrata serta rasio invertebrata terhadap tumbuhan, tidak diidentifikasi sebagai variabel penjelas yang signifikan.
Burung yang bermigrasi mengalami perubahan perilaku, fisiologis, dan anatomi yang signifikan sepanjang siklus tahunannya dan terpapar pada lingkungan yang beragam, yang mengarah pada pola makan yang sangat bervariasi dan kemungkinan peningkatan paparan patogen. Paparan ini diharapkan dapat mendiversifikasi sumber mikrobiota usus mereka yang pada akhirnya mendorong divergensi antara populasi migran dan penduduk (Wu et al. 2018 ; Grond et al. 2019 ; Sun et al. 2022 ; Wang, Zhong, et al. 2022 ; Włodarczyk et al. 2024 ). Di Prancis Utara, bangau abu-abu bersifat menetap, burung coot Eurasia bersifat menetap, sementara burung dara hutan biasa menunjukkan perilaku menetap dan bermigrasi (Tabel 4 ). Dengan demikian, status migrasi burung coot Eurasia dan burung dara hutan biasa dapat berkontribusi pada variasi antar individu yang diamati dalam mikrobiota feses dalam kumpulan data kami (Gambar 4c ).
Hasil kami menunjukkan bahwa panjang tubuh memiliki pengaruh kecil tetapi signifikan pada komposisi bakteri mikrobiota feses (Tabel 5 ). Satu kemungkinan penjelasannya adalah hubungannya dengan panjang usus. Pada beberapa famili ikan (Cyprinidae dan Sparidae), panjang usus diketahui membentuk struktur mikrobiota usus, dengan keragaman alfa berasosiasi negatif dengan panjang usus (Escalas et al. 2021 ; Liu et al. 2022 ). Usus yang lebih panjang meningkatkan waktu transit makanan (lihat Jackson 1992 , pada burung laut), yang dapat menstabilkan lingkungan usus, mengurangi pergantian mikroba, dan menciptakan lebih banyak kondisi anaerobik yang mendukung bakteri anaerobik dan anaerobik fakultatif, yang pada akhirnya memengaruhi pemanfaatan sumber daya. Tren serupa telah diamati pada burung pengicau, di mana Bodawatta, Koane, et al. ( 2021 ) melaporkan korelasi negatif antara massa tubuh (digunakan sebagai proksi untuk waktu retensi usus) dan keragaman mikroba serta heterogenitas mikrobiota kloaka di 17 spesies. Burung, karena adaptasi evolusioner terhadap terbang, memiliki saluran pencernaan yang lebih pendek dan waktu retensi usus yang lebih cepat dibandingkan dengan mamalia yang tidak terbang dengan ukuran yang sama (Bodawatta, Hird, et al. 2022 ). Song et al. ( 2020 ) lebih lanjut menyarankan bahwa kelelawar memiliki kesamaan mikrobiota usus dengan burung karena adaptasi fisiologis konvergen terhadap terbang. Temuan ini menunjukkan bahwa adaptasi usus yang terkait dengan terbang dapat berperan dalam membentuk struktur mikrobiota usus. Meskipun kumpulan data kami tidak memungkinkan perbandingan langsung dari keragaman alfa, perbedaan dalam panjang usus dapat membantu menjelaskan mengapa burung yang lebih besar, seperti bangau abu-abu, dengan saluran usus yang lebih panjang dan waktu retensi yang berpotensi lebih lama, menunjukkan mikrobiota usus yang tampaknya kurang beragam dibandingkan dengan Turdidae (Gambar 5b ).
Karena hubungan filogenetik dan sifat ekologi memengaruhi komposisi mikrobiota usus, menguraikan faktor-faktor yang membentuk komunitas mikroba di seluruh spesies burung tetap menjadi tantangan. Kompleksitas ini semakin meningkat oleh dampak habitat, seperti yang ditunjukkan oleh data kami dan penelitian sebelumnya (Wang, Hong, dkk. 2022 ), yang menyoroti ekologi burung sebagai faktor dalam komposisi mikrobiota.
4.4 Hubungan Antara Lokasi dan Mikrobiota Kotoran Burung
Mikrobiota usus vertebrata sangat responsif terhadap faktor lingkungan, dengan banyak penelitian menunjukkan kemampuannya untuk beradaptasi dengan perubahan pola makan, habitat, dan pengaruh yang disebabkan manusia. Misalnya, mikrobiota usus burung pengicau telah terbukti sangat mudah berubah terhadap kondisi lingkungan, termasuk yang dibentuk oleh aktivitas manusia seperti urbanisasi (Hird et al. 2014 ; Teyssier et al. 2018 ; Knutie et al. 2019 ; Loo et al. 2019 ; San Juan et al. 2020 ). Demikian pula, variasi spasial yang signifikan dalam komposisi mikrobiota feses telah diamati dalam kawanan burung camar punggung hitam kecil ( Larus fuscus ), di mana kekayaan dan keanekaragaman komunitas bakteri lebih tinggi pada burung camar yang mencari makan di tempat pembuangan sampah (Jarma et al. 2024 ). Lebih jauh, ketinggian juga terbukti memengaruhi mikrobiota usus spesies seperti burung camar berkepala cokelat ( Larus brunnicephalus ) dan angsa di lahan basah, dengan pergeseran taksa bakteri yang terkait dengan metabolisme energi, karbohidrat, dan asam amino yang menunjukkan adaptasi mikrobiota terhadap lingkungan dataran tinggi (Wang, Liu, dkk. 2018 ; Bo dkk. 2022 ). Lebih jauh lagi, keberadaan bakteri patogen telah dikaitkan dengan perbedaan pola makan dan habitat di ekosistem lahan basah ini, yang menunjukkan kemungkinan hubungan antara kualitas ekosistem dan komposisi mikrobiota.
Data kami mengungkapkan bahwa bahkan ketika burung menghuni area umum dan tipe habitat yang sama, mereka menunjukkan variabilitas yang signifikan dalam komposisi mikrobiota feses (Gambar 6 ). Keragaman ini sebagian dijelaskan oleh faktor lokal, seperti ukuran kolam dan, pada tingkat yang lebih rendah, lokasi peri-urban (Tabel 5 ). Hubungan antara ukuran kolam dan mikrobiota usus burung menjamin eksplorasi lebih lanjut. Namun, karena ukuran kolam dalam ekosistem perairan berkorelasi positif dengan kekayaan spesies, khususnya serangga perairan (Oertli dan Parris 2019 ), kolam yang lebih besar dapat menyediakan relung trofik yang lebih luas. Akibatnya, ukuran kolam secara tidak langsung dapat memengaruhi keragaman mikrobiota usus dengan mengubah masukan makanan. Selain itu, habitat yang secara struktural kompleks sering kali mendukung keanekaragaman hayati yang lebih tinggi, yang dapat memaparkan burung pada lingkungan mikroba yang lebih beragam.
Dinamika ini berpotensi tercermin di Cléry-sur-Somme (CLE), sebuah kolam besar di daerah pedesaan, yang secara signifikan memengaruhi komposisi mikrobiota feses (Gambar 3 dan 5 dan Tabel 5 ), menawarkan rangkaian sumber daya invertebrata dan tumbuhan yang lebih luas untuk burung dibandingkan dengan lokasi lain (Fablet et al. 2024 ). Khususnya, lokasi ini menampung serangga akuatik seperti Ephemeroptera dari famili Caenidae dan Baetidae. Taksa ini adalah bioindikator yang sensitif terhadap polusi berdasarkan standar AFNOR NF T90-350 (2004), yang dirujuk dalam European Water Framework Directive. Kehadiran mereka dalam makanan burung menunjukkan bahwa CLE menunjukkan kualitas lingkungan yang lebih tinggi dibandingkan dengan lokasi yang lebih urban. Eutrofikasi dan urbanisasi, yang menyederhanakan komunitas makrofita dan invertebrata akuatik, sering kali mengurangi keanekaragaman hayati dan mengubah dinamika ekosistem (Rejmankova 2011 ; Oertli dan Parris 2019 ). Namun, penting untuk dicatat bahwa model CCA kami tidak mengidentifikasi kekayaan tumbuhan dan invertebrata atau rasio invertebrata terhadap tumbuhan dalam makanan sebagai variabel penjelas yang signifikan, mungkin karena ukuran sampel kami yang relatif kecil ( n = 46).
Akhirnya, pola yang diamati dalam studi kami mungkin selaras dengan penelitian yang lebih luas tentang dampak antropogenik pada sistem akuatik. Misalnya, sebuah studi perbandingan di Norwegia menemukan keragaman mikroba yang lebih tinggi di perairan pedesaan yang kurang terpengaruh oleh kontaminasi tinja, sementara perairan perkotaan menunjukkan keragaman mikroba yang lebih rendah dan tingkat polusi tinja yang lebih tinggi (Paruch et al. 2019 ). Demikian pula, kumpulan data kami mengungkapkan prevalensi yang jauh lebih tinggi dari bakteri enterik yang berpotensi patogenik Campylobacter dalam kotoran burung yang diambil sampelnya dari lingkungan pinggiran kota dibandingkan dengan yang pedesaan. Mengingat bahwa ekologi makan tampaknya menjadi faktor kunci yang memengaruhi keberadaan campylobacter dalam flora usus burung (Benskin et al. 2009 ), temuan ini mendukung gagasan bahwa lingkungan perkotaan dapat membentuk mikrobiota usus melalui mekanisme langsung (misalnya, paparan kontaminan) dan mekanisme tidak langsung (misalnya, perubahan pola makan). Memahami dinamika ini sangat penting, karena burung air, yang bertindak sebagai reservoir bagi Campylobacter dan patogen bakteri enterik potensial lainnya, dapat berkontribusi terhadap penyebaran penyakit zoonosis, sehingga menimbulkan risiko signifikan terhadap kesehatan masyarakat (Benskin et al. 2009 ; Boukerb et al. 2021 ).
5. Kesimpulan
Mikrobiota usus yang berasosiasi dengan inang sangat memengaruhi kesehatan burung dan vertebrata akuatik, merespons gangguan lingkungan dengan cepat. Para peneliti telah menyarankan bahwa komunitas mikroba ini dapat berfungsi sebagai indikator sensitif untuk memantau perubahan ekologis dan fisiologis, mengadvokasi integrasi mereka ke dalam strategi konservasi sebagai hal yang penting untuk melestarikan keanekaragaman hayati dan meningkatkan ketahanan ekosistem (Trevelline et al. 2019 ; Sehnal et al. 2021 ). Namun, mikrobiota usus burung dipengaruhi oleh serangkaian sifat dan faktor lingkungan yang kompleks, yang mengarah pada pola rumit yang implikasinya bagi kesehatan inang sebagian besar masih belum diketahui, terutama yang menyangkut potensi disbiosis mikroba. Masih belum jelas apakah perubahan dalam komunitas bakteri tinja di seluruh inang dan tipe habitat memiliki konsekuensi fungsional. Pendekatan tradisional untuk mempelajari mikrobiota usus sering kali bersifat invasif, yang memerlukan penangkapan atau gangguan pada burung, yang dapat menyebabkan stres, mengubah perilaku, dan mengganggu mikrobiota usus mereka. Meskipun berdasarkan jumlah sampel yang terbatas, temuan kami selaras dengan pola ekologi dan evolusi yang diharapkan, yang menunjukkan bahwa sampel feses yang dikumpulkan secara oportunistik dari tanah dapat memberikan alternatif yang menjanjikan dan berdampak rendah. Metode ini dapat memungkinkan penilaian yang luas terhadap mikrobiota usus burung, sekaligus mengungkap hubungan antara komunitas mikroba, sifat burung, habitat, dan pola makan.
6 Keterbatasan dan Arah Masa Depan
Meskipun hasil kami memberikan wawasan ekologis yang berharga, ukuran sampel yang terbatas membatasi kekuatan kesimpulan kami. Untuk beberapa spesies, jumlah sampel yang sangat rendah (2–3 individu) membatasi generalisasi pola yang diamati. Selain itu, kekuatan penjelasan model CCA kami mungkin telah dipengaruhi oleh kumpulan data yang relatif kecil ( n = 46), yang berpotensi menutupi hubungan ekologis seperti peran kekayaan tumbuhan dan invertebrata dalam komposisi makanan. Penelitian di masa mendatang harus memprioritaskan peningkatan ukuran sampel untuk meningkatkan kekuatan statistik dan meningkatkan ketahanan temuan. Memperluas upaya pengambilan sampel di berbagai individu dan habitat yang lebih luas akan memungkinkan penilaian yang lebih andal terhadap variasi mikrobiota dan pola makanan.
