ABSTRAK
Titrasi antibodi merupakan langkah penting dalam setiap alur kerja sitometri, dengan tujuan untuk menentukan konsentrasi antibodi yang memastikan hasil yang sangat dapat direproduksi. Ketika ingin membandingkan ekspresi antigen antara sampel menggunakan intensitas fluoresensi rata-rata atau median (MFI), reagen harus digunakan pada konsentrasi jenuh sehingga variasi yang tidak dapat dihindari dalam kondisi pewarnaan tidak memengaruhi sinyal fluoresensi. Konsentrasi yang direkomendasikan dari antibodi monoklonal (mAb) berlabel fluorofor yang tersedia secara komersial mungkin tidak mencapai pewarnaan plateau, dan konsentrasi jenuhnya mungkin terlalu tinggi untuk berguna secara eksperimental. Untuk mengatasi masalah umum ini, kami menyajikan metode baru untuk mencapai saturasi mAb terkonjugasi fluorofor, dengan ‘menambahkan’ antibodi tak berlabel dari klon yang sama. Di sini, kami menunjukkan penerapan alur kerja ini pada anti-CD3 manusia (klon OKT3, IgG2a tikus) dan anti-TCRαβ (klon IP26, IgG1 tikus), dua mAb yang tidak mencapai saturasi pada 2 kali lipat di atas konsentrasi yang direkomendasikan secara komersial. Pertama, konsentrasi jenuh OKT3 dan IP26 yang tidak berlabel (dimurnikan) ditentukan dengan deteksi dengan antibodi sekunder anti-IgG tikus (H + L) berlabel fluorofor. Kurva titrasi mAb yang tidak berlabel dan berlabel dibandingkan untuk setiap klon untuk menentukan apakah pelabelan telah mengakibatkan hilangnya aktivitas pengikatan. Antibodi yang tidak berlabel kemudian ‘dicampur’ ke dalam antibodi berlabel pada rasio yang bervariasi, dan yang mencapai saturasi sambil mempertahankan sinyal fluoresensi yang memadai diidentifikasi. Kami menunjukkan bahwa saturasi antibodi dapat dicapai dengan campuran yang dioptimalkan dari antibodi berlabel dan tidak berlabel, sambil mempertahankan sinyal yang jelas dari fluorofor. Meskipun alur kerja ini hanya diterapkan pada OKT3 dan IP26, alur kerja ini berpotensi diterapkan pada klon antibodi apa pun yang memiliki sediaan berlabel dan tidak berlabel. Metode ini penting untuk perbandingan ekspresi biomarker yang kuat saat reagen berlabel fluorofor tidak mencapai saturasi dalam kondisi pewarnaan standar.
1 Pendahuluan
Reseptor plasma-membran sering digunakan sebagai target terapeutik atau dievaluasi sebagai biomarker klinis. Teknik deteksi berbasis antibodi seperti flow cytometry umumnya diterapkan untuk membandingkan kelimpahan reseptor ini dalam sampel dari subjek dengan kanker dan patologi lainnya, dengan hasil yang sering dilaporkan sebagai intensitas fluoresensi rata-rata atau median (MFI). Misalnya, salah satu pengamatan yang paling menonjol dan dapat diandalkan dalam kanker adalah penurunan regulasi komponen reseptor sel T (TCR) termasuk rantai αβ (TCRαβ), CD3, dan CD247 [ 1 – 6 ]. Banyak penelitian telah menerapkan flow cytometry untuk membandingkan ekspresi relatif komponen TCR ini antara individu yang berbeda dalam karakteristik klinisnya [ 1 – 3 , 5 , 7 – 9 ]. Namun, penelitian ini menyajikan sedikit atau tidak ada informasi tentang praktik yang digunakan untuk mengoptimalkan pewarnaan antibodi dan untuk memastikan bahwa pembacaan MFI individu tidak dikacaukan oleh perubahan kecil dalam protokol eksperimen. Sebuah meta-analisis terbaru dari Reproducibility Project: Cancer Biology, yang bertujuan untuk mereproduksi eksperimen terpilih dari 53 makalah berdampak tinggi, menemukan dengan satu metrik bahwa hanya 46% dari replikasi yang dicoba selaras dengan hasil asli [ 10 , 11 ]. Krisis dalam reproduktifitas ini bukanlah hal baru; studi sebelumnya mampu mereplikasi hasil hanya dari 6 dari 53 studi praklinis penting dalam hematologi dan onkologi [ 12 ]. Sejalan dengan ini, dua studi yang membandingkan MFI ekspresi CD247 dan CD3 pada pasien kanker serviks dan individu sehat melaporkan hasil yang bertentangan [ 3 , 13 ]. Normalisasi MFI menggunakan sel dari kontrol internal, diwarnai dan diperoleh di setiap batch, dapat memediasi efek antar-batch seperti variasi tegangan sitometer dan sensitivitas laser [ 14 ]. Namun, ini tidak akan mengatasi variasi intra-batch di MFI yang diperkenalkan oleh perbedaan yang tidak dapat dihindari dalam kondisi pewarnaan antara sampel.
Bahasa Indonesia: Saat menerapkan sitometri untuk menentukan proporsi populasi sel yang berbeda dalam satu sampel, sinyal sub-jenuh yang mudah dibedakan dari latar belakang tidak menghadirkan kesulitan dalam interpretasi. Namun, jika tujuannya adalah untuk membandingkan ekspresi relatif antigen tertentu antara subjek, maka deteksi pada konsentrasi antibodi sub-jenuh dapat memperkenalkan sumber variabilitas yang tidak terkendali. Konsentrasi antibodi jenuh secara luas dapat didefinisikan sebagai jumlah antibodi yang diperlukan untuk menempati semua tempat pengikatan antigen pada sel yang mengekspresikan antigen [ 15 ]. Konsentrasi jenuh biasanya ditentukan dengan titrasi, menggunakan berbagai konsentrasi antibodi di bawah kondisi eksperimen yang dimaksudkan untuk mewarnai sampel yang berisi sel-sel yang positif dan negatif untuk antigen yang diinginkan [ 16 – 18 ]. MFI sel yang positif untuk antigen kemudian diplot terhadap konsentrasi antibodi, menghasilkan kurva titrasi sigmoidal (Gambar 1 ). Pada konsentrasi antibodi sub-jenuh di mana kemiringan kurva sigmoidal paling besar, sedikit variasi dalam kondisi eksperimen seperti jumlah sel, volume pewarnaan, suhu pewarnaan, jumlah pencucian, atau waktu inkubasi dapat secara signifikan mempengaruhi nilai MFI [ 18 , 19 ]. Namun, ketika konsentrasi antibodi sesuai dengan “dataran tinggi” kurva, efek variasi eksperimen pada intensitas fluoresensi sel antigen-positif menjadi kecil. Pengikatan off-target juga menghasilkan kurva titrasi, yang umumnya mencapai dataran tinggi pada konsentrasi yang jauh lebih tinggi daripada pengikatan spesifik, sehingga merupakan praktik yang umum untuk memilih konsentrasi kerja yang paling baik mengenali target dengan pengikatan off-target minimal. Beberapa metrik seperti Indeks Pewarnaan, Indeks Pemisahan, atau Rasio Sinyal/Kebisingan dapat digunakan untuk menilai kualitas pewarnaan. Sementara semua metrik akan menghasilkan pemilihan konsentrasi kerja yang serupa, Indeks Pewarnaan (SI) paling sering dilaporkan [ 19 ]. Akan tetapi, perlu dicatat bahwa saat konsentrasi antibodi meningkat, pewarnaan plateau spesifik biasanya stabil sementara pengikatan off-target meningkat, yang menyebabkan penurunan SI. Dengan demikian, SI maksimum mungkin tidak mengidentifikasi konsentrasi antibodi optimal untuk mencapai pewarnaan spesifik yang sangat dapat direproduksi. Misalnya, peningkatan kecil dalam pewarnaan off-target oleh anti-TCRαβ atau anti-CD3 dalam sampel sel mononuklear darah (PBMC) dapat diabaikan secara efektif, karena sudah diterima dengan baik bahwa hanya sel T yang mengekspresikan TCRαβ permukaan dan CD3, sehingga pewarnaan populasi sel lain, menurut definisi, off-target.

Konjugasi antibodi ke fluorofor dapat mengubah karakteristik pengikatannya, atau bahkan menonaktifkan antibodi [ 21 ]. Sebelum antibodi terkonjugasi fluorofor tersedia secara komersial, konjugasi biasanya dilakukan di rumah. Efektivitas konjugasi di rumah sering diuji menggunakan uji kompetisi di mana berbagai konsentrasi antibodi yang tidak berlabel ditambahkan ke konsentrasi tetap antibodi berlabel, dan pengurangan fluoresensi ditentukan [ 22 , 23 ]. Kami terinspirasi oleh eksperimen kompetisi ini dan keinginan untuk menggunakan antibodi terkonjugasi fluorofor yang tersedia secara komersial dalam kondisi jenuh untuk secara akurat membandingkan ekspresi antigen antara sampel sebagai bagian dari alur kerja yang memaparkan PBMC manusia ke koktail kompleks antibodi yang mengidentifikasi lebih dari 30 subpopulasi. Oleh karena itu, kami mengembangkan alur kerja yang dapat menghasilkan reagen yang jenuh sambil mempertahankan utilitas dan efektivitas biaya antibodi monoklonal yang ditandai secara fluoresensi. Ini dicapai dengan membuat campuran antibodi monoklonal berlabel dan tidak berlabel. Dalam kajian ini, kami menerapkan alur kerja ini untuk membandingkan ekspresi dua komponen reseptor sel T manusia (TCR), CD3 (klon OKT3, IgG2a tikus) dan TCRαβ (klon IP26, IgG1 tikus), yang mana mAb berlabel fluorofor yang tersedia secara komersial tidak mencapai saturasi pada 2 kali lipat di atas konsentrasi yang direkomendasikan.
2 Metode
2.1 Pengumpulan dan Persiapan Sampel
Relawan yang sehat direkrut dengan persetujuan tertulis yang diinformasikan berdasarkan protokol etik Sydney Local Health District X23-0300. Darah dikumpulkan ke dalam tabung EDTA dan diproses dalam waktu 4 jam pada suhu kamar (RT). Sel mononuklear darah perifer (PBMC) diisolasi dengan Ficoll-Paque (GE Healthcare) menurut protokol standar [ 24 ]. PBMC dikriopreservasi dengan pembekuan dalam 10% dimetil sulfoksida, 20% serum anak sapi janin yang diinaktivasi panas (FCS) dan RPMI-1640 (Thermo Fisher Scientific) dalam wadah beku kriogenik CoolCell (Corning) pada suhu −80°C untuk penyimpanan jangka pendek.
2.2 Pewarnaan Sampel untuk Flow Cytometry
PBMC yang dikriopreservasi dicairkan dengan cepat pada suhu 37°C dalam penangas air, kemudian dipindahkan ke RPMI-1640 yang dilengkapi dengan 10% FCS yang diinaktivasi panas. Sel dihitung secara manual menggunakan hemocytometer, dengan trypan blue digunakan untuk mengidentifikasi sel yang mati. Jumlah sel dan viabilitas dicatat. 5 × 105 sel dikeluarkan dari suspensi sel untuk setiap kondisi pewarnaan, kecuali dinyatakan lain. Sel diinkubasi dengan 50 μL 1:200 Live/Dead NIR (Invitrogen) dalam PBS yang dilengkapi dengan 1% FBS selama 15 menit di atas es dalam gelap dalam mikroplat 96-well (Greiner). Semua langkah selanjutnya dilakukan dalam buffer FACS (0,5% BSA, 5 mM EDTA, 0,05% natrium azida dalam PBS). Tahap pencucian dilakukan dengan mensuspensikan kembali sel-sel di setiap sumur mikroplat dalam buffer 150 μL, melakukan sentrifugasi pada 350 g selama 3 menit, dan membuang supernatan. Setelah inkubasi NIR Hidup/Mati, sel-sel dicuci dan diinkubasi dengan 100 μL Human TruStain FcX 1:20 (Biolegend) pada suhu ruangan dalam gelap. Setelah mencuci sel sekali, setiap koktail antibodi yang relevan ditambahkan dalam volume pewarnaan 100 μL sebelum inkubasi selama 30 menit di atas es dalam gelap (Tabel 1 ). Jika menggunakan antibodi sekunder, sel-sel dicuci dua kali sebelum inkubasi dengan 400 ng anti-mouse-IgG (H + L) FITC dalam 100 μL selama 30 menit di atas es dalam gelap. Akhirnya, sel-sel dicuci tiga kali sebelum akuisisi.
| Kekhususan | Klon | Fluorofor | Sumber | Nomor katalog | Nomor lot | Konsentrasi (μg/mL) |
|---|---|---|---|---|---|---|
| CD3 | OKT3 | BV605 | Legenda Bio | 317322 | B389730 | 50 |
| CD3 | OKT3 | Tidak berlabel | Legenda Bio | 317302 | B358930 | 500 |
| TCRαβ | IP26 | Bahasa Inggris | eBiosains | Nomor telepon 12–9986-42 | 2566741 | 100 |
| TCRαβ | IP26 | Tidak berlabel | Legenda Bio | 306702 | B399126 | 500 |
| IgG Tikus (H + L) | Poliklonal | Bahasa Indonesia: FITC | Penelitian Imuno Jackson | M30201 | Nomor 4 | 500 |
| Bahasa Indonesia: CD56 | N901 | Percp-Cy5.5 | Beckman Coulter | A79388 | tahun 200070 | 50 |
| Zombie NIR | Bahasa Indonesia | Bahasa Indonesia | Invitrogen | L34976 | 1647137 | skala 1:200 |
2.3 Akuisisi Data
Sampel dan kontrol kompensasi diperoleh pada CytoFlex LX Cytometer Beckman Coulter. Kinerja instrumen diverifikasi sebelum akuisisi menggunakan manik kontrol kualitas (Beckman Coulter). Sampel PBMC disuspensikan kembali dalam 100 μL buffer FACS, kemudian 150.000 kejadian diperoleh pada kecepatan sedang (30 μL/menit) untuk setiap kondisi. Kontrol kompensasi disiapkan untuk setiap fluorofor dengan mereaksikan 1 μL antibodi yang diencerkan dalam 500 uL buffer FACS dengan 1 tetes BD CompBeads Anti-Mouse Ig, K (BD Bioscience). Untuk menyiapkan kontrol kompensasi NIR Hidup/Mati, 5 × 10 5 sel dipanaskan hingga 60°C dalam blok panas selama 10 menit untuk menginduksi kematian sel. Sel kemudian diinkubasi dengan 50 μL 1:200 Live/Dead NIR (Invitrogen) dalam PBS yang ditambah dengan 1% FBS selama 15 menit di atas es dalam gelap dalam mikroplat 96-sumur (Greiner). Sel dicuci dua kali sebelum akuisisi; manik kompensasi tidak dicuci sebelum akuisisi.
2.4 Analisis
File Fcs3.1 ditransfer ke FlowJo v10, dan setiap matriks kompensasi dihitung dan diterapkan pada sampel. Sel-sel mati dan doublet digerbangkan, kemudian limfosit digerbangkan (Gambar S1 ) Populasi positif dan negatif untuk setiap kompleks antibodi/antigen diidentifikasi. Nilai intensitas fluoresensi median (MFI) dan deviasi standar (SD) yang kuat diekspor dari populasi positif dan negatif. GraphPad Prism digunakan untuk analisis statistik dan grafis. Indeks pewarnaan untuk setiap pengulangan dihitung sebagai:
![]()
Ketidakpastian untuk indeks pewarnaan dinyatakan sebagai rata-rata ± simpangan baku setiap pengulangan. Uji- T berpasangan digunakan sebagai kriteria statistik untuk pemilihan pengenceran antibodi optimal dari kurva titrasi. Pewarnaan dataran tinggi didefinisikan sebagai bagian kurva di mana nilai intensitas fluoresensi median (MFI) populasi positif pada dua konsentrasi antibodi berturut-turut tidak berbeda secara signifikan ( p > 0,05) [ 25 ].
3 Hasil
3.1 Antibodi Berlabel Fluorofor yang Menargetkan TCRαβ (IP26) dan CD3 (OKT3) Tidak Mencapai Pengikatan Saturasi pada Konsentrasi yang Direkomendasikan Secara Komersial
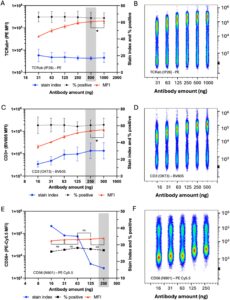
Untuk menentukan apakah anti-TCRαβ-PE (klon IP26, IgG1 tikus, 500 ng/konsentrasi rekomendasi uji) dan anti-CD3-BV605 (klon OKT3, IgG2a tikus, 250 ng/konsentrasi rekomendasi uji) mencapai pewarnaan plateau pada konsentrasi yang direkomendasikan secara komersial, kedua antibodi diuji pada alikuot 5 × 105 PBMC dari tiga sukarelawan manusia yang sehat. Seri pengenceran 2 kali lipat dilakukan untuk anti-TCRαβ-PE (31–100 ng) dan anti-CD3-BV605 (16–500 ng), dimulai 2 kali lipat di atas konsentrasi yang direkomendasikan secara komersial (Gambar 2a–d ). Uji-t berpasangan dilakukan untuk menentukan apakah dua konsentrasi berturut-turut berada di area plateau kurva. Plateau ditunjukkan oleh perbedaan yang tidak signifikan ( p > 0,05) antara kedua konsentrasi. Pewarnaan plateau antara konsentrasi yang direkomendasikan secara komersial dan 2 kali lipat di atas tidak diamati untuk anti-TCRαβ-PE ( p = 0,0228, t = 6,503, df = 2) atau anti-CD3-BV605 ( p = 0,0134, t = 8,543, df = 2). Sebaliknya, anti-CD56-Percp-cy5.5 (klon N901, mouse IgG1, konsentrasi yang direkomendasikan 250 ng/tes) mencapai pewarnaan plateau pada rentang konsentrasi 16–250 ng/tes dan dapat digunakan secara eksperimental pada 16 ng/tes (Gambar 2e,f ). Dengan demikian, reagen anti-CD56-Percp-cy5.5 ini mencapai saturasi pada konsentrasi setidaknya 10 kali lipat lebih rendah dari yang direkomendasikan. Namun, konsentrasi anti-TCRαβ-PE (IP26) dan anti-CD3-BV605 (OKT3) yang direkomendasikan secara komersial tidak cukup untuk mencapai pengikatan antigen pada tingkat jenuh.
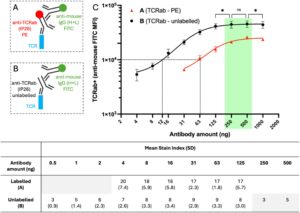
Untuk menentukan konsentrasi jenuh anti-TCRαβ mAb yang tidak berlabel, PBMC dari tiga donor sehat diwarnai dalam seri pengenceran 2 kali lipat mulai dari 4 hingga 1000 ng per 100 μL. Pengikatan dideteksi dengan antibodi sekunder berlabel fluorofor, anti-mouse-IgG (H + L)-FITC yang dititrasi secara optimal (Gambar S2 , Gambar 3b ). Antara 1000 ng dan 500 ng, MFI FITC menurun secara signifikan ( p = 0,0185, t = 7,258, df = 3) karena kelebihan antibodi yang menyebabkan efek prozon (Gambar S3 , Gambar 3c ). Antara 500 ng dan 250 ng, tidak ada perbedaan signifikan dalam MFI populasi TCRαβ + ( p = 0,1806, t = 2,021, df = 2), yang menunjukkan pewarnaan plateau telah terjadi (Gambar 3c ). Untuk membandingkan aktivitas pengikatan IP26 yang tidak berlabel dengan IP26 yang terkonjugasi PE, anti-TCRαβ–PE dititrasi dari 31 hingga 1000 ng/uji pada PBMC dari 3 donor sehat, kemudian dideteksi dengan anti-mouse-IgG (H + L)-FITC (Gambar 3a,c ). Kurva sigmoidal dipasangkan dengan data dan konsentrasi setiap antibodi pada titik di mana kurva dari anti-mouse-FITC sekunder jelas sejajar (MFI 10.000) diinterpolasi dengan interval kepercayaan 95% (CI). Konsentrasi anti-TCRαβ–PE dan anti-TCRαβ tak berlabel yang menghasilkan MFI 10.000 dalam saluran FITC ditetapkan sebesar 77,9 ng (47,4–61,2 ng 95% CI) dan 12,1 ng (6,6–17,4 ng 95% CI). Dengan demikian, aktivitas pengikatan antibodi TCRαβ terkonjugasi PE berkurang hingga 5,1 kali lipat (4,6–7,1 95% CI) relatif terhadap format tak berlabel.
250 ng anti-TCRαβ yang tidak berlabel ditambahkan ke 500 ng anti-TCRαβ-PE (67% konsentrasi akhir berlabel) dan campuran tersebut dititrasi dalam seri pengenceran 2 kali lipat antara 49 dan 750 ng/uji. Tidak terdeteksi pewarnaan plateau dari campuran ini (Gambar 4a ). Namun, pewarnaan latar belakang yang tinggi dan populasi intermediet TCRαβ yang nyata, kemungkinan besar monosit, diamati (Gambar 4c ). Untuk mengatasi hal ini, langkah pencucian tambahan disertakan dalam protokol pewarnaan (Gambar S4 ). Hal ini berhasil mengurangi pewarnaan latar belakang dan disertakan dalam semua pewarnaan berikutnya menggunakan anti-TCRαβ. Untuk menentukan apakah penambahan anti-TCRαβ tak berlabel dalam proporsi lebih tinggi akan mencapai pengikatan saturasi, campuran 500 atau 1500 ng anti-TCRαβ tak berlabel dengan 500 ng anti-TCRαβ-PE (masing-masing 50% atau 25% berlabel) dititrasi seperti di atas (Gambar 4a ). Meskipun campuran berlabel 50% dan 25% tampaknya mencapai pewarnaan plateau, populasi TCRαβ + lebih baik dipisahkan dari latar belakang oleh campuran yang mengandung 50% antibodi berlabel (Gambar 4d,e ). Untuk memverifikasi pewarnaan plateau dan memilih konsentrasi optimal campuran anti-TCRαβ berlabel 50% untuk percobaan mendatang, sel dari 3 donor sehat diwarnai dengan seri pengenceran 2 kali lipat dari campuran 50% sebanyak 63–1000 ng (Gambar 3b ). Tidak terdapat perbedaan signifikan dalam MFI populasi TCRαβ+ antara 1000 dan 500 ng ( p = 0,0760, t = 3,417, df = 2) atau antara 500 dan 250 ng ( p = 0,1006, t = 2,910, df = 2). Oleh karena itu, saturasi TCRαβ dicapai pada 500 ng/uji menggunakan campuran 250 ng antibodi berlabel PE dan 250 ng antibodi tak berlabel.

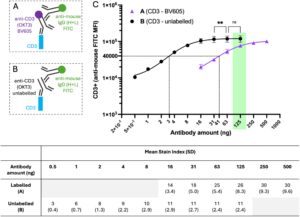
Untuk mereplikasi alur kerja di atas untuk anti-CD3 mAb (OKT3), sel dari 1 donor diwarnai dengan 16 hingga 2500 ng per 100 μL anti-CD3 tak berlabel yang dideteksi dengan antibodi sekunder anti-mouse-IgG (H + L)-FITC (Gambar S5 ). Karena pewarnaan plateau diamati untuk seluruh rentang konsentrasi ini, rangkaian pengenceran anti-CD3 tak berlabel diulang dengan 3 donor pada 0,5–125 ng/uji (Gambar 5c ). Tidak ada perbedaan signifikan dalam MFI populasi CD3 + antara 125 dan 63 ng ( p = 0,4013, t = 1,057, df = 2), yang menunjukkan saturasi tercapai pada rentang konsentrasi ini untuk OKT3 tak berlabel. Untuk memperkirakan pengurangan aktivitas OKT3 setelah konjugasi, anti-CD3-BV605 dititrasi dari 16 hingga 250 ng pada sel dari tiga donor, kemudian dideteksi dengan anti-mouse-IgG (H + L)-FITC (Gambar 5a,c ). Kurva sigmoidal disesuaikan dengan data, dan pada MFI terinterpolasi sebesar 40.000, konsentrasi anti-CD3–BV605 dan anti-CD3 tak berlabel masing-masing adalah 41,4 ng (34,8–48,8 ng 95% CI) dan 3,0 ng (2,1–4,0 ng 95% CI). Nilai-nilai ini menunjukkan pengurangan aktivitas antibodi sebesar 13,9 kali lipat (12,2–16,3 95% CI) untuk mAb terkonjugasi BV605 relatif terhadap mAb tak berlabel. Untuk mengonfirmasi hilangnya aktivitas yang nyata pada OKT3 mAb terkonjugasi BV605 dibandingkan dengan mAb tak terkonjugasi, uji kompetisi dilakukan. Sejumlah OKT3 tak berlabel yang berbeda ditambahkan ke 250 ng OKT3 terkonjugasi BV605 dan sel diwarnai untuk flow cytometry. Ketika hanya 0,2% antibodi tak berlabel ditambahkan ke anti-CD3–BV605, MFI BV605 pada sel CD3 + berkurang hingga 72,6% dari kontrol (Tabel 2 ). Hasil ini mengonfirmasi bahwa konjugasi OKT3 oleh BV605 mengakibatkan hilangnya aktivitas pengikatan CD3 yang besar. Meskipun terjadi kehilangan ini, OKT3 mAb terkonjugasi BV605 masih merupakan reagen yang berguna untuk menggerakan sel T karena fluoresensinya yang tinggi ketika digunakan pada konsentrasi yang direkomendasikan secara komersial.
| Ab yang tidak berlabel ditambahkan ke 250 ng berlabel Ab (ng) | LKM | % fluoresensi |
|---|---|---|
| angka 0 | 123.266 orang | 100.0 |
| 0.5 | 89.531 | 72.6 |
| 1 | 82.134 orang | 66.6 |
| 5 | 72.806 orang | 59.1 |
| 12.5 | 35.518 orang | 28.8 |
| 25 | 16.680 orang | 13.5 |
| 250 | 7488 | 6.1 |
Catatan: OKT3 yang tidak berlabel ditambahkan ke 250 ng anti-CD3–BV605 dan MFI BV605 pada sel CD3 + ditentukan. % fluoresensi dihitung sebagai 100 × MFI (anti-CD3 yang tidak berlabel)/MFI (tanpa anti-CD3 yang tidak berlabel).
3.5 Konsentrasi Jenuh Anti-CD3 Dapat Dicapai Dengan Rasio 9:1 Format Berlabel dan Tidak Berlabel pada 250 Ng/Uji
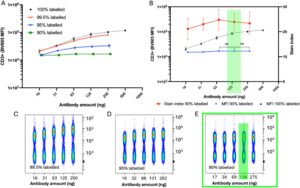
Untuk menentukan apakah penambahan sejumlah kecil OKT3 yang tidak berlabel ke dalam OKT3 berlabel BV605 akan mencapai saturasi pengikatan, 1 ng antibodi yang tidak berlabel ditambahkan ke 250 ng anti-CD3-BV605 dan dilakukan seri pengenceran 2 kali lipat antara 16 dan 250 ng. Dengan mempertimbangkan hilangnya aktivitas antibodi anti-CD3–BV605 secara substansial dibandingkan dengan format yang tidak berlabel, kami beralasan bahwa campuran antibodi harus mengandung proporsi Ab yang berlabel jauh lebih besar daripada Ab yang tidak berlabel. Namun campuran yang mengandung 99,5% anti-CD3 berlabel tidak mencapai pewarnaan plateau, jadi selanjutnya 12,5 ng dan 25 ng anti-CD3 yang tidak berlabel ‘dicampurkan’ ke dalam 250 ng anti-CD3-BV605, menghasilkan campuran antibodi berlabel 95% dan 90% yang dititrasi pada 2 donor sehat (Gambar 6a,c–e ). Dengan campuran yang mengandung 90% anti-CD3 berlabel, tidak ada perbedaan signifikan dalam MFI populasi CD3 + antara 275 dan 138 ng ( p = 0,9465, t = 0,08430, df = 1) atau 38 dan 69 ng ( p = 0,9539, t = 0,07257, df = 1) (Gambar 6b,e ). Oleh karena itu dengan ‘menambahkan’ 10% OKT3 yang tidak berlabel ke anti-CD3-BV605 pada konsentrasi akhir 125 ng/uji, saturasi pengikatan dapat dicapai sambil mempertahankan sinyal fluoresensi yang dapat diidentifikasi dengan jelas dari BV605.
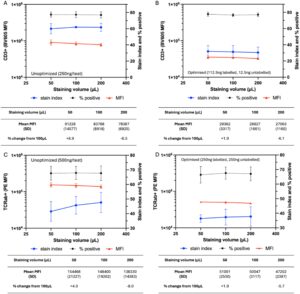
Untuk menunjukkan dampak yang berkurang dari variasi eksperimen pada pembacaan MFI ketika antigen diwarnai pada saturasi, sel dari tiga donor diwarnai dalam berbagai volume uji (50-200 μL) dari jumlah antibodi jenuh dan sub-jenuh (ng) anti-TCRαβ dan anti-CD3. Seperti yang diharapkan, pewarnaan dalam volume uji 200 μL (yaitu, pada konsentrasi 2 kali lipat lebih rendah daripada yang diuji dalam eksperimen yang dirinci di atas) secara konsisten menghasilkan MFI terendah untuk semua kondisi uji. Sebaliknya, MFI sel CD3 + yang diwarnai dengan anti-CD3-BV605 sub-jenuh (100% berlabel) (250 ng/uji) meningkat sebesar 8,9% dalam volume uji 50 μL (yaitu, pada konsentrasi 2 kali lipat lebih tinggi dari sebelumnya) dibandingkan dengan volume uji standar 100 μL (Gambar 7a ). Sebaliknya, perbedaan dalam MFI antara volume pewarnaan 50 dan 100 μL hanya 1,9% ketika pewarnaan dilakukan dengan anti-CD3 jenuh (90% berlabel) (112,5 ng berlabel, 12,5 ng tidak berlabel), sementara pengenceran 2 kali lipat pada 200 μL masih menghasilkan MFI yang secara signifikan lebih rendah (Gambar 7c ). MFI sel TCRαβ + yang diwarnai dengan anti-TCRαβ berlabel 100% adalah 4,0% lebih tinggi dalam volume pewarnaan 50 μL dibandingkan dengan 100 μL (500 ng/uji). Perbedaan ini berkurang menjadi 1,9% ketika anti-TCRαβ berlabel 50% (250 ng berlabel, 250 ng tidak berlabel) digunakan (Gambar 6b–d ). Oleh karena itu, perbedaan dalam volume pewarnaan sel memiliki dampak yang lebih kecil pada MFI ketika sel diwarnai pada konsentrasi jenuh, seperti yang dicapai melalui penerapan alur kerja yang dijelaskan.
4 Diskusi
Di sini kami mendokumentasikan alur kerja yang memungkinkan antibodi yang tersedia secara komersial yang dijual pada konsentrasi non-saturasi untuk digunakan dalam kondisi saturasi. Prinsip dasarnya adalah bahwa saturasi dapat dicapai dengan cara yang hemat biaya dengan menggunakan campuran mAb berlabel yang mahal dan tidak berlabel yang lebih murah. Kami menggunakan TCRαβ (IP26) dan CD3 (OKT3) sebagai contoh untuk menunjukkan penerapan metode ini. Baik IP26 maupun OKT3 tidak mencapai saturasi pada 2 kali lipat di atas konsentrasi yang direkomendasikan secara komersial. Konsentrasi di atas 1000 ng/tes untuk TCRαβ-PE dan 500 ng/tes untuk CD3-BV605 tidak diuji. Namun, konsentrasi ini akan membutuhkan 20 μL antibodi untuk digunakan per tes dan tidak layak secara eksperimental ketika volume pewarnaan yang mengandung hingga 10 antibodi tambahan hanya 100 μL. Campuran 500 ng/uji anti-TCRαβ (250 ng berlabel PE dan 250 ng tidak berlabel) dan 125 ng/uji anti-CD3 (112,5 ng berlabel BV605 dan 12,5 ng tidak berlabel) mampu mencapai saturasi sambil mempertahankan sinyal fluoresensi yang mudah dibedakan.
Baik antigen TCRαβ maupun CD3 diekspresikan pada membran sel, dengan rasio sinyal terhadap derau yang tinggi dicapai pada sel-sel yang hidup. Sebaliknya, penerapan alur kerja ini pada pewarnaan antigen intraseluler atau nuklir dapat menjadi rumit karena pewarnaan latar belakang yang tinggi yang sering diamati dengan flow cytometry intraseluler. Dalam kasus seperti itu, mungkin tidak mungkin untuk mencapai rasio sinyal terhadap derau yang dapat diterima pada konsentrasi jenuh untuk antigen intraseluler [ 26 ]. Selain itu, pengenalan antibodi yang tidak berlabel ke dalam koktail pewarnaan mengurangi sinyal fluoresensi, sehingga teknik ini paling baik diterapkan pada mAb yang terkonjugasi dengan fluorofor terang dan/atau mendeteksi antigen yang diekspresikan secara tinggi. Mungkin tidak ada persyaratan untuk menerapkan alur kerja ini dan mencapai saturasi dalam kasus ketika mAb hanya digunakan untuk mengidentifikasi dan mengendalikan populasi sel yang diinginkan, karena pergeseran kecil dalam MFI dapat dengan mudah diakomodasi dalam analisis berikutnya.
Alur kerja yang dijelaskan di sini juga dapat diterapkan pada sitometri massa, di mana antibodi dikonjugasikan ke ion logam berat, bukan fluorofor. Karena konjugasi internal lebih umum dilakukan untuk reagen sitometri massa, banyak lab mungkin sudah memiliki akses ke bentuk terkonjugasi dan tak terkonjugasi dari mAb yang sama. Kedua antigen yang diperiksa di sini menunjukkan pola ekspresi bimodal atau ‘on-off’, menyederhanakan identifikasi populasi positif dan negatif. Pendekatan alternatif dalam sitometri massa, khususnya untuk antigen yang tidak menghasilkan sinyal yang sangat tinggi, adalah menambahkan populasi PBMC kontrol berkode batang ke setiap sampel eksperimen sebelum pewarnaan, lalu membandingkan MSI sampel eksperimen menggunakan rasio MSI sampel eksperimen terhadap MSI kontrol untuk setiap campuran yang diwarnai. Hal ini menghindari pengurangan sinyal keseluruhan.
Alur kerja ini mungkin tidak sesuai untuk antigen yang diekspresikan sebagai kontinum, misalnya CD45RO pada sel T [ 27 , 28 ]. Meskipun di luar cakupan penelitian saat ini, kelayakan penerapan metode ini pada flow cytometry intraseluler, mass cytometry, atau antigen tanpa ekspresi bimodal harus dinilai dalam penelitian mendatang. Pertimbangan tambahan adalah bahwa melakukan inkubasi selama 16 jam telah terbukti meningkatkan sinyal pewarnaan dan mengurangi latar belakang jika dibandingkan dengan inkubasi 30 menit yang umum [ 29 ]. Dengan demikian, waktu inkubasi yang lebih lama harus diuji untuk menentukan apakah ini dapat meningkatkan resolusi penanda ketika antibodi yang tidak berlabel ‘ditambahkan’ ke antibodi yang berlabel.
Untuk antibodi komersial yang mencapai saturasi, volume yang direkomendasikan sering kali adalah 5 μL/tes. Dalam kasus sitometri berdimensi tinggi, mungkin tidak mungkin untuk menggabungkan sejumlah besar antibodi pada volume ini atau lebih besar dan masih tetap berada dalam volume pewarnaan standar. Antibodi yang tidak berlabel sering kali dijual pada konsentrasi yang jauh lebih tinggi (500 μg/mL) daripada antibodi yang berlabel (50–100 μg/mL), sehingga volume spike-in yang ditentukan sangat kecil. Mempertimbangkan contoh-contoh yang disajikan di sini, total volume campuran CD3 dan TCRαβ berlabel dan tidak berlabel yang diperlukan untuk satu tes masing-masing adalah 2,55 dan 3 μL. Lebih jauh lagi, ketika digunakan pada konsentrasi yang direkomendasikan secara komersial, sinyal dari fluorofor mungkin sangat tinggi, yang memerlukan tingkat kompensasi yang tinggi untuk mengoreksi spillover emisi fluoresensi. Strategi “spike-in” dapat meningkatkan kejelasan pewarnaan dengan mengurangi jumlah kompensasi yang diperlukan. Pertimbangan lebih lanjut adalah bahwa pewarna polimer, khususnya pewarna Brilliant Violet, dapat mengagregasi dan mendistorsi sinyal fluoresensi jika digunakan bersama-sama dalam konsentrasi besar [ 29 , 30 ]. Karena interaksi antara pewarna sebanding dengan konsentrasi antibodi yang terikat polimer, penggunaan konsentrasi antibodi yang lebih rendah mengurangi agregasi dan meningkatkan kejelasan sinyal [ 29 ]. Dengan demikian, alur kerja ini juga dapat diterapkan pada klon yang mencapai saturasi pada konsentrasi yang direkomendasikan secara komersial tetapi terkonjugasi dengan pewarna polimer yang sangat terang atau tandem untuk mengurangi jumlah polimer dan mencegah agregasi. Sebagai alternatif, buffer komersial seperti Super Bright Complete Staining Buffer (Thermo Fisher) dan Brilliant Stain Buffer (BD Biosciences) dapat digunakan untuk mencegah interaksi polimer-polimer.
Perbedaan dalam aktivitas pengikatan antara format berlabel dan tidak berlabel dari OKT3 dan IP26 diperkirakan dengan perhitungan perubahan lipatan antara kurva titrasi seperti yang dideteksi oleh anti-mouse-IgG (H + L) FITC. Perubahan lipatan dengan interval kepercayaan 95% dihitung pada nilai MFI yang dipilih untuk jatuh pada bagian “linier” paralel dari kurva, di mana estimasi paling akurat; estimasi pengukuran di dekat dataran tinggi atau garis dasar kurva sigmoidal menghasilkan margin kesalahan yang lebar [ 31 ]. Dengan demikian, nilai MFI untuk sekunder terkonjugasi FITC ditetapkan pada 40.000 untuk OKT3 dan 10.000 untuk IP26. Analisis ini mengungkapkan hilangnya aktivitas pengikatan yang besar untuk konjugat anti-CD3-BV605. Saat ini tidak jelas apakah ini spesifik lot antibodi, khusus untuk konjugasi dengan BV605, atau umum diamati setelah konjugasi fluorofor OKT3. Untuk alasan ini, setiap vial antibodi baru harus dititrasi dan diperiksa silang terhadap vial sebelumnya yang digunakan dalam pengerjaan yang dijelaskan di sini untuk mengendalikan setiap perubahan spesifik lot dalam aktivitas antibodi. Selain itu, campuran massal antibodi berlabel dan tidak berlabel dengan jumlah pengujian yang diperlukan harus disiapkan saat merencanakan serangkaian eksperimen besar untuk mengurangi variasi antar-eksperimen karena kesalahan pipet. Faktor-faktor di luar kondisi pewarnaan, seperti sitometer itu sendiri, juga dapat memengaruhi pembacaan MFI pada hari tertentu. Dengan demikian, kontrol batch harus digunakan untuk mengoreksi variasi antar-batch saat menggunakan metode ini [ 14 ]. Kondisi pewarnaan, seperti suhu dan waktu inkubasi, harus dijaga agar tetap konsisten di seluruh batch.
Alur kerja yang dijelaskan di sini cocok untuk kalkulasi antar-sampel dari ekspresi relatif yang dilakukan di laboratorium kami. Flow cytometry juga dapat digunakan untuk kuantifikasi absolut jumlah antibodi yang terikat per sel, dan oleh karena itu kepadatan antigen pada permukaan sel [ 32 ]. Metode umum adalah dengan menggunakan kit BD QuantiBrite, di mana manik-manik dengan jumlah PE yang diketahui dijalankan pada sitometer dan kurva standar dibuat. Ini memungkinkan jumlah PE yang terikat untuk diinterpolasi dari MFI PE pada sel tertentu. Namun metode ini terbatas karena hanya memungkinkan untuk analisis ekspresi di saluran PE, mengasumsikan sifat fluoresensi manik-manik dan sel adalah sama, dan memiliki masalah dengan variabilitas lot pada konjugat antibodi-PE [ 33 ]. Alur kerja ‘spike-in’ kami tidak dapat diterapkan untuk kuantifikasi antigen tetapi berguna ketika tujuannya adalah untuk membandingkan MFI dari penanda atau penanda yang diinginkan antara sampel.
Variasi alami dalam volume pewarnaan dimodelkan dengan mengubah volume pewarnaan secara sengaja. Sementara pewarnaan pada konsentrasi jenuh berhasil mengurangi variasi dalam pembacaan MFI antara volume pewarnaan 50 dan 100 μL, kehati-hatian harus dilakukan untuk memastikan konsistensi dalam aspirasi sampel sehingga sisa buffer pencuci tidak mengencerkan koktail antibodi. Data awal juga menunjukkan bahwa variasi yang luas dalam jumlah sel tidak memengaruhi MFI. Perlu dicatat bahwa tidak ada percobaan yang dijelaskan di sini yang melibatkan penggunaan anti-TCRαβ dan anti-CD3 dalam campuran pewarnaan yang sama, karena pengikatan OKT3 memblokir IP26. Ketika pewarnaan bersama untuk TCRαβ dan CD3 diperlukan, klon anti-CD3 yang berbeda seperti UCHT1 harus dipilih. Namun, metode ini dapat diterapkan pada beberapa antigen dalam panel yang sama jika tidak ada interaksi antara antibodi dalam koktail pewarnaan.
5 Kesimpulan
Kami menyajikan alur kerja “spike-in” untuk mencapai pewarnaan antibodi jenuh dari antigen permukaan yang melimpah dengan pola ekspresi bimodal untuk analisis sitometri aliran. Campuran antibodi berlabel dan tidak berlabel dioptimalkan untuk memastikan pewarnaan plateau yang dapat direproduksi dari setiap sampel individual, yang memungkinkan estimasi akurat ekspresi relatif antar sampel. Penerapan alur kerja ini untuk perbandingan ekspresi biomarker akan memberikan tingkat reproduktifitas yang tidak dapat dijamin saat menggunakan konsentrasi antibodi berlabel sub-jenuh.
